2. 广西中医药大学, 广西 南宁 530001
2. Guangxi University of Chinese Medicine, Nanning 530001, China
杧果Mangifera indica L.(俗称芒果)为漆树科(Aceraceae)杧果属Mangifera L. 热带常绿大乔木,其分布广泛,世界有70多个国家生产芒果,年产量近2.0×107 t,其中我国年产量1.0×106 t。杧果鲜食或加工后产生大量的果核,果核中的核仁约占杧果总质量的20%左右[1, 2],但杧果核仁常被废弃,未得到有效利用。杧果核仁具有补肾、祛肾寒的功效,用于肾虚、肾寒、腰腿痛、疝气和睾丸炎等症[3]。近年来研究表明,杧果核仁具有抑菌止泻[4]、抗氧化[2]、抗炎[5]等药理作用。基于杧果核仁具有补肾、祛肾寒功效,而肾阳虚与弱精症密切相关,且临床上常用补肾阳中药治疗弱精症,前笔者通过实验证实了杧果核仁具有治疗弱精症的作用[6]。为进一步明确其活性成分,本实验从杧果核仁95%乙醇提取物的二氯甲烷萃取物和正丁醇萃取物中分离得到9个化合物,分别鉴定为维生素E(vitamin E,1)、没食子酸甲酯(methyl gallate,2)、山柰酚(kaempferol,3)、槲皮素(quercetin,4)、3,4-O-异丙基莽草酸(3,4-O-isopropylidene shikimic acid,5)、5-羟基-4-氧代吡喃-2-羧酸(5-hydroxy-4-oxopyran-2-carboxylic acid,6)、阿魏酸(ferulic acid,7)、异槲皮苷(isoquercitrin,8)、1,2,3,4,6-五-O-没食子酰葡萄糖(1,2,3,4,6-penta-O-galloylglucose,9)。其中化合物1、3~6、8为首次从杧果核仁中分离得到,化合物1、7、9在体外能增加弱精症大鼠的精子活力和精子存活率。
1 仪器与材料Yanaco MP-S3显微熔点测定仪(日本Yanaco公司),Bruker AM-400 MHz型核磁共振光谱仪(瑞士Bruker公司),QTRAP型串联四极杆线性离子阱质谱仪(美国AB SCIEX公司),CMIS型精子质量分析系统(上海北昂医疗技术有限公司)。
柱色谱用硅胶(100~200目,青岛海洋化工厂),Sephadex LH-20型凝胶(Amersham Pharmacia Biotech AB),化学试剂均为分析纯。雷公藤多苷片(批号20120501,黄石飞云制药有限公司),五子衍宗丸(批号130155,云南腾药制药股份有限公司)。“台式”培养液:以NaCl 8.0 g、KCl 0.2 g、CaCl2 0.2 g、NaHCO3 1.0 g、MgCl2 0.1 g、NaH2PO4 0.05 g和葡萄糖1.0 g,加重蒸馏水至1 000 mL配制。杧果核仁各单体化合物,均分别以“台式”培养液配制成40和80 μmol/L的浓度;五子衍宗丸以“台式”培养液配制成40 μmol/L的浓度。
药材采自广西百色市(2012年7月),经四川医科大学庄元春副教授鉴定为杧果Mangifera indica L. 的干燥核仁。标本(20120709)保存于四川医科大学药用植物标本库。
Wistar大鼠,体质量(200±20)g,雄性,由四川医科大学实验动物中心提供,实验动物许可证号SYXK(川)2013-065。
2 提取与分离取杧果核仁10.4 kg,加95%乙醇回流提取,每次2 h,提取4次,收集提取液,浓缩至无乙醇味,得乙醇浸膏2.58 kg。取1.5 kg乙醇浸膏,加适量水混悬,混悬液依次以石油醚、二氯甲烷、醋酸乙酯、正丁醇萃取,回收溶剂,得到石油醚萃取物47.6 g、二氯甲烷萃取物58.9 g、醋酸乙酯萃取物285.3 g、正丁醇萃取物53.5 g。取二氯甲烷萃取物50.0 g,先用石油醚-丙酮(50∶1→2∶1)梯度洗脱,合并相同组分,得3个流分Fr. 1~3;再以氯仿-甲醇(20∶1→1∶1)梯度洗脱,合并相同组分,得3个流分Fr. 4~6。Fr. 1(5.0 g)进行硅胶柱色谱,以石油醚- 丙酮(30∶1→10∶1)梯度洗脱,经反复硅胶柱色谱及重结晶得到化合物1(50 mg)、2(20 mg)。Fr. 2(7.0 g)进行硅胶柱色谱,以石油醚-丙酮(20∶1→5∶1)梯度洗脱,再经反复硅胶柱色谱及重结晶,得到化合物3(50 mg)、4(30 mg)。Fr. 4(5.0 g)进行硅胶柱色谱,以氯仿-甲醇(10∶1→3∶1)梯度洗脱,经反复硅胶柱色谱及重结晶,得到化合物5(30 mg)、6(20 mg)、7(20 mg)。
正丁醇萃取物50.0 g经硅胶柱色谱分离,以氯仿-甲醇(20∶1→3∶2)梯度洗脱,相同部分合并,得5个流分Fr. 7~11。Fr. 9(2.0 g)进行硅胶柱色谱,以氯仿-甲醇(6∶1→2∶1)梯度洗脱,其中氯仿-甲醇(3∶1)部分再经Sephedax-LH 20凝胶柱色谱得化合物8(30 mg)和9(30 mg)。
3 结构鉴定化合物1:淡黄色油状物,mp 2~4 ℃,分子式为C29H50O2。ESI-MS m/z: 430 [M]+。1H-NMR (400 MHz, CDCl3) δ: 4.28 (1H, s, -OH), 2.60 (2H, t, J = 6.7 Hz, H-4), 2.20 (3H, s, H-7a), 2.10 (6H, s, H-5a, 8a), 1.81 (2H, m, H-3), 1.26 (3H, s, H-2a);13C-NMR (400 MHz, CDC13) 及 DEPT δ: 148.5 (C-9, C), 144.9 (C-6, C), 122.0 (C-8, C), 121.1 (C-7, C), 115.9 (C-5, C), 115.2 (C-10, C), 74.9 (C-2, C), 39.9 (C-1′, -CH2), 39.5 (C-11′, -CH2), 37.9 (C-3′, 7′, -CH2), 37.3 (C-5′, 9′, -CH2), 32.8 (C-4′, -CH), 32.7 (C-8′, -CH), 31.6 (C-3, -CH2), 27.9 (C-12′, -CH), 24.8 (C-2′, -CH2), 24.4 (C-10′, -CH2), 23.8 (C-2a, -CH3), 22.5 (C-12′a, -CH3), 22.4 (C-12′b, -CH3), 21.1 (C-6′, -CH2), 20.8 (C-4, -CH2), 19.8 (C-4′a, -CH3), 19.7 (C-8′a, -CH3), 12.2 (C-7a, -CH3), 11.8 (C-5a, -CH3), 11.3 (C-8a, -CH3)。以上数据与文献报道一致[7],故鉴定化合物1为维生素E。
化合物2:白色粉末(甲醇),mp 201~203 ℃,分子式为C8H8O5。ESI-MS m/z: 183 [M-H]−, 367 [2M-H]−。1H-NMR (400 MHz, CD3OD) δ: 3.71 (3H, s, -OCH3), 6.92 (2H, s, H-2, 6);13C-NMR (100 MHz, CD3OD) δ: 166.9 (-C=O), 145.8 (C-3, 5), 138.8 (C-4), 119.7 (C-1), 108.9 (C-2, 6), 51.7 (-OCH3)。以上数据与文献报道一致[8],故鉴定化合物2为没食子酸甲酯。
化合物3:黄色无定形粉末(甲醇),mp 274~276 ℃,分子式为C15H10O6。ESI-MS m/z: 285 [M-H]−。1H-NMR (400 MHz, DMSO-d6) δ: 12.47 (1H, s, 5-OH), 8.02 (2H, d, J = 8.6 Hz, H-2′, 6′), 6.92 (2H, d, J = 8.6 Hz, H-3′, 5′), 6.41 (1H, d, J = 2.0 Hz, H-8), 6.17 (1H, d, J = 2.0 Hz, H-6);13C-NMR (100 MHz, DMSO-d6) δ: 175.9 (C-4), 163.9 (C-7), 160.7 (C-9), 159.2 (C-4′), 156.2 (C-5), 146.8 (C-2), 135.7 (C-3), 129.6 (C-2′, 6′), 121.7 (C-1′), 115.5 (C-3′, 5′), 103.1 (C-10), 98.2 (C-6), 93.5 (C-8)。以上数据与文献报道一致[9],故鉴定化合物3为山柰酚。
化合物4:黄色粉末(甲醇),mp 314~316 ℃,分子式为C15H10O7。ESI-MS m/z: 325 [M+Na]+, 303 [2M+H]+。1H-NMR (400 MHz, CD3OD) δ: 12.47 (1H, s, 5-OH), 7.65 (1H, s, H-2′), 7.51 (1H, d, J = 8.5 Hz, H-6′), 6.86 (1H, d, J = 8.5 Hz, H-5′), 6.40 (1H, s, H-8), 6.17 (1H, s, H-6);13C-NMR (100 MHz, CD3OD) δ: 156.2 (C-2), 147.73 (C-5), 146.9 (C-2), 135.7 (C-3), 175.9 (C-4), 160.8 (C-5), 98.3 (C-6), 163.9 (C-7), 93.4 (C-8), 160.7 (C-9), 103.1 (C-10), 122.0 (C-1′), 115.1 (C-2′), 145.1 (C-3′), 147.7 (C-4′), 115.7 (C-5′), 120.1 (C-6′)。以上数据与文献报道一致[10],故鉴定化合物4为槲皮素。
化合物5:片状结晶(石油醚-丙酮),mp 174~176 ℃,分子式为C10H14O5。ESI-MS m/z: 213 [M-H]−, 427 [2M-H]−。1H-NMR (400 MHz, C5D5N) δ: 7.35 (1H, t, J = 1.7 Hz, H-2), 5.02 (1H, m, H-3), 4.51 (1H, t, J = 6.4 Hz, H-4), 4.42 (1H, td, J = 4.4, 6.8 Hz, H-5), 3.20 (1H, dd, J = 4.4, 17.4 Hz, H-6a), 2.84 (1H, dd, J = 6.9, 17.4 Hz, H-6b), 1.49 (3H, s, -CH3), 1.44 (3H, s, -CH3);13C-NMR (100 MHz, C5D5N) δ: 169.4 (-COOH), 132.3 (C-1), 134.2 (C-2), 109.3 (C-8), 78.7 (C-4), 73.2 (C-3), 68.3 (C-5), 30.8 (C-6), 28.4 (10-CH3), 26.2 (9-CH3)。以上数据与文献报道一致[11],故鉴定化合物5为3,4-O-异亚丙基莽草酸。
化合物6:无色片状结晶(甲醇),mp 210~212 ℃,分子式为C6H4O5。ESI-MS m/z: 157 [2M+H]+, 179 [M+Na]+。1H-NMR (400 MHz, DMSO-d6) δ: 6.91 (1H, s, H-3), 8.17 (1H, s, H-6);13C-NMR (100 MHz, DMSO-d6) δ: 116.1 (C-3), 140.4 (C-6), 147.6 (C-5), 152.4 (C-2), 173.8 (C-4), 160.8 (-COOH)。以上数据与文献报道一致[12],故鉴定化合物6为5-羟基- 4-氧代吡喃-2-羧酸。
化合物7:白色针状结晶(甲醇),mp 170~172 ℃,分子式为C10H10O4。ESI-MS m/z: 195 [2M+H]+, 177 [M-OH]+。1H-NMR (400 MHz, DMSO-d6) δ: 7.46 (1H, d, J = 15.9 Hz, H-3′), 6.34 (1H, d, J = 15.9 Hz, H-2′), 7.26 (1H, s, H-2), 7.06 (1H, dd, J = 8.1, 1.7 Hz, H-6), 6.77 (1H, d, J = 8.1 Hz, H-5), 3.79 (3H, s, -OCH3);13C-NMR (100 MHz, DMSO-d6) 及DEPT δ: 167.9 (C-1′, -COOH), 149.1 (C-3, C), 147.9 (C-4, C), 144.4 (C-3′, -CH), 125.8 (C-1, C), 122.7 (C-6, -CH), 115.7 (C-2′, -CH), 115.6 (C-5, -CH), 110.3 (C-2, -CH), 55.7 (-OCH3)。以上数据与文献报道一致[13],故鉴定化合物7为阿魏酸。
化合物8:黄色粉末(甲醇),mp 223~225 ℃,分子式为C21H20O12。ESI-MS m/z: 464 [M]+, 463 [M-H]−, 927 [2M-H]−。1H-NMR (400 MHz, CD3OD) δ: 12.6 (1H, s, 5-OH), 9.26 (1H, s, 7-OH), 7.57 (1H, d, J = 2.5 Hz, H-2′), 7.56 (1H, d, J = 6.0 Hz, H-5′), 6.83 (1H, dd, J = 6.0, 2.5 Hz, H-6′), 6.39 (1H, d, J = 2.0 Hz, H-8), 6.18 (1H, d, J = 2.0 Hz, H-6), 5.46 (1H, d, J = 7.6 Hz, H-1″);13C-NMR (100 MHz, CD3OD) δ: 156.3 (C-2), 133.3 (C-3), 177.5 (C-4), 161.3 (C-5), 98.7 (C-6), 164.1 (C-7), 93.5 (C-8), 156.2 (C-9), 104.0 (C-10), 121.6 (C-1′), 121.2 (C-2′), 144.8 (C-3′), 148.5 (C-4′), 116.2 (C-5′), 115.2 (C-6′), 100.8 (C-1″), 74.1 (C-2″), 76.5 (C-3″), 69.9 (C-4″), 77.6 (C-5″), 60.9 (C-6″)。以上数据与文献报道一致[14],故鉴定化合物8为异槲皮苷。
化合物9:浅棕色粉末(甲醇),mp 256~258℃,分子式为C41H32O26。ESI-MS m/z: 939 [M-H]−。1H-NMR (400 MHz, CD3COCD3) δ: 6.33 (1H, d, J = 8.4 Hz, Glc-H-1), 5.92 (1H, t, J = 9.6 Hz, Glc-H-3), 5.46 (1H, t, J = 9.6 Hz, Glc-H-4), 5.43 (1H, t, J = 9.6 Hz, Glc-H-2), 4.43 (1H, m, Glc-H-5), 4.30 (2H, d, J = 8.0 Hz, Glc-H-6), 6.77, 6.82, 6.85, 6.92, 6.97 (各 2H, s, galloyl-H-2, 6);13C-NMR (100 MHz, CD3COCD3) 及DEPT δ: 92.3 (Glc-C-1, -CH), 71.1 (Glc-C-2, -CH), 72.6 (Glc-C-3, -CH), 68.2 (Glc-C-4, -CH), 72.8 (Glc-C-5, -CH), 61.9 (Glc-C-6, -CH2), 164.5, 164.7, 165.0, 165.5,166.0 (各1C, galloyl-C-7, -COO), 118.0, 118.3, 118.7, 119.2, 119.6 (各1C, galloyl-C-1, C), 109.3, 109.5, 109.6, 109.8, 110.2 (各2C, galloyl-C-2, 6, -CH), 145.6, 145.7, 145.8, 146.0, 146.4 (各2C, galloyl-C-3, 5, C), 139.0, 139.2, 139.4, 140.0, 140.3 (各1C, galloyl-C-4, C)。以上数据与文献报道一致[15],故鉴定化合物9为1,2,3,4,6-五-O-没食子酰葡萄糖。
4 成分活性研究 4.1 方法 4.1.1 弱精症动物模型的建立40只雄性Wistar大鼠,在同一环境室温下,自由进食饮水。随机分为正常对照组20只和模型组20只。模型组均每日ig 20 mg/kg雷公藤多苷片,对照组ig等体积生理盐水(0.02 mL/g),连续30 d。30 d后,模型组和正常对照组各随机抽取10只大鼠,立即处死,摘除左侧睾丸和附睾。睾丸用4%多聚甲醛固定,常规石蜡包埋,HE染色,光镜下观察睾丸组织病理改变。附睾剪碎于2.0 mL“台式”培养液中,在30 ℃恒温水浴中保温10 min,待精子充分游离后,血球计数板计数,用“台式”培养液将精液稀释至2×107个/mL。移取10 μL在CMIS型精子质量分析系统检测精子密度、精子存活率、精子活力和精子畸形率。
4.1.2 活性成分筛选弱精症大鼠模型建立后,立即处死模型组和对照组各剩余的10只大鼠,分别摘取附睾,附睾按“4.1.1”项方法处理后,以“台式”培养液稀释至2×107个/mL。正常大鼠每例精子悬液1份(30 μL/份),弱精症大鼠每例精子悬液20份(30 μL/份),分别移入21只离心管中。实验设正常对照组、模型组、阳性对照组及实验组。①正常对照组(1份):30 μL“台式”培养液与30 μL正常大鼠精子悬液混匀;②模型组(1份):30 μL“台式”培养液与30 μL弱精症大鼠精子悬液混匀;③阳性对照组(1份):30 μL浓度为40 μmol/L的五子衍宗丸与30 μL弱精症大鼠精子悬液混匀;④实验组(总计18份):实验组为杧果核仁单体化合物(1~9),各单体化合物均设2个不同浓度组(40和80 μmol/L),各取30 μL分别与30 μL弱精症大鼠精子悬液混匀。各离心管置于37 ℃恒温水浴箱培养孵育0、1、2 h,移取10 μL,用CMIS型精子质量分析系统检测精子活力和精子存活率。
4.1.3 统计学方法数据以x±s表示,实验数据应用SPSS 13.0统计软件进行统计处理。采用单因素方差分析进行统计学分析,组间比较采用Dunnett’s t检验。
4.2 结果 4.2.1 雷公藤多苷造模效果评价睾丸病理切片显示对照组睾丸细胞学无异常改变,曲细精管内精子发生完全,各级生精细胞排列规整;模型组生精上皮变薄,睾丸曲细精管管腔变大,多数管腔内可见空泡变性的生精细胞或巨核细胞,各级生精细胞和精子数量明显减少,部分管腔生精细胞全部破坏,偶见残存的支持细胞,间质内可见水肿或结缔组织增生(图 1)。附睾中的精子显示:与正常对照组相比,模型组的精子密度、精子存活率、精子活力都较低,精子畸形率较高,均有显著差异(P<0.01,表 1)。睾丸病理切片及附睾精子质量表明,ig大鼠雷公藤多苷,可造成大鼠睾丸受损,精子发生、成熟障碍以及附睾精子质量降低,可成功建立弱精症大鼠模型。
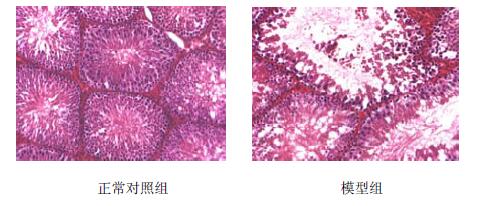 | 图 1 睾丸组织比较 (HE染色,×200) Fig.1 Comparison on testicular tissue (HE dying, × 200) |
| 表 1 精子质量比较 Table 1 Comparison on sperm quality |
与正常对照组比较,模型组的精子活力和精子存活率在0、1、2 h都较低,并有极显著性差异(P<0.01)。模型组、正常对照组、阳性对照组及各实验组的精子活力、存活率均随时间延长而减弱。在0 h,实验组各化合物和模型组比较,精子活力和存活率均没有差异(P>0.05)。在1、2 h,40和80 μmol/L的化合物1(维生素E)、7(阿魏酸)及9(1,2,3,4,6-五-O-没食子酰葡萄糖)与模型组比较,精子活力和存活率均增加,并有显著差异(P<0.05、0.01),并随浓度增加,精子活力和精子存活率增加。其他化合物在1和2 h,与模型组比较,精子活力和存活率均无差异(P>0.05)。结果见表 2和3。
| 表 2 化合物对弱精症大鼠体外精子活力的影响 Table 2 Effect of compounds on sperm motility of asthenospermia rats in vitro |
| 表 3 化合物对弱精症大鼠体外精子存活率的影响 Table 3 Effect of compounds on sperm survival rate of asthenospermia rats in vitro |
从杧果核仁中分离得到9个化合物,化合物1、3~6、8为首次从杧果核仁中分离得到。
弱精症是导致男性不育的主要原因,其发病机制为睾丸及附睾受损造成的精子发生、成熟障碍[16]。雷公藤多苷作用于精子细胞的变态期,抑制晚期精子细胞精核蛋白转化和精子在附睾中的成熟,损伤睾丸生精细胞,导致精子生成发生障碍,并影响精子的活力,因此常采用雷公藤多苷建立弱精症动物模型[17, 18]。本实验睾丸病理切片及附睾精子质量分析表明,连续30 d给予大鼠每日ig 20 mg/kg雷公藤多苷,不仅可造成大鼠睾丸、附睾功能损伤,而且可造成大鼠附睾中的精子密度、精子存活率和精子活力降低,精子畸形率升高,揭示了本实验通过ig大鼠雷公藤多苷,成功建立了雄性大鼠弱精症模型。实验结果还表明,化合物1、7和9在体外能使弱精症大鼠的精子活力和精子存活率增加,为杧果核仁临床治疗弱精症提供了科学依据。
| [1] | Abdalla A E M, Darwish S M, Ayad E H E, et al. Egyptian mango by-product 1. Compositional quality of mango seed kernel [J]. Food Chem, 2007, 103(4): 1134-1140. |
| [2] | Maisuthisakul P, Gordon M H. Antioxidant and tyrosinase activity of mango seed kernel by product [J]. Food Chem, 2009, 117(2): 332-341. |
| [3] | 内蒙古蒙药材标准 [S]. 1987. |
| [4] | Kaur J, Rathinam X, Kasi M, et al. Preliminary investigation on the antibacterial activity of mango (Mangifera indica L: Anacardiaceae) seed kernel [J]. Asian Pac J Trop Med, 2010, 3(9): 707-710. |
| [5] | Das P C, Das A, Mandal S, et al. Anti-inflammatoryand antimicrobial activities of the seed Kernel of M. indica [J]. Fitoterapia, 1989, 60(3): 235-240. |
| [6] | 袁叶飞. 农作物废弃物芒果核仁的化学成分及药理作用研究 [D]. 百色: 广西百色国家农业科技园区, 2013. |
| [7] | 张茂娟, 刘 冰, 安彦峰, 等. 白钩藤的化学成分研究 [J]. 中草药, 2014, 45(2): 175-180. |
| [8] | 周荣光, 杨兆祥, 王 金, 等. 扁桃叶的化学成分研究 [J]. 天然产物研究与开发, 2012, 24(9): 1217-1219. |
| [9] | 周兴栋, 程 淼, 余绍福, 等. 锡叶藤的化学成分研究[J]. 中草药, 2015, 46(2): 185-188. |
| [10] | 宁德生, 闫晓旭, 黄思思, 等. 壮药鸡尾木的化学成分及其细胞毒活性 [J]. 中国药学杂志, 2015, 40(4): 686-690. |
| [11] | 谢春锋, 李子静, 曲建博, 等. 毛地钱和多形带叶苔化学成分研究 [J]. 中国药学杂志, 2007, 42(22): 1706-1708. |
| [12] | Kingsbury C A, Cliffton M, Looker J H, et al. Carbon-13 nuclear magnetic resonance spectra of kojic acid and other 4-pyrone derivatives [J]. J Org Chem, 1976, 16(41): 2777-2780. |
| [13] | 靳 鑫, 时圣明, 张东方, 等. 穿心莲化学成分的研究(II) [J]. 中草药, 2014, 45(2): 164-169. |
| [14] | 周艳林, 赵 旭, 华 娟, 等. 金沙藤化学成分及其抗氧化活性评价研究 [J]. 中华中医药杂志, 2013, 28(5): 1392-1396. |
| [15] | 刘春丽, 关小丽, 李典鹏, 等. 龙眼壳中化学成分的研究 (I) [J]. 广西植物, 2014, 34(2): 167-169. |
| [16] | Anca B, Razvan S, Demetra S, et al. Methylation pattern of methylene tetrahydrofol-ate reductase and small nuclear ribonucleoprotein polypeptide N promoters in oligoa-sthenospermia: a case-control study [J]. Reprod Biomed Online, 2014, 28(2): 225-231. |
| [17] | Wang T S, Huang J L, Wu D L, et al. Effect of Wuziyanzong Pill on sperm quality and calcium ion content in oligoasthenospermia rats [J]. J Tradit Chin Med, 2012, 32(4): 631-635. |
| [18] | 王秋萍, 王桐生, 龙子江, 等. 五子衍宗丸对少弱精症模型大鼠精子质量及睾丸组织的影响 [J]. 中成药, 2011, 33(10): 1796-1797. |
 2015, Vol. 46
2015, Vol. 46


