2. 江苏省中药高效给药系统工程技术研究中心, 江苏 南京 210023;
3. 南京市中药微丸产业化工程技术研究中心, 江苏 南京 210029
2. Jiangsu Engineering Research Center for Efficient Delivery System of TCM, Nanjing 210023, China;
3. Nanjing Engineering and Technology Research Center for TCM Pellets, Nanjing 210029, China
上消化道出血系指屈氏韧带以上的消化道,包括食管、胃、十二指肠或胰、胆等病变引起的出血;胃空肠吻合术后的空肠病变出血亦属此范围。上消化道出血是临床常见的急重症,具有发病率高、病死率高等特征。消化性溃疡出血是上消化道出血的主要原因,急性胃黏膜病变为上消化道出血的另一重要病因,尤其对老年患者,亦是出血致死亡的重要原因[1]。中医药治疗上消化道出血多从“止血、消瘀、宁血、补血”入手[2],根据胃热型、肝火旺盛型、气滞型、气虚型、血瘀型的证型分类,分别以清热、泻肝、理气、益气、化瘀为主要治疗原则进行治疗[3],具有复发率低、副作用小、溃疡愈合质量高等特点[4]。
三七、白及为中医药治疗上消化道出血常用药,两者配伍,可用于各种病因所致上消化道出血[3, 6-7]。三七和白及的主要有效成分分别是三七总皂苷和白及多糖[8]。文献报道[9],三七皂苷能改善内皮功能,降低血小板表面活性,防止其大量黏附、聚集,从而改善微循环、抗血栓;可通过促进胃黏膜壁细胞从激活状态向静息状态转化来保护胃黏膜[10]。白及多糖含有极性基团,与胃酸反应后可形成胶体,黏附在胃壁上,可有效隔离胃酸和胃蛋白酶,促进胃损伤部位的修复和愈合[11-12];白及甘露聚糖具有抗炎[13]、止血、促进内源性前列腺素释放的作用[14],可通过抗炎镇痛、刺激胃黏膜合成及释放内源性前列腺素、缩短凝血时间,使末梢血管内的红细胞凝集形成血栓而局部止血,最终发挥胃黏膜保护作用[15]。
然而,三七与白及配伍发挥药效与其成分的药动学是否有关联,两者配伍在药动学方面是否有影响,这些问题还不明确,需进一步研究以明确其发挥药效的作用基础。本研究采用无水乙醇致大鼠急性胃黏膜损伤模型模拟上消化道出血,建立UPLC-MS/MS同时测定10种三七皂苷成分的分析方法,研究三七总皂苷配伍白及多糖后对其药动学的影响,为临床两药合用提供参考。
1 材料 1.1 仪器SHIMADZU UPLC XR超快速液相色谱仪(日本岛津公司,包括高压输液单元、全自动进样器、柱温箱);AB SCIEX QTRAP 5500型质谱仪(加拿大AB SCIEX公司),Analyst 1.5软件。MicroCL 21R微量离心机(美国Thermo Scientific公司),微量移液器(上海科华实验系统有限公司),Milli-Q Synthesis 108超纯水仪(美国密理博公司),万分之一天平(上海精密科学仪器有限公司),百万分之一天平(HAUG GmbH & CO. KG)。
1.2 药品与试剂三七总皂苷(南京景竹生物科技有限公司,总皂苷质量分数80%,批号JZ130805);白及多糖(西安斯诺特生物技术有限公司,多糖质量分数90%,批号SNT20151216);人参皂苷Rb1、Rf、Rc、Rg1、CK、Rh1(R)、Rg3(R)、Rg2对照品(吉林大学有机化学教研室提供,质量分数>98%);人参皂苷Rd和地高辛对照品(HPLC检测质量分数≥98%,成都普菲德生物科技有限公司);甲酸铵(质量分数97%,北京百灵威科技有限公司);三七皂苷R1对照品(中国食品药品检定研究院,批号110745-200617);乙腈(色谱纯,德国Merck公司);甲醇(色谱纯,江苏汉邦科技有限公司);重蒸水(Milli-Q Synthesis 108超纯水仪制得)。
1.3 实验动物SD健康大鼠,雄性,体质量180~220 g,由上海杰思捷实验动物有限公司提供,动物合格证号SCXK(沪)2013-0006。
2 方法与结果 2.1 液相条件色谱柱为Sepax Technologies(150 mm×2.1 mm,3 μm);流动相为1 mmol/L的甲酸铵水溶液(A)-乙腈(B);梯度洗脱程序为0.01~1 min,10% B;1~2 min,10%~40% B;2~5 min,40%~60% B;5~6 min,60%~98% B;6~7.5 min,98% B;7.5~8 min,98%~100% B;体积流量0.3 mL/min;柱温35 ℃;进样量2 μL。
2.2 质谱条件AB SCIEX 5500三重四级杆串联质谱仪,离子化方式为电喷雾离子化(ESI);负离子模式,采用多反应监测(MRM);气帘气为275.8 kPa(40 psi);碰撞气为Medium;喷雾电压为−4 500 V;雾化温度为500 ℃;雾化气为344.75 kPa(50 psi);辅助气为379.225 kPa(55 psi)。待测物与内标检测参数见表 1。
|
|
表 1 待测物与内标的MRM检测参数 Table 1 MRM detection parameters of analystes and internal standards |
2.3 溶液的配制 2.3.1 供试药液的配制
精密称取三七总皂苷适量,加入适量水混匀,配制成40 mg/mL的溶液,再精密量取已配好的三七总皂苷溶液适量,加入适量白及多糖,配制成含白及多糖104 mg/mL的混合溶液(混合溶液中三七总皂苷40 mg/mL)。
2.3.2 混合对照品溶液的配制分别取人参皂苷CK、人参皂苷Rh1 (R)、人参皂苷Rg1、人参皂苷Rg2、人参皂苷Rg3 (R)、人参皂苷Rf、人参皂苷Rd、人参皂苷Rc、人参皂苷Rb1、三七皂苷R1对照品适量,精密称定,置于5 mL量瓶中,甲醇定容至刻度,得质量浓度分别为人参皂苷CK(2 055 μg/mL)、人参皂苷Rh1 (R)(1 379.0 μg/mL)、人参皂苷Rg1(552.8 μg/mL)、人参皂苷Rg2(485.0 μg/mL)、人参皂苷Rg3 (R)(1 003.5 μg/mL)、人参皂苷Rf(501.3 μg/mL)、人参皂苷Rd(736.0 μg/mL)、人参皂苷Rc(627.8 μg/mL)、人参皂苷Rb1(517.6 μg/mL)、三七皂苷R1(1 013.0 μg/mL)的储备液。分别移取适量对照品储备液至10 mL量瓶中,用初始流动相乙腈-1 mmol/L甲酸铵水溶液(1∶9)稀释至刻度,并逐步稀释得系列质量浓度的混合对照品溶液及质控溶液,4 ℃保存,备用。
2.3.3 内标溶液的配制取地高辛对照品适量,精密称定,置于10 mL量瓶中,用甲醇稀释至刻度,得0.8 mg/mL的储备液。取内标储备液适量置于10 mL量瓶中,用初始流动相乙腈-1 mmol/L的甲酸铵水溶液(1∶9)稀释至刻度,得质量浓度为0.8 μg/mL的内标溶液,4 ℃保存,备用。
2.4 给药与样品采集雄性SD大鼠12只,随机分为三七总皂苷组(P组)、三七总皂苷配伍白及多糖组(BP组),每组6只,适应性喂养1周之后,所有大鼠禁食不禁水12 h,P组ig三七总皂苷400 mg/kg,BP组ig白及多糖与三七总皂苷混合溶液1 040 mg/kg。分别于给药后0.083、0.25、0.5、0.75、1、1.5、2、3、4、6、8、12、24、48、72、96 h大鼠眼眶取血约0.2 mL,置于肝素化的离心管中,6 000 r/min离心7 min,上清置于另一离心管中,−80 ℃保存备用。
2.5 血浆样品处理取100 μL血浆样品置于1.5 mL EP管中,加入0.8 μg/mL的内标地高辛溶液10 μL,涡旋30 s,再加入1 mL甲醇,涡旋3 min,12 000 r/min离心5 min,取出800 μL上清,置于冷冻离心浓缩机中挥干,进样前加入100 μL流动相复溶,14 000 r/min离心10 min,取2 μL上清进样。
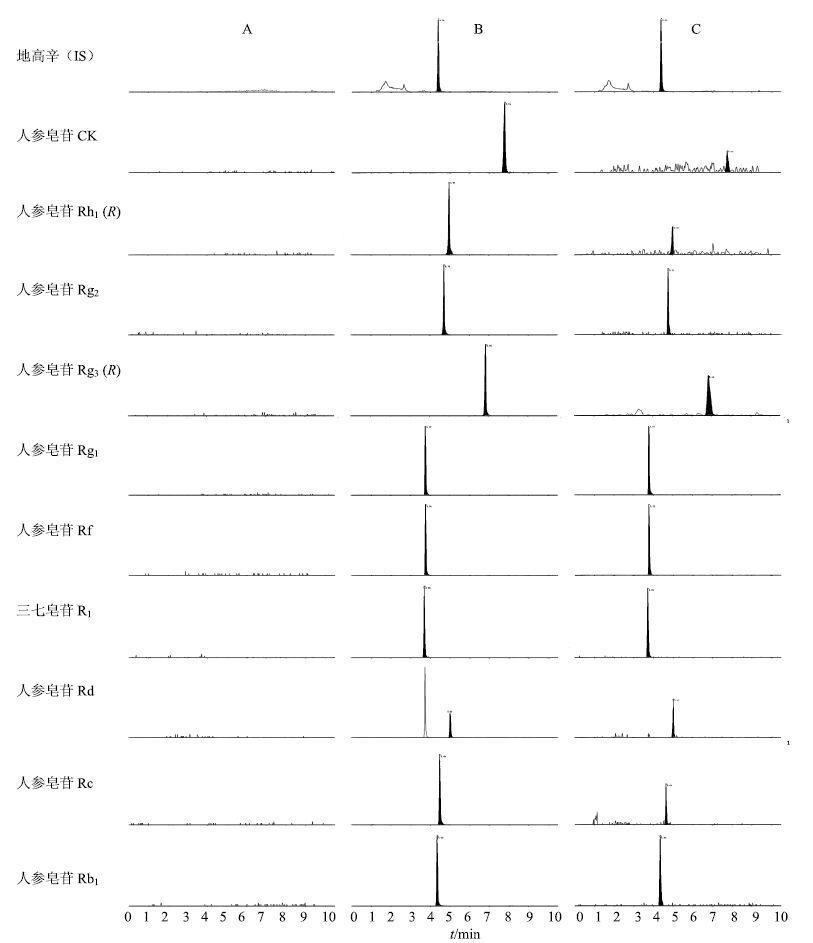
2.6 方法学考察 2.6.1 专属性实验分别取空白血浆、空白血浆加入10种待测物及内标物,大鼠给药后10 min血浆样品按“2.5”项下血浆样品处理方法处理后进样,利用UPLC-MS/MS进行检测,考察方法专属性,结果见图 1。从图中可以看出,各待测三七总皂苷中的单体成分、内标与血浆中的内源性物质之间没有干扰,分析方法专属性高,均能实现良好的分离。
2.6.2 线性关系及定量下限分别精密吸取不同质量浓度的混合对照品溶液10 μL置于离心管中,离心浓缩至干,加入大鼠空白血浆100 μL,按照“2.5”项下血浆样品处理方法进行处理,进样分析。以血浆中各待测物质量浓度为横坐标(X),以待测物与内标的峰面积比值为纵坐标(Y),用加权(W=1/X2)最小二乘法进行线性回归,得到10种成分的线性范围、回归方程及相关系数,见表 2。结果表明各成分在各自的线性范围内线性关系良好。
|
A-大鼠空白血浆 B-空白血浆+对照品+内标 C-大鼠灌胃给药后血浆样品 A-Blank rat plasma B-Blank rat plasma mixed with ingredients and digaoxin C-plasma samples of rats administrated with drugs 图 1 大鼠血浆中各成分典型MRM色谱图 Fig.1 Typical MRM chromatograms of components in rat plasma |
|
|
表 2 线性关系及定量下限 Table 2 Linearity and lower limits of quantitation |
2.6.3 精密度与准确度
根据标准曲线范围选择低、中、高3个质量浓度,低质量浓度为标准曲线最低点2.5倍,中质量浓度为标准曲线中间一个浓度,高质量浓度为标准曲线最高点的80%,用空白血浆配制成相应质量浓度的血浆样品,每个质量浓度配制6份。按照“2.5”项方法处理后进样测定,计算批间、批内精密度和准确度,结果见表 3。结果表明各成分批内与批间精密度在2.19%~12.40%,准确度在86.28%~112.12%,符合生物样品测定要求。
|
|
表 3 各成分在大鼠血浆中批内与批间精密度和准确度 (n = 6) Table 3 Intra- and inter-batch precision and accuracy consequences of components in rat plasma (n = 6) |
2.6.4 提取回收率
分别精密吸取低、中、高3个质量浓度的混合对照品溶液10 μL置于离心管中,离心浓缩至干,加入大鼠空白血浆100 μL,每个质量浓度6份,按“2.5”项下方法处理后进样测定。另取空白血浆100 μL,先按“2.5”项下血浆处理方法离心浓缩至干后,分别加入低、中、高3个质量浓度的混合对照品溶液10 μL,离心浓缩至干,加入100 μL初始流动相复溶,离心后进样分析,以空白血浆处理前与处理后2种方法峰面积比值计算提取回收率,见表 4。结果表明各成分在大鼠血浆中的提取回收率在73.79%~112.60%。
|
|
表 4 各成分在大鼠血浆中的提取回收率与基质效应 (n = 6) Table 4 Recovery and matrix effects of components in rat plasma (n = 6) |
2.6.5 基质效应
取空白血浆100 μL,按“2.5”项下血浆处理方法离心浓缩至干后分别加入低、中、高3个质量浓度的混合对照品溶液10 μL,每个质量浓度6份,离心浓缩至干,加入100 μL初始流动相复溶,离心后进样分析。同时配制相同质量浓度的以初始流动相为溶剂的混合对照品溶液直接进样分析,空白血浆中加入对照品所得峰面积与对照品溶液所得峰面积之比,即为基质效应,见表 4,结果表明各成分在血浆中的基质效应在87.25%~109.93%。
2.6.6 稳定性试验按“2.5”项下方法制备高、中、低3个质量浓度对照血浆样品各6份,对对照血浆样品进行在室温放置12 h,−20 ℃放置4周,反复冻融3次以及在4 ℃的进样器内放置24 h的稳定性考察,见表 5。结果表明各成分在室温放置12 h、−20 ℃放置4周、反复冻融3次以及在4 ℃的进样器内放置24 h稳定性均良好。
|
|
表 5 各成分在大鼠血浆中的稳定性考察 (n = 6) Table 5 Stability of components in rat plasma (n = 6) |
2.7 血药浓度测定
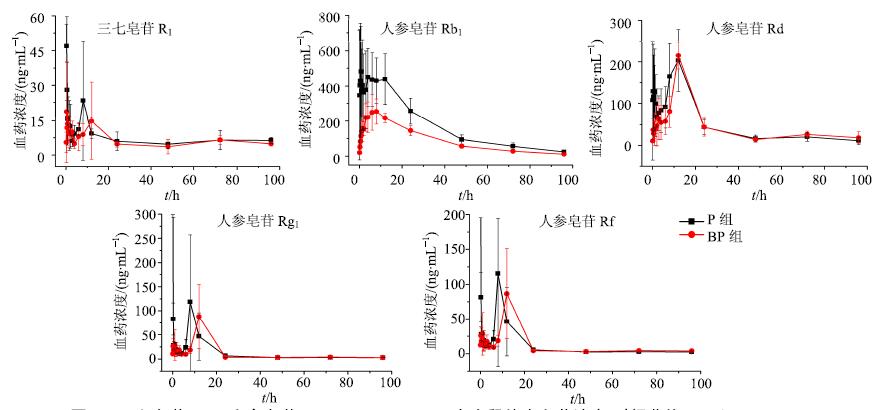
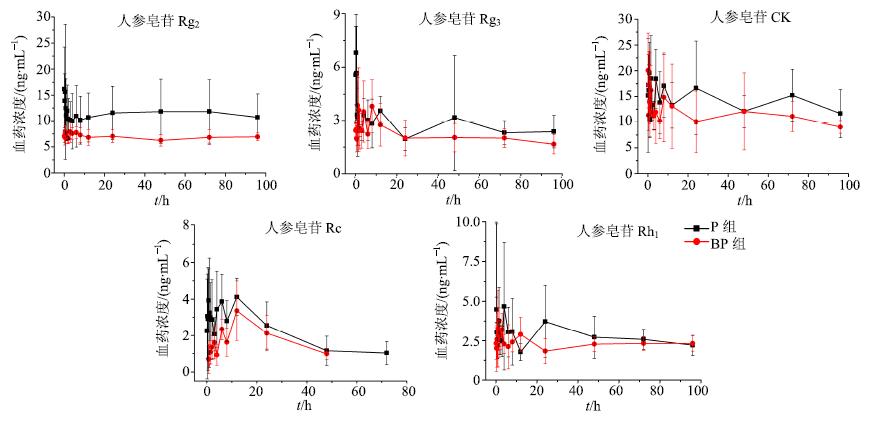
将不同时间点的血浆样品按“2.5”项下血浆样品处理方法处理后,按“2.1”和“2.2”项下方法进样分析,测定10个待测物质量浓度,以血药浓度对时间作图,得到各成分的血药浓度-时间曲线。结果见图 2和3,可见BP组各成分血药浓度普遍偏低。
|
图 2 三七皂苷R1及人参皂苷Rb1、Rd、Rg1、Rf在大鼠体内血药浓度-时间曲线 (x±s±s,n = 5) Fig.2 Mean plasma concentration-time profiles of notoginsenoside R1 and ginsenosides Rb1,Rd,Rg1,Rf in rats (x±s,n = 5) |
|
图 3 人参皂苷Rg2、Rg3、CK、Rc、Rh1在大鼠体内血药浓度-时间曲线 (x±s±s,n = 5) Fig.3 Mean plasma concentration-time profiles of ginsenosides Rg2,Rg3,CK,Rc,and Rh1 in rats (x±s,n = 5) |
2.8 药动学参数比较
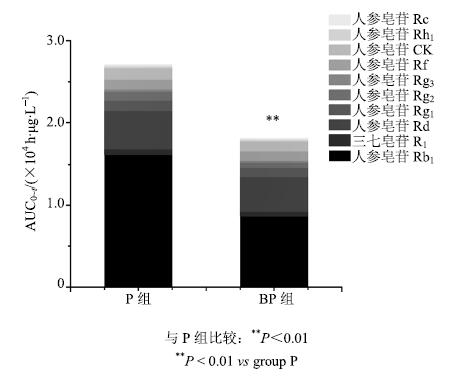
采用DAS 3.0药动学软件处理2组大鼠给药后不同时间的血浆药物浓度数据,求算各成分的药动学参数。结果见表 6。各组不同成分之间AUC及10种成分的总AUC比较结果表明,与P组相比,BP组人参皂苷Rb1的AUC显著降低(P<0.01)。三七皂苷R1及人参皂苷Rd、Rg1、Rf、CK、Rc、Rh1(R)、Rg2、Rg3(R)的AUC有所降低,但无显著性差异。10种成分总AUC(图 4)为P组>BP组,差异显著(P<0.01)。与P组相比,BP组人参皂苷Rg1的Cmax降低(P<0.05)。且BP组各成分tmax普遍延迟,其中人参皂苷Rg1、Rb1、Rf显著延迟(P<0.01),人参皂苷Rg2和三七皂苷R1延迟(P<0.05)。
|
|
表 6 各成分药动学参数 (x±s±s,n = 5) Table 6 Pharmacokinetic parameters of 10 components (x±s,n = 5) |
|
与P组比较:**P<0.01 **P < 0.01 vs group P 图 4 P组与BP组各成分总AUC比较 Fig.4 Total AUC of each component in P and BP groups |
3 讨论
本实验建立的UPLC-MS/MS法同时测定三七中10种皂苷成分的分析方法符合生物样品测定要求,适于三七总皂苷大鼠血浆样品的测定。该药动学实验个体差异较大,但从总体结果来看,白及多糖普遍降低三七皂苷的AUC,推迟tmax,降低Cmax,说明白及多糖可能增加了三七皂苷在胃肠道的暴露水平,从而增加治疗上消化道出血的疗效。白及多糖是由甘露糖和葡萄糖聚合而成,糖基比例约4∶1,有3种糖苷键,其中多个β-1,4-甘露二糖可形成螺旋结构而成囊[16],结合本实验室前期研究pH值对白及多糖成胶性的影响,发现随着pH值增大,白及多糖流动性减低,当pH值达到10时,白及多糖可倒置不流动,且白及多糖具有非牛顿流体的性质[17],说明白及多糖可在胃内黏附[18],肠道成胶,从而滞留在胃肠道中。而三七皂苷在胃酸条件下不稳定,在肠道中主要以被动扩散方式吸收[19-20],肠道菌群可加速其代谢成原人参三醇(PPT型)或原人参二醇(PPD)型结构[21]。因此白及多糖推迟了三七总皂苷的达峰时间,但减少了三七总皂苷的口服吸收,结合文献资料,原因可能有2种:(1)白及多糖的囊状结构包裹了三七总皂苷,使三七总皂苷释放减慢,且白及多糖在胃内具有黏附性,延长三七皂苷在胃内的滞留时间,增加了三七总皂苷在胃酸作用下的水解;(2)白及多糖具有凝胶特性[22],延长了三七皂苷在肠道内的滞留时间,影响肠道菌群,使三七皂苷在肠道内迅速代谢完全,成为PPT型或PPD型结构。
白及多糖具有药辅两用的特性,作为药物,可收敛止血、消肿生肌,多用于肺胃出血,可与特殊生物位点的酶发生反应或与特定细胞的糖受体有很强的亲和力,从而发挥止血、保护胃黏膜、促进伤口愈合、抗菌消炎、抗氧化抗肿瘤的药理作用[23];作为药用辅料,可用于药物递送载体和伤口愈合敷料,并具有很强的凝胶性能,低毒,可生物降解,生物相容性高[24]。三七化瘀止血、活血定痛,对各种出血证均有效,具有止血不留瘀、祛瘀不伤正的特点。白及多糖可降低三七皂苷的口服吸收,说明白及多糖作为药用辅料与三七皂苷配伍,没有提高三七皂苷的口服吸收;作为药物与三七皂苷配伍,可协同发挥止血活血的药效。文献报道,白及多糖可作为新型胃黏附材料、结肠靶向材料[25]、巨噬细胞靶向材料[26],用于控释、缓释制剂的制备,但关于白及多糖的在胃肠道黏附是否有选择性或特异性,并没有总体研究。因此,可以从白及多糖的作用于胃肠道的材料性质及作为药物对胃肠道功能的影响两方面进一步研究其影响药物吸收的原因。
| [1] | 沈爱萍, 余莲英, 沙卫红, 等. 3042例上消化道出血患者的临床特点分析及护理[J]. 护理学报, 2011, 18(2B):9–13. |
| [2] | 王仁强. 中医药治疗上消化道出血有关问题探讨[J]. 中国中医急症, 1996, 5(1):20–22. |
| [3] | 范建国, 程广勤. 上消化道出血辨证施治[J]. 中医临床研究, 2011, 3(23):114–115. |
| [4] | 杨迟. 三粉愈疡散对实验性胃溃疡的防治作用及其治疗机理研究[D]. 扬州:扬州大学, 2013. |
| [5] | 刘臣. 白及粉治疗上消化道出血48例[J]. 中国民间疗法, 2003, 11(3):48–49. |
| [6] | 杨海才, 马海波, 李琳琳. 白芨三七散治疗上消化道出血30例疗效观察[J]. 现代中西医结合杂志, 2001, 10(18):1771–1772. |
| [7] | 陈华良, 顾文芬. 三七白芨散治疗上消化道出血18例[J]. 中原医刊, 2004, 31(11):44. |
| [8] | Wang Z, Chen Y Y, Pan H J, et al. Saponin accumulation in flower buds of Panax notoginseng[J]. Chin Herb Med, 2015, 7(2): 179–184. DOI:10.1016/S1674-6384(15)60036-3 |
| [9] | 王阶, 许军, 衷敬柏, 等. 三七总苷对高黏血症患者血小板活化分子表达和血小板聚集的影响[J]. 中国中西医结合杂志, 2004, 24(4):312–316. |
| [10] | 王莹, 禇扬, 李伟, 等. 三七中皂苷成分及其药理作用的研究进展[J]. 中草药, 2015, 46(9):1381–1392. |
| [11] | 邓响潮, 李燕舞, 王汝俊. 三七总皂苷对应激大鼠胃黏膜损伤及胃壁细胞超微结构的影响[J]. 时珍国医国药, 2008, 19(9):2143–2145. |
| [12] | 王红英. 白及甘露聚糖抗胃溃疡及抗炎、镇痛作用的实验研究[J]. 浙江中医药大学学报, 2009, 33(1):119–121. |
| [13] | 刘莹, 崔炯莫, 李洪斌, 等. 白芨超微粉对大鼠实验性胃溃疡的影响[J]. 中草药, 2008, 39(3):397–400. |
| [14] | 吕小波, 黄春球, 武正才. 白及多糖对胃溃疡大鼠防治作用的实验研究[J]. 云南中医学院学报, 2012, 35(1):30–32. |
| [15] | 罗新根, 刘文庸, 张卫东, 等. 中药白及的化学成分及临床研究进展[J]. 药学实践杂志, 1999, 17(6):359–364. |
| [16] | 沈奇, 沈小青, 张阳阳, 等. 蒲公英绿原酸-白芨多糖包合物鉴定研究[J]. 食品科学, 2010, 31(9):83–85. |
| [17] | 程安媛. 新型胃粘附材料——白芨多糖的制备及膜粘附性体内外评价[D]. 重庆:重庆医科大学, 2008. |
| [18] | 韩旻. 三七总皂苷(PNS)口服吸收机理及W/O口服微乳的研究[D]. 上海:复旦大学, 2006. |
| [19] | Han B H, Park M H, Han Y N, et al. Degradation of ginseng saponins under mild acidic condition[J]. J Med Plant Res, 1982, 44(2): 146–149. |
| [20] | Sun K, Wang C S, Guo J, et al. Protective effects of ginsenoside Rb1, ginsenoside Rg1, and notoginsenoside R1 on lipopolysaccnaride-induced microcirculatory disturbance in rat mesentery[J]. Life Sci, 2007, 81(6): 509–518. DOI:10.1016/j.lfs.2007.06.008 |
| [21] | Luo Y, Diao H J, Xia S H, et al. A physiologically active polysaccharide hydrogel[J]. J Biomed Mater Res Part A, 2010, 94(1): 193–204. |
| [22] | Wang Y, Liu J J, Li Q, et al. Two natural glucomannan polymers, from Konjac and Bletilla, as bioactive materials for pharmaceutical applications[J]. Biotechnol Lett, 2015, 37(1): 1–8. DOI:10.1007/s10529-014-1647-6 |
| [23] | 悦随士, 高丛军, 王晓丽. 白及散剂治疗上消化道出血疗效观察[J]. 中国中医急症, 2002, 11(5):345–346. |
| [24] | 崔向磊. 白芨多糖的结肠生物可降解性与抗溃疡性结肠炎活性研究[D]. 苏州:苏州大学, 2012. |
| [25] | Dong L, Xia S H, Luo Y, et al. Targeting delivery oligonucleotide into macrophages by cationic polysaccharide from Bletilla striata successfully inhibited the expression of TNF-α[J]. J Controlled Release, 2009, 134(3): 214–220. DOI:10.1016/j.jconrel.2008.11.013 |
| [26] | Zhan X D, Jia L X, Niu Y M, et al. Targeted depletion of tumour-associated macrophages by an alendronate-glucomannan conjugate for cancer immunotherapy[J]. Biomaterials, 2014, 35(38): 10046–10057. DOI:10.1016/j.biomaterials.2014.09.007 |
 2017, Vol. 48
2017, Vol. 48


