2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001;
3. 中药提取精制新技术重点研究室, 江苏 连云港 222001
2. State Key Laboratory of Pharmaceutical Process New-teach for Chinese Medicine, Lianyungang 222001, China;
3. Key Laboratory for the New Technique Research of TCM Extraction and Purification, Lianyungang 222001, China
参蒲盆炎方由赤芍、虎杖、醋延胡索等10味中药组成,具有清热除湿、化瘀止痛之功效,主治湿热瘀结所致的腹痛、腹坠胀,慢性盆腔炎见上述证候者,临床疗效显著[1]。
浸膏干燥为中药制药过程中非常重要的一个环节,常用的干燥方式有板式减压干燥、喷雾干燥[2-3]、带式真空干燥、冷冻干燥等,在前期的研究中发现,采用不同的干燥方式得到的干膏中指标性成分变化不同[4-5],需进一步研究。
中药制剂过程中提取溶媒和工艺路线的改变,因为涉及到中药制剂的物质基础,一般被视为有“质的改变”[6];而浓缩、干燥和成型等工艺对中药制剂的质量和药效的影响往往被忽略[7-8]。本实验从主要指标成分量差异的角度,研究不同干燥工艺和条件对参蒲盆炎浸膏质量的影响,为综合评价参蒲盆炎颗粒的浸膏干燥工艺提供依据。
1 仪器与材料MTVBD01-04-01真空带式干燥机,上海朗脉科技有限公司,传送带长4 m,直径1 m;FZG-15型真空板式干燥机,常州宇通干燥设备有限公司;SODA-12型喷雾干燥机,上海大川原干燥设备有限公司;Aglient 1260型高效液相色谱仪,美国Aglient公司;BP211D型电子分析天平,德国Sartorius公司。对照品芍药苷(批号110736-201337,质量分数96.5%)、虎杖苷(批号111575-200502,质量分数100.0%)、延胡索乙素(批号110726-201213,质量分数99.9%)均购自中国食品药品检定研究院;参蒲盆炎颗粒浸膏,批号140901,江苏康缘药业股份有限公司;乙腈为色谱纯,水为超纯水,其他试剂均为分析纯。
2 结果与方法 2.1 浸膏的制备前期以处方中主要有效成分转移率、出膏率等作为指标,经单因素及正交试验优选的浸膏制备工艺为虎杖、醋延胡索加10倍量60%乙醇回流提取2次,每次1.5 h[9],滤过,得乙醇提取液,备用;赤芍、蒲公英等其余8味药材加10倍量水煎煮3次,每次1.5 h[10],滤过,滤液减压浓缩至相对密度为1.08~1.10(60 ℃)的清膏,加乙醇醇沉至乙醇终体积分数为60%,静置过夜,吸取醇沉上清液与乙醇提取液合并减压浓缩至相对密度为1.20~1.30(60 ℃),得参蒲盆炎颗粒浸膏。
2.2 不同干燥工艺样品的制备根据生产实际,取浸膏各5.0 kg,平行4份,以浸膏相对密度、干燥时间、干燥温度、真空度等为主要因素,分别考察常压干燥、板式减压干燥、带式真空干燥和喷雾干燥4种干燥方式对参蒲盆炎颗粒浸膏质量的影响。按表 1中不同的干燥工艺和参数设置,制得每种干燥方法下各5批样品,研细,密封,置干燥器中保存备用。
|
|
表 1 不同干燥方式的工艺参数和样品测定结果 Table 1 Preparation parameters and assaying results of samples prepared by different drying methods |
2.3 不同干燥工艺样品中含水量与指标成分测定 2.3.1 含水量测定
精密称取各干燥工艺和参数下经干燥所得干膏粉约3.0 g,按照《中国药典》2015年版一部附录Ⅸ H水分测定法中第一法进行测定,计算干膏含水量。
2.3.2 芍药苷、虎杖苷的测定[11](1)对照品溶液的制备:精密称取芍药苷、虎杖苷对照品适量,分别加甲醇制成质量浓度分别为芍药苷209.6 μg/mL、虎杖苷137.5 μg/mL的溶液,即得。
(2)供试品溶液制备:分别精密称取各试验组下的混合干膏粉约0.50 g,精密称定,置50 mL量瓶中,加50%甲醇定容至刻度,摇匀,即得。
(3)阴性供试品溶液制备:分别取缺赤芍及缺虎杖的其他各味药材,按“2.3.2(2)”项下制备方法分别制备缺赤芍、缺虎杖的阴性供试品溶液。
(4)色谱条件:Phenomenex Luna C18柱(250 mm×4.6 mm,5 μm),乙腈-0.1%磷酸水溶液(13:87)为流动相,检测波长230、306 nm,进样10 μL,柱温30 ℃。
2.3.3 延胡索乙素的测定[9](1)对照品溶液的制备:取延胡索乙素适量,精密称定,加甲醇制成含延胡索乙素102.7 μg/mL的对照品溶液。
(2)供试品溶液的制备:精密称取混合干膏约5 g,置50 mL量瓶中,加50%甲醇定容至刻度,摇匀,即得。
(3)阴性供试品溶液制备:取缺延胡索其他各味药材,按“2.3.3(2)”项下制备方法制备缺醋延胡索供试品溶液。
(4)色谱条件:Phenomenex Gemini C18柱(250 mm×4.6 mm,5 μm),以乙腈-磷酸钠缓冲盐(精密称取无水磷酸二氢钠6 g、十二水合磷酸氢二钠约2 g,加水1 000 mL使溶解,42:58)为流动相,检测波长为280 nm,体积流量1 mL/min,进样量10 μL,柱温30 ℃。
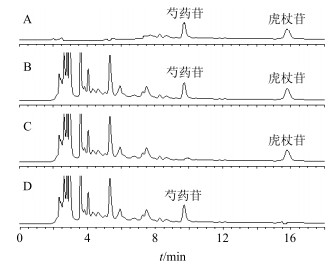
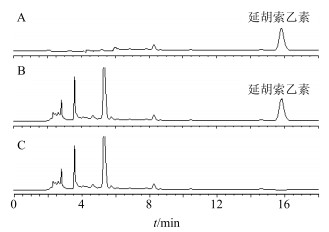
分别采用外标一点法计算干膏中芍药苷、虎杖苷、延胡索乙素量,色谱图见图 1、2。
|
图 1 芍药苷和虎杖苷混合对照品(A)、供试品(B)、缺赤芍阴性供试品(C)和缺虎杖阴性供试品(D)定量测定HPLC色谱图 Fig.1 HPLC of peoniflorin and polygonin mixed reference substances (A), sample (B), negative samples without Paeoniae Radix Rubra (C), and without Polygoni Cuspidati Rhizoma et Radix (D) |
|
图 2 延胡索乙素对照品(A)、供试品(B)和缺醋延胡索阴性样品(C)定量测定HPLC图 Fig.2 HPLC of tetrahydropulmatine reference substance (A), sample (B), and negative sample without Vinegar Corydalis Yanhusuo Radix (C) |
2.4 方法学考察结果
精密称取芍药苷、虎杖苷与延胡索乙素对照品适量,加甲醇分别制成每毫升含芍药苷1.048 mg、虎杖苷0.687 mg、延胡索乙素1.027 mg的溶液,作为储备液。分别精密量取储备液0.5、1、2、4、6、8 mL至10 mL量瓶中,加甲醇稀释至刻度,即得系列浓度对照品溶液。分别精密吸取各浓度混合对照品溶液10 μL注入高效液相色谱仪,以进样量为横坐标,峰面积平均值为纵坐标进行线性回归。求得芍药苷的线性方程为Y=10 176 X+415 410,r=0.999 7,表明芍药苷在52.4~838.4 μg/mL线性关系良好;虎杖苷的线性方程为Y=26 787 X+235 762,r=0.999 9,表明虎杖苷在34.4~549.6 μg/mL线性关系良好;延胡索乙素的回归方程为Y=6 516 X+1.967,r=0.999 6,表明延胡索乙素在51.35~821.60 μg/mL线性关系良好。精密度试验、重复性试验、稳定性试验与加样回收率试验均符合要求。
2.5 测定结果不同干燥工艺样品中含水量、芍药苷、虎杖苷与延胡索乙素量的测定结果见表 1。从各干燥品含水量及各成分测定结果可知,不同干燥工艺及参数下,各干燥品的含水量在3.68%~3.81%,差异很小;带式真空干燥和喷雾干燥所得样品的3种指标成分量较高,且相对稳定;板式减压干燥和常压干燥所得样品,随着干燥温度的升高,3种指标成分量均有下降趋势,100 ℃常压干燥样品指标成分量最低。
2.6 方差分析各组数据以x±s表示,采用SPSS 16.0统计软件对数据进行处理,采用One-way ANOVA法进行多组间比较,结果如表 2~4所示。
|
|
表 2 芍药苷最小显著差异法(LSD)和多重配对比较t检验法(Dunnett)多重比较结果(因变量为芍药苷质量分数) Table 2 LSD and Dunnett multiple coparison results with peoniflorin (dependent variable was paeoniflorin concentration) |
|
|
表 3 虎杖苷LSD和Dunnett多重比较结果(因变量为虎杖苷质量分数) Table 3 LSD and Dunnett multiple coparison results with polygonin (dependent variable as polygonin concentration) |
|
|
表 4 延胡索乙素LSD和Dunnett多重比较结果(因变量为延胡索乙素质量分数) Table 4 LSD and Dunnett multiple coparison results with tetrahydropulmatine (dependent variable as tetrahydropalmatine concentration) |
由表 2~4可见,根据Dunnett法比较,真空带式干燥样品中芍药苷、虎杖苷与延胡索乙素的量与参蒲盆炎颗粒浸膏相比,没有差别;喷雾干燥样品3种指标成分质量分数较参蒲盆炎颗粒浸膏略有下降,但没有显著差别;板式减压干燥和常压干燥样品3种指标性成分量较参蒲盆炎颗粒浸膏明显下降(P<0.05)。根据LSD法比较,板式减压干燥、常压干燥样品3种指标性成分量显著低于带式真空干燥、喷雾干燥样品(P<0.05),且常压干燥样品中指标性成分量显著低于板式减压干燥样品(P<0.05);而喷雾干燥样品中3种主要指标成分的量与带式真空干燥样品相比显著降低(P<0.05)。
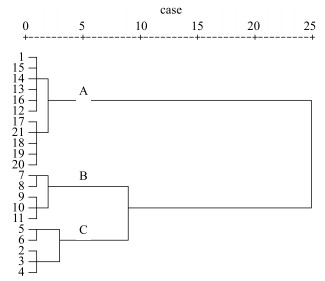
2.7 不同干燥工艺样品指标成分聚类分析采用SPSS 16.0统计软件对数据进行处理,以参蒲盆炎颗粒干膏中芍药苷、虎杖苷和延胡索乙素的量为指标,采用组平均(average distance between clusters)法对所测21个样品进行聚类分析,所有数据经过标准化处理[12],聚类方法采用组间连接法及平方欧式距离,结果见表 5、图 3。根据表 5和图 3可知,当分组闭值取聚合系数λ=1.277时,21个不同干燥方式和条件下参蒲盆炎颗粒干膏样品可以分成3组。
|
|
表 5 不同干燥方式样品的聚类过程 Table 5 Agglomeration schedule of samples by different drying methods |
|
图 3 不同干燥方式样品的聚类分析 Fig.3 Agglomeration analysis of samples by different drying methods |
A组:包括1、15、14、13、16、12、17、21、18、19、20,即参蒲盆炎颗粒浸膏、喷雾干燥和带式真空干燥品,当λ=0.128时,全部带式真空干燥样品与未经干燥处理的1号样品首先聚为一小类;当λ=0.590时,全部喷雾干燥样品与带式真空干燥样品聚为一类,提示尽管带式真空干燥与喷雾干燥条件相差很大,但对样品指标成分破坏均较小,具有一定的相似性。
B组:包括7、8、9、10、11,均是板式减压干燥样品,B组与A组在聚类树上的距离远,提示板式减压干燥样品3种指标成分量与带式真空干燥、喷雾干燥差异明显。
C组包括2、3、4、5、6,即常压干燥样品,提示常压下,干燥温度高低及时间长短对干燥样品中3种指标成分量影响差异不明显。
当λ=3.556时,C组与B组聚为一类,但在聚类树上距离较远,提示常压干燥对3种指标成分量的影响与板式减压干燥相比,也存在差异。
2.8 干燥工艺参数与样品指标成分量波动关系由上述结果可见,不同干燥工艺过程对样品指标成分量的影响不同,为了确定与干燥工艺参数相关性最大的成分,并以其为指标,更好地实现对于干燥工艺的评价,采用主成分分析(principal component analysis,PCA)法对干燥工艺过程进行分析,实现对干燥工艺过程的定量评价。
2.8.1 参蒲盆炎颗粒浸膏带式真空干燥样品将带式真空干燥得到的5个样品的芍药苷、虎杖苷、延胡索乙素含量数据作为变量输入SPSS 16.0统计软件,根据软件计算出的特征值(eigenvectors)和累计贡献率,列出由标准标量表达的各主成分的关系式。由PCA得到结果如表 6、7所示。
|
|
表 6 带式真空干燥样品PCA特征值与贡献率 Table 6 Eigenvalue and contribution rate of PCA in samples by belt vacuum drying |
|
|
表 7 带式真空干燥样品3种主成分系数矩阵 Table 7 Coefficient matrix of three principal components |
由PCA结果可知:主成分Z1代表了原信息的99.503%。Z1=0.996X1+0.998 X2+0.999 X3(X1=芍药苷质量分数、X2=虎杖苷质量分数、X3=延胡索乙素质量分数)。
由以上结果可知:对于主成分Z1,因为Z1的贡献率达到99.503%,对带式真空干燥工艺参数变化具有最大的贡献度,且X1~X3的系数均在0.99以上,提示带式真空干燥对各主要指标成分量的影响较为均衡。
2.8.2 参蒲盆炎颗粒浸膏喷雾干燥样品由PCA得到结果如表 8、9所示。由PCA得到,2个主成分Z1、Z2分别代表了原信息的94.984%、4.729%。Z1=0.951X1+0.983 X2+0.989 X3,Z2=0.310 X1-0.170 X2-0.129 X3(X1=芍药苷质量分数、X2=虎杖苷质量分数、X3=延胡索乙素质量分数)。
|
|
表 8 喷雾干燥样品PCA特征值与贡献率 Table 8 Eigenvalue and contribution rate of PCA in samples by spray drying |
|
|
表 9 喷雾干燥样品3种主成分系数矩阵 Table 9 Coefficient matrix of three principal components |
由以上结果可见:对于主成分Z1和Z2,因为Z1和Z2的贡献率总和达到99.713%,对于喷雾干燥工艺参数变化影响具有极大的贡献度,所以综合考虑主成分Z1和Z2;对于Z1,X1、X2、X3的系数均在0.95以上,芍药苷、虎杖苷和延胡索乙素质量分数对主成分Z1贡献度较大;对于Z2,X1的系数0.31,芍药苷质量分数对主成分的贡献度较大;由Z2的数据变化可见,喷雾干燥条件对芍药苷质量分数具有一定的影响。因此喷雾干燥过程对工艺参数变化比较敏感的化学组分是芍药苷、虎杖苷和延胡索乙素。
2.8.3 参蒲盆炎颗粒浸膏板式减压干燥样品由PCA得到结果如表 10、11所示。PCA结果表明,主成分Z1、Z2代表了原信息的98.648%、1.248%。Z1=0.987X1+0.997 X2+0.995 X3,Z2=0.158 X1-0.066 X2-0.091 X3(X1=芍药苷质量分数、X2=虎杖苷质量分数、X3=延胡索乙素质量分数)。
|
|
表 10 板式减压干燥样品PCA特征值与贡献率 Table 10 Eigenvalue and contribution rate of PCA in samples by plank decompression drying |
|
|
表 11 板式减压干燥样品3种主成分系数矩阵 Table 11 Coefficient matrix of three principal components |
由上述结果分析:对于主成分Z1和Z2,因为Z1、Z2的贡献率高达99.869%,对板式减压干燥工艺参数变化贡献度最大;由于Z1,X1、X2、X3的系数都在0.98以上,因此,芍药苷、虎杖苷和延胡索乙素量对于主成分Z1产生了主要影响;对于Z2,芍药苷量对主成分的贡献度较大。
故此,在板式减压干燥工艺中,受到影响较大的化学组分是芍药苷、虎杖苷和延胡索乙素,其量变化对主成分的贡献度最大。
2.8.4 参蒲盆炎颗粒浸膏常压干燥样品|
|
表 12 常压干燥样品PCA特征值与贡献率 Table 12 Eigenvalue and contribution rate of PCA in samples by drying under normal pressure |
|
|
表 13 常压干燥样品3种主成分系数矩阵 Table 13 Coefficient matrix of three principal components |
PCA结果表明,主成分Z1代表了原信息的99.043%。Z1=0.991 X1+0.996 X2+0.999 X3(X1=芍药苷质量分数、X2=虎杖苷质量分数、X3=延胡索乙素质量分数)。
对于主成分Z1,其贡献率高达99.043%,对常压干燥工艺具有极大的贡献度,且X1~X3的系数都非常高,3种指标成分的量均发生了较大变化,表明常压干燥对于参蒲盆炎颗粒中主要化学组分均产生了较明显的影响,亦即在相当的干燥条件下参蒲盆炎颗粒中主要化学组分均比较敏感。
3 讨论中药制剂浓缩干燥和成型过程不只是纯物理的蒸发、蒸馏或物料之间的简单混合,还存在氧化、还原、水解、聚合、异构化等一系列复杂的化学变化[13],涉及到药物各成分间的相互作用、药物与辅料的相互作用、物料物理稳定性、化学稳定性与生物学稳定性的改变等,不仅使中药制剂外观性状和内在质量发生不同程度的改变,更进一步影响到其临床疗效[14-17]。
本研究采用方差分析,结果表明,不同干燥方式样品中芍药苷、虎杖苷、延胡索乙素的量存在较大差异,以带式真空干燥样品中各指标成分量最高,喷雾干燥次之,100 ℃常压干燥样品指标成分量最低,提示带式真空干燥、喷雾干燥对样品指标成分破坏较小,而板式减压干燥和常压干燥对样品指标成分破坏较大,干燥方式和条件的改变对参蒲盆炎颗粒浸膏干燥质量的影响不容忽视。板式减压干燥可能由于真空度的存在,降低含氧量和相对湿度,缩短干燥时间,其主要指标成分变化几率较常压干燥降低;而喷雾干燥过程可能由于干燥温度高,压缩空气中含氧气量较高,主要指标成分损失较带式真空干燥多。
干燥工艺从带式真空干燥、喷雾干燥转变成板式减压干燥及常压干燥时,芍药苷、虎杖苷和延胡索乙素的量显著降低,提示带式真空干燥、喷雾干燥对样品指标成分破坏较小,而板式减压干燥和常压干燥对样品指标成分破坏较大,可能存在影响参蒲盆炎颗粒药效的质量变化,须注意其干燥工艺是否存在质的改变。
采用聚类分析,结果表明,蒲盆炎颗粒浸膏、喷雾干燥和带式真空干燥品聚为一类,板式减压干燥样品聚为一类,常压干燥样品聚为一类;可能由于带式真空干燥在较低温度、真空度下进行且干燥时间短,对样品中所测3种指标成分破坏较小,化学成分的量与参蒲盆炎颗粒浸膏最为接近,而喷雾干燥与带式真空干燥虽条件相差很大,但对样品指标性成分破坏均较小,具有一定的相似性;板式减压干燥样品与喷雾干燥、带式真空干燥、常压干燥在聚类树上的距离均较远,提示板式减压干燥样品3种指标性成分量与带式真空干燥、喷雾干燥、常压干燥差异明显,不同干燥方式对指标性化学成分的影响不同。采用PCA研究表明,芍药苷、虎杖苷和延胡索乙素的量对4种干燥工艺的参数变化均较为敏感,在干燥过程中应重点监测这几类物质量的变化。
由于中药成分的复杂性及化学检测手段的局限性,不可能对所有指标性化学成分进行分析[18-19],而浓缩干燥和成型工艺的改变,对有效成分或指标性成分量的变化有时不明显,但却会产生显著的物理或物化性质的改变[20-22],进而影响其生物利用度及临床疗效[23]。以上研究表明,指标性化学成分定量测定作为参蒲盆炎颗粒浸膏干燥工艺优选的一种快速评价方法,具有一定参考价值。
| [1] | 刘丹, 何凤军, 刘长龙, 等. 响应面法优选妇科Ⅳ颗粒一步制粒工艺[J]. 中国中药杂志, 2016, 41(1):75–82. |
| [2] | 丁冬梅, 张振海, 蒋艳荣, 等. 丹参酮ⅡA喷雾干燥粉体药剂学性质的研究[J]. 中草药, 2014, 45(10):1398–1401. |
| [3] | 周扬, 刘力, 徐德生, 等. 纳米喷雾干燥技术用于生地黄低聚糖微粉的制备工艺研究[J]. 中草药, 2016, 47(1):65–71. |
| [4] | 刘霖, 刘汉清, 刘嘉, 等. 黄葵胶囊中间体稠膏不同干燥方法的对比研究[J]. 中成药, 2014, 36(1):195–198. |
| [5] | 罗云.中药制剂工艺有无实质性改变的早期快速检(Ⅰ)-板蓝根水提液不同干燥工艺的差异性研究[D].成都:成都中医药大学, 2007. |
| [6] | 董娟娥, 龚明贵, 梁宗锁, 等. 干燥方法和提取温度对板蓝根、大青叶有效成分的影响[J]. 中草药, 2008, 39(1):111–114. |
| [7] | 胡彦君, 王雅琪, 李冰涛, 等. 板蓝根制剂制备过程中成分变化及其药效相关性研究[J]. 中草药, 2016, 47(9):1515–1519. |
| [8] | 王学成, 伍振峰, 王雅琪, 等. 中药丸剂干燥工艺、装备应用现状及问题分析[J]. 中草药, 2016, 47(13):2365–2372. |
| [9] | 刘长龙, 李云霄, 钱俊, 等. 响应面法优化十味盆安颗粒虎杖醋延胡索的提取工艺研究[J]. 世界科学技术-中医药现代化, 2016, 18(9):1602–1608. |
| [10] | 刘长龙, 李云霄, 钱俊, 等. 响应面法优化十味盆安颗粒真空带式干燥工艺研究[J]. 中草药, 2015, 46(13):1914–1919. |
| [11] | 钱俊, 林夏, 王星星, 等. 双波长HPLC法同时测定妇科Ⅳ颗粒剂中芍药苷和虎杖苷的含量[J]. 药学与临床研究, 2014, 22(3):219–221. |
| [12] | 董燕, 贾李蓉, 张竹绿. 中医药数据标准化现状与数据元研究[J]. 中国数字医学, 2012, 7(1):44–47. |
| [13] | 苏子仁, 陈建南. 中药制剂工艺过程的物理化学变化研究[J]. 中国中药杂志, 1998, 23(11):671–674. |
| [14] | 李润美.岗梅总皂昔及其制剂的制备工艺研究[D].广州:广州中医药大学, 2010. |
| [15] | 韦熹苑, 俞洁东, 卢小玲. 不同干燥工艺虎杖提取物UPLC指纹图谱的研究[J]. 广东化工, 2016, 43(6):26–27. |
| [16] | 肖小河, 金城, 赵中振, 等. 论中药含量控制与评价模式的创新与发展[J]. 中国中药杂志, 2007, 32(14):1377–1381. |
| [17] | 徐冰.中药制剂生产过程全程优化方法学研究[D].北京:北京中医药大学, 2013. |
| [18] | 贺帅, 姚育法, 周本杰, 等. 不同干燥工艺对热毒清颗粒中指标成分保留率的影响[J]. 中国药房, 2013, 24(31):2916–2919. |
| [19] | 洪伟.玄参干燥过程主要活性成分的变化[D].武汉:湖北中医药大学, 2012. |
| [20] | 叶殷殷.大黄配方颗粒制备工艺及含量标准的研究[D].广州:广州中医药大学, 2010. |
| [21] | 金城.基于理化-生物关联检测的中药(板蓝根)生产过程含量控制方法初步研究[D].北京:中国人民解放军军事医学科学院, 2009. http://www.oalib.com/paper/4435537 |
| [22] | 王强.中药制剂工艺有无实质性改变的早期快速检(Ⅱ)-不同干燥工艺大黄水提物理化性质和生物活性考察[D].北京:中国人民解放军军事医学科学院, 2008. |
| [23] | 刘长龙, 李云霄, 钱俊, 等. 响应面法优化十味盆安颗粒真空带式干燥工艺研究[J]. 中草药, 2015, 46(13):1914–1919. |
 2017, Vol. 48
2017, Vol. 48


