2. 江苏省中医药研究院 中药组分与微生态研究中心, 江苏 南京 210028
2. Multi-component of Traditional Chinese Medicine and Microecology Research Center, Jiangsu Provincial Academy of Chinese Medicine, Nanjing 210028, China
淫羊藿Epimedii Folium是传统的补肾中药,具有强筋骨、补肾阳、祛风湿等药理作用[1-2],在民间沿用已有千年历史。现代药理研究表明淫羊藿总黄酮具有很好的抗骨质疏松作用,主要活性成分包括淫羊藿苷、朝藿定A、朝藿定B、朝藿定C和宝藿苷I等[3-6]。课题组前期研究表明,淫羊藿黄酮苷肠道渗透性低,吸收较差,口服后需要在肠道内水解为次级苷或苷元才有利于其充分吸收发挥药理作用,而在骨质疏松病理状态下,淫羊藿黄酮苷在肠道的水解速率明显下降[7-9]。为弥补病理状态下肠道酶和肠道菌对淫羊藿总黄酮酶解的不足,本课题组构建了以淫羊藿总黄酮、外加酶、辅料三位一体的适宜于淫羊藿总黄酮肠道内“实时酶解”和“实时吸收”的仿生酶解口服给药系统,以促进淫羊藿总黄酮在体内的水解转化,提高淫羊藿总黄酮的生物利用度与抗骨质疏松疗效。
本研究以蜗牛酶为外加酶,以淫羊藿总黄酮释放度为评价指标,筛选了制备淫羊藿总黄酮酶解肠溶胶囊所需的填充剂种类、用量,崩解剂种类、用量,润湿剂种类等关键因素,并采用响应面法优化其制剂处方,同时对肠溶胶囊中4种黄酮苷的酶解过程进行考察,为淫羊藿总黄酮新制剂的研发提供研究基础。
1 仪器与材料ZRS-8G智能溶出试验仪,天津市天光光学仪器有限公司;UV-1008PC紫外可见分光光度计,上海凤凰光学仪器有限公司;Mettler AL204十万分之一天平,梅特勒-托利多仪器有限公司;JY5002电子天平,上海良平仪器仪表有限公司;离心机,长沙湘智离心机仪器有限公司;Milli-Q纯水机,美国Millipore公司。
淫羊藿总黄酮提取物,自制,以淫羊藿苷计总黄酮质量分数约70%;对照品淫羊藿苷(批号20110206)、朝藿定A(批号20120401)、朝藿定B(批号20120131)、朝藿定C(批号20120118)、宝藿苷I(批号20120222),上海源叶生物科技有限公司,质量分数均>98%;箭藿苷A(批号ZL140303)、箭藿苷B(批号ZL140401)、2″-O-鼠李糖基淫羊藿次苷II(批号ZL140315),南京泽朗医药有限公司,质量分数均>98%;蜗牛酶,上海源叶生物科技有限公司;α-乳糖、微晶纤维素等辅料,药用级,安徽山河药用辅料股份有限公司;2#肠溶胶囊,北京大正百得利生物科技 有限公司;其余试剂均为国产分析纯。
2 方法与结果 2.1 淫羊藿总黄酮仿生酶解肠溶胶囊的制备将淫羊藿总黄酮提取物、蜗牛酶、填充剂、崩解剂混匀,过80目筛,混匀,喷雾加入润湿剂适量,制成软材,过16目筛制粒,50 ℃干燥,过12目筛整粒,装入2#肠溶胶囊。
2.2 淫羊藿总黄酮的UV定量测定 2.2.1 线性关系考察参照《中国药典》2015年版中淫羊藿总黄酮的定量测定方法[10]。精密称取淫羊藿苷对照品2.03 mg,置于10 mL量瓶中,用甲醇溶解并稀释定容至刻度,摇匀,作为淫羊藿苷储备溶液。分别精密吸取淫羊藿苷储备液适量置于5 mL量瓶中,用甲醇稀释配制得质量浓度为4.06、8.12、12.18、16.24、20.30 μg/mL的系列对照品溶液,摇匀,于270 nm波长处测定淫羊藿苷吸光度(A)值,以A值对质量浓度(C)进行线性回归,得淫羊藿苷的线性回归方程为A=0.034 8 C,r=0.999 8,表明淫羊藿苷在4.06~20.30 μg/mL与A值呈良好的线性关系。
2.2.2 供试品溶液的制备精密量取淫羊藿总黄酮仿生酶解肠溶胶囊释放样品的续滤液5 mL,置10 mL量瓶中,加无水乙醇定容至刻度,摇匀,作为供试品溶液。
2.2.3 精密度试验取淫羊藿苷对照品溶液,在270 nm处测定其A值,重复测6次,计算其RSD值为1.34%,表明仪器精密度良好。
2.2.4 稳定性试验取同一供试品溶液,置于室温下,分别于0、1、2、4、8、12、24 h取样,在270 nm处测定其A值,计算RSD值为1.91%,表明供试品溶液在24 h内稳定。
2.2.5 重复性试验平行制备6份供试品溶液,在270 nm处测定其A值,计算RSD值为1.75%,表明该方法重复性良好。
2.2.6 加样回收率试验取适量淫羊藿总黄酮肠溶胶囊内容物,共6份,分别加入一定量的淫羊藿苷对照品溶液,用甲醇稀释定容,离心后在270 nm处测定其A值,计算淫羊藿总黄酮的平均加样回收率为98.76%,RSD值为1.58%,表明加样回收率良好,符合要求。
2.3 体外释放度实验参照《中国药典》2015年版释放度测定法[附录X D第二法(一)法][10],以0.1 mol/L盐酸溶液750 mL为释放介质,转速为100 r/min,依法操作,经2 h后,取10 mL溶液滤过,再精密量取续滤液5 mL,置10 mL量瓶中,加无水乙醇定容至刻度,摇匀,作为供试品溶液(1)。然后向溶出杯中加入温度为(37.0±0.5)℃的250 mL 0.2 mol/L磷酸钠溶液,用2 mol/L盐酸溶液或氢氧化钠溶液调节pH值至6.80±0.05,继续运转,分别在0.25、0.5、0.75、 1、1.5、2、3、4、6 h时取溶液10 mL,滤过,精密量取续滤液5 mL,置10 mL量瓶中,加无水乙醇定容至刻度,摇匀,作为供试品溶液(2)。另取本品1粒,除尽胶囊中内容物,用无水乙醇洗净,挥发干后,用磷酸盐缓冲液(含50%无水乙醇)溶解并稀释至适宜质量浓度,再滤过,作为空白对照溶液。采用UV法在270 nm波长处测定各样品的A值,计算淫羊藿苷的质量浓度。以淫羊藿苷计,计算淫羊藿总黄酮仿生酶解肠溶胶囊在不同时间点的累积释放率。
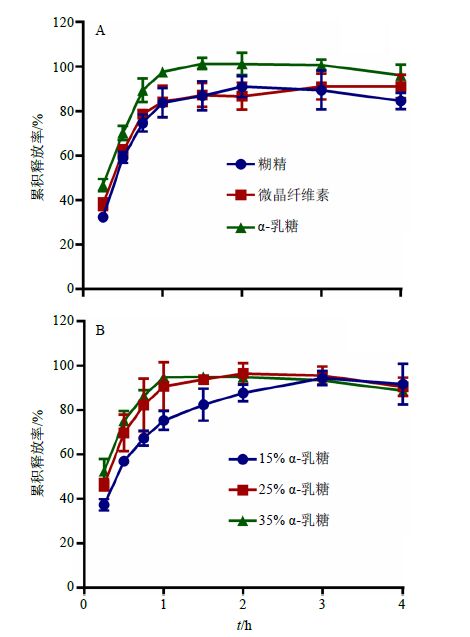
2.4 淫羊藿总黄酮仿生酶解肠溶胶囊处方筛选 2.4.1 填充剂种类与用量根据预试验结果,初步固定淫羊藿总黄酮提取物100 mg、蜗牛酶68 mg及崩解剂(低取代羟丙纤维素)12 mg不变,分别采用α-乳糖、微晶纤维素、糊精作为填充剂,填充剂用量设定为25%,按“2.1”项方法制备淫羊藿总黄酮肠溶胶囊,以淫羊藿总黄酮累积释放率为指标,筛选填充剂种类。结果表明,肠溶胶囊在人工肠液中的累积释放曲线如图 1-A所示,以糊精、微晶纤维素、α-乳糖作为填充剂的肠溶胶囊在45 min时淫羊藿总黄酮的累积释放率分别为88.27%、76.98%、73.82%,其中以α-乳糖作为填充剂时总黄酮的累积释放率最高,因此,本实验优选α-乳糖作为填充剂。
根据上述实验结果,初步固定淫羊藿总黄酮提取物100 mg、蜗牛酶68 mg及崩解剂(低取代羟丙纤维素)12 mg不变,分别采用15%、25%、35%的α-乳糖作为填充剂,按“2.1”项方法制备淫羊藿总黄酮肠溶胶囊,以淫羊藿总黄酮释放率为指标,筛选填充剂用量。结果表明,肠溶胶囊在人工肠液中的累积释放曲线如图 1-B所示,3种肠溶胶囊在45 min时淫羊藿总黄酮的累积释放率分别为75.36%、90.72%、94.81%,当α-乳糖用量超过25%时,淫羊藿总黄酮的累积释放率均达到90%,考虑到降低辅料用量,本实验优选25%的α-乳糖作为填充剂。
|
图 1 填充剂种类 (A) 及用量 (B) 对淫羊藿总黄酮累积释放率的影响 (x±s,n = 3) Fig.1 Effect of filling agents species (A) and amount (B) on cumulative release degree of Epimedium flavonoids (x±s,n = 3) |
2.4.2 崩解剂种类与用量
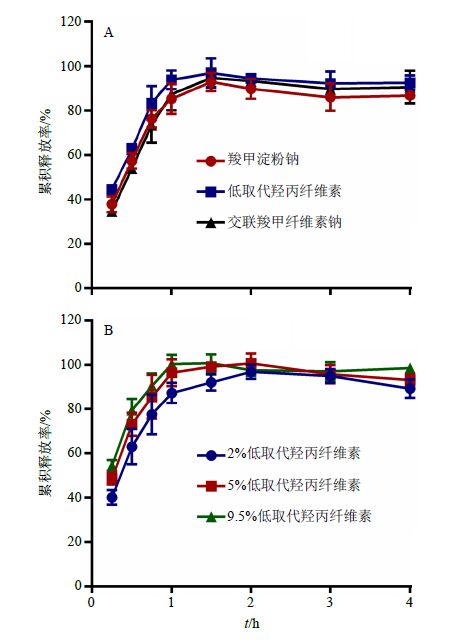
根据预试验结果,初步固定淫羊藿总黄酮提取物100 mg、蜗牛酶68 mg及α-乳糖60 mg不变,分别采用羧甲淀粉钠、低取代羟丙纤维素、交联羧甲纤维素钠作为崩解剂,崩解剂用量均为5%,按“2.1”项方法制备淫羊藿总黄酮肠溶胶囊,以淫羊藿总黄酮累积释放率为指标,筛选崩解剂种类。结果表明,肠溶胶囊在人工肠液中的累积释放曲线如图 2-A所示,3种肠溶胶囊在45 min时淫羊藿总黄酮的累积释放率分别为75.35%、82.37%、72.54%,其中以低取代羟丙纤维素作为崩解剂时总黄酮的累积释放率最高,因此,本实验优选低取代羟丙纤维素作为崩解剂。
|
图 2 崩解剂种类 (A) 及用量 (B) 对淫羊藿总黄酮累积释放率的影响 (x±s,n = 3) Fig.2 Effect of disintegrant species (A) and amount (B) on cumulative release degree of Epimedium flavonoids (x±s,n = 3) |
根据上述实验结果,初步固定淫羊藿总黄酮提取物100 mg、蜗牛酶68 mg及α-乳糖60 mg不变,分别采用2%、5%、9.5%的低取代羟丙纤维素作为崩解剂,按“2.1”方法制备淫羊藿总黄酮肠溶胶囊,以淫羊藿总黄酮释放率为指标,筛选崩解剂用量。结果表明,肠溶胶囊在人工肠液中的累积释放曲线如图 2-B所示,3种肠溶胶囊在45 min时淫羊藿总黄酮的累积释放率分别为77.55%、85.57%、90.54%,其中低取代羟丙纤维素用量分别为5%和9.5%时,淫羊藿总黄酮的累积释放率不存在显著性差异,考虑到降低辅料用量,因此,本实验优选5%低取代羟丙纤维素作为崩解剂。
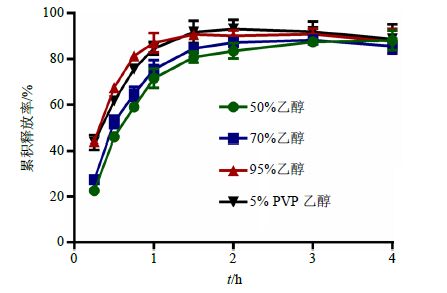
2.4.3 润湿剂种类按照上述单因素实验结果,称取淫羊藿总黄酮提取物10 g、蜗牛酶6.8 g、α-乳糖6 g、低取代羟丙纤维素1.2 g,混合均匀,分别以50%、70%、95%乙醇及5%聚乙烯吡咯烷酮(PVP)乙醇溶液作为润湿剂,按“2.1”项方法制备淫羊藿总黄酮肠溶胶囊,以淫羊藿总黄酮累积释放率为指标,筛选润湿剂种类。结果表明,肠溶胶囊在人工肠液中的累积释放曲线如图 3所示,4种肠溶胶囊在45 min时的累积释放率分别为59.02%、64.78%、81.46%、84.66%,其中只有以95%乙醇或5% PVP乙醇溶液作为润湿剂制备的肠溶胶囊的总黄酮累积释放率达到80%以上,且两者不存在显著性差异,考虑到降低辅料用量,因此,本实验优选95%乙醇作为润湿剂。
|
图 3 润湿剂种类对淫羊藿总黄酮累积释放率的影响 (x±s,n = 3) Fig.3 Effect of wetting agent species on cumulative release degree of Epimedium flavonoids (x±s,n = 3) |
2.5 淫羊藿总黄酮仿生酶解肠溶胶囊处方优化 2.5.1 试验设计和结果
根据单因素试验结果,确定填充剂和崩解剂用量为影响淫羊藿总黄酮仿生酶解肠溶胶囊释放度的主要因素,因此本实验以肠溶胶囊在45 min时的总黄酮累积释放率(R)为响应值,以填充剂(α-乳糖)用量(A)和崩解剂(低取代羟丙纤维素)用量(B)2个因素为自变量,每个因素取5个水平,采用Design Expert统计分析软件中的Box-Benhnken设计了13个试验点,以获取最佳处方参数,其中5个为中心点。本实验设计的13个试验点分为2类:一类是自变量取值所构成的三维顶点,即析因点;另一类是区域的中心点,即零点,零点试验重复5次,用于估计本实验的误差。响应面试验的因素水平编码及试验结果见表 1,方差分析见表 2。
2.5.2 回归模型的方差分析利用Design Expert V8.0.6软件对表 1试验数据进行分析,得到淫羊藿总黄酮肠溶胶囊处方的二次回归模型方程R=22.974 93+1.484 98 A+2.316 11 B+8.015 05×10−3 AB-0.012 118 A2-0.120 86 B2。对模型进行方差分析,结果见表 2。可以得出,模型的P<0.01,表明模型极显著;失拟项的P>0.05,说明模型失拟度不显著;模型的调整确定系数Radj2=0.908 9,说明该模型拟合程度良好,实验误差较小,可以用此模型对淫羊藿总黄酮肠溶胶囊处方进行优化。
|
|
表 1 响应面法试验设计与结果 Table 1 Design and results of response surface design |
|
|
表 2 回归模型的方差分析 Table 2 Analysis of variance for regression model |
模型回归方程的系数显著性检验如下:1次项A(P<0.01),2次项A2(P<0.01)、B2(P<0.01)均达到极显著水平,表明α-乳糖用量对淫羊藿总黄酮肠溶胶囊的释放度有显著影响;2次项AB均不显著(P>0.05),表明低取代羟丙纤维素量与α-乳糖量的交互作用对淫羊藿总黄酮肠溶胶囊的释放度无显著影响。
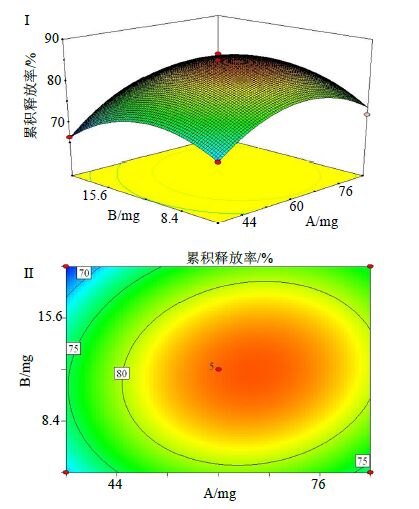
2.5.3 响应面处方优化分析响应面处方优化分析结果见图 4,当α-乳糖量不变时,随着低取代羟丙纤维素量的增加,淫羊藿总黄酮肠溶胶囊的释放度先升高后降低,当α-乳糖量达到65 mg左右,低取代羟丙纤维素量达到11.7 mg左右时,淫羊藿总黄酮肠溶胶囊的释放率达到最高。
|
图 4 处方优化分析的响应面 (Ⅰ) 和等值线 (Ⅱ) Fig.4 Response surface (I) and contour (II) of prescription optimization analysis for response surface design |
利用Design Expert V8.0.6软件对回归模型进行进一步的典型性分析,得到淫羊藿总黄酮肠溶胶囊的最优处方为淫羊藿总黄酮提取物为100 mg,蜗牛酶为68 mg,α-乳糖为65 mg,低取代羟丙纤维素为11.7 mg,该胶囊在人工肠液中45 min时的淫羊藿总黄酮累积释放率可达85.43%。
按照上述最佳处方进行3次验证试验,淫羊藿总黄酮肠溶胶囊的累积释放率分别为87.16%、89.21%、86.49%,平均累积释放率为87.62%,略高于理论值,说明确定的最优处方条件稳定可靠。
2.6 淫羊藿总黄酮仿生酶解肠溶胶囊酶解过程考察[11] 2.6.1 淫羊藿黄酮原型苷及其酶解产物的HPLC定量测定[11](1)色谱条件:色谱柱为Zorbax SB C18柱(150 mm×4.6 mm,5 μm);流动相为乙腈-水,梯度洗脱:0~15 min,10%~25%乙腈;15~38 min,25%乙腈;38~40 min,25%~34%乙腈;40~70 min,34%乙腈;70~80 min,34%~48%乙腈;80~83 min,48%~85%乙腈;83~95 min,85%乙腈;检测波长270 nm;体积流量1.0 mL/min;柱温40 ℃;进样量10 μL。HPLC色谱图见图 5。
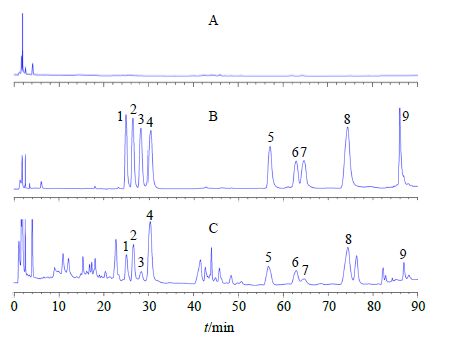
|
A-空白释放介质 B-加各主要黄酮对照品的释放介质 C-淫羊藿总黄酮肠溶胶囊释放2 h后的释放介质 1~9分别为朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、箭藿苷A、箭藿苷B、2″-O-鼠李糖基淫羊藿次苷Ⅱ、宝藿苷Ⅰ及淫羊藿苷元 A-blank release medium B-release medium spiked with the reference substance of the main flavonoids C-release medium with Epimedium flavonoids enteric capsules released after 2 h 1—9 represented epimedins A,B,C,icariin,sagittatoside A,sagittatoside B,2″-O- rhamnosylicariside II,baohuoside I,and icaritin,respectively 图 5 淫羊藿黄酮苷及其酶解产物的HPLC图 Fig.5 HPLC of Epimedium flavonoids glycosides and their corresponding hydrolysates |
(2)对照品溶液的制备:分别取105 ℃干燥至恒定质量的淫羊藿苷6.76 mg、朝藿定A 8.39 mg、朝藿定B 8.09 mg、朝藿定C 8.20 mg、宝藿苷I 5.13 mg、箭藿苷A 6.65 mg、箭藿苷B 6.40 mg、2″-O-鼠李糖基淫羊藿次苷II 6.70 mg、淫羊藿苷元3.75 mg,精密称定,分别置于10 mL量瓶中,加甲醇稀释定容,作为对照品储备液,备用。
(3)线性关系考察:精密吸取上述各对照品储备液适量,置于2 mL量瓶中,用无水乙醇稀释定容,配制得到不同质量浓度的混合对照品溶液。取各混合对照品溶液1 mL,分别置于10 mL量瓶中,用空白辅料溶液定容至10 mL,精密量取续滤液5 mL,置10 mL量瓶中,加无水乙醇稀释至刻度,摇匀,离心后取上清液8 mL,氮气吹干,加入0.4 mL无水乙醇溶解定容,离心,滤过,HPLC检测。以质量浓度为横坐标(X),峰面积积分值为纵坐标(Y),进行线性回归分析,结果线性回归方程、相关系数(r)和线性范围分别为淫羊藿苷Y=11.325 X+10.933,r=0.999 2,线性范围2.11~270.50 μg/mL;朝藿定A Y=6.423 X+8.447,r=0.998 9,线性范围2.62~335.50 μg/mL;朝藿定B Y=7.388 X+15.979,r=0.999 6,线性范围2.53~323.60 μg/mL;朝藿定C Y=8.264 X+19.877,r=0.999 4,线性范围2.56~328.00 μg/mL;宝藿苷I Y=13.825 X+44.666,r=0.999 1,线性范围3.22~206.00 μg/mL;淫羊藿苷元Y=7.132 X-35.731,r=0.998 8,线性范围1.1.7~150.00 μg/mL;箭藿苷A Y=11.468 X+4.824,r=0.999 6,线性范围2.03~266.00 μg/mL;箭藿苷B Y=12.575 X-2.369,r=0.999 6,线性范围2.00~256.00 μg/mL;2″-O-鼠李糖基淫羊藿次苷II Y=12.824 X+4.675,r=0.999 3,线性范围2.10~268.00 μg/mL;该方法的线性关系、精密度、重复性、回收率、稳定性和专属性均符合要求。
(4)供试品溶液的制备及测定:取“2.3”项下淫羊藿总黄酮肠溶胶囊在不同时间点的释放样品(2)各10 mL,滤过,按“2.6.1(3)”项方法操作计算不同时间点释放介质中主要黄酮苷及其主要酶解产物的量。
2.6.2 酶解过程考察结果酶解过程考察结果见图 6,随着淫羊藿总黄酮肠溶胶囊中内容物(总黄酮和蜗牛酶)的释放,淫羊藿总黄酮的主要黄酮苷(朝藿定A、朝藿定B、朝藿定C和淫羊藿苷)在释放的同时被蜗牛酶酶解,由图 6-A可知,4种黄酮苷在0~1 h内呈上升趋势,表明它们的释放速度大于酶解速度,在1~4 h内呈下降趋势表明它们的释放速度小于酶解速度,但它们均在4 h内基本酶解完全;由图 6-B可知,淫羊藿总黄酮的主要酶解产物(箭藿苷A、箭藿苷B、2″-O-鼠李糖基淫羊藿次苷II、宝霍苷I)的释放量在0~3 h内呈上升趋势,在3 h时达到最大值,3 h后呈下降趋势,可能与其继续被酶解生成苷元等其他酶解产物有关。
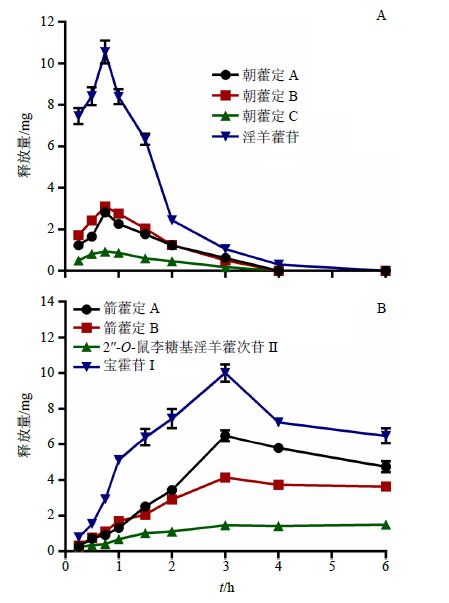
|
图 6 淫羊藿总黄酮肠溶胶囊中主要黄酮苷 (A) 及其酶解产物 (B) 的体外释放曲线 (x±s,n = 6) Fig.6 In vitro release profiles of main flavonoid glycosides (A) and corresponding hydrolysates from Epimedium flavonoids enteric capsules (x±s,n = 6) |
3 讨论
淫羊藿黄酮苷具有很好的抗骨质疏松药效,但其口服直接以原型的形式吸收很少,主要通过肠道酶和肠道菌的水解转化以次级苷或苷元的形式吸收入血,且次级苷和苷元的抗骨质疏松活性比淫羊藿黄酮苷原型更好。然而,人体肠道酶和肠道菌不稳定,易受疾病、年龄、人种、饮食及药物等因素的影响而波动,且本课题组在前期研究中也发现在大鼠骨质疏松病理状态下淫羊藿黄酮苷的水解速率明显减慢。因此,本研究设计构建了由淫羊藿总黄酮、酶、辅料三位一体的仿生酶解肠溶胶囊,以补偿病理状态下淫羊藿黄酮苷水解转化的不足,促进淫羊藿黄酮苷的转化吸收,提高淫羊藿黄酮的抗骨质疏松疗效。
本课题组在前期研究中发现蜗牛酶在人工模拟肠液中酶解淫羊藿黄酮苷的效率最高,其主要酶解产物与肠道酶和肠道菌的酶解产物基本一致[12-13],且由于蜗牛酶价廉易得,因此本研究选择蜗牛酶作为淫羊藿黄酮苷水解酶,与淫羊藿总黄酮、适宜的辅料混合装入肠溶胶囊,其在胃液中无崩解或释放,避免了蜗牛酶被酸性胃液破坏,其在肠道中可快速崩解释放,有效保证了淫羊藿总黄酮能够在肠道排空时间内(3~6 h)酶解完全[14],充分转化为次级苷而吸收,而后续药效学实验也证明该制剂比淫羊藿总黄酮提取物具有更好的抗骨质疏松疗效。
本研究分别建立了淫羊藿总黄酮的UV定量测定方法和总黄酮中各原型苷(淫羊藿苷、朝藿定A、朝藿定B、朝藿定C)及其酶解产物(宝藿苷I、淫羊藿苷元、箭藿苷A、箭藿苷B、2″-O-鼠李糖基淫羊藿次苷II)的HPLC定量测定方法,并考察其线性关系、专属性、精密度、稳定性、回收率均符合要求,所建方法准确可行。本研究采用单因素实验,优选的填充剂、崩解剂、润湿剂种类和用量均能保证淫羊藿总黄酮肠溶胶囊在人工胃液中2 h内基本无崩解或释放,在人工肠液中45 min内累积释放率均在70%以上。本研究还采用响应面法对其制剂处方进行进一步优化,优选的总黄酮肠溶胶囊处方合理,性质稳定,各项指标与理论值均能较好的吻合,模型选用合理有效。
对于淫羊藿黄酮苷口服生物利用度低的问题,现有研究报道解决办法多通过制备磷脂复合物[15]、微乳[16]、自微乳[17]、固体脂质纳米粒[18]等给药系统来提高淫羊藿黄酮原型苷的口服生物利用度,并未考虑药物在体内生物转化、吸收的具体过程,特别是在病理状态下药物吸收代谢情况的变化,因而在实际临床应用中可能达不到预期效果。因此本研究基于病理状态下淫羊藿总黄酮吸收代谢特点设计的口服给药系统将为开发具有类似性质中药新制剂提供新思路和新方法。
| [1] | 曾庆岳, 王云山. 淫羊藿药理作用研究进展[J]. 医药导报 , 2012, 31 (4) :462–465. |
| [2] | Jiang J, Zhao B J, Song J, et al. Pharmacology and clinical application of plants in Epimedium L[J]. Chin Herb Med , 2016, 8 (1) :12–23. DOI:10.1016/S1674-6384(16)60003-5 |
| [3] | 蒋俊, 崔莉, 孙娥, 等. 基于淫羊藿黄酮类化合物的体内代谢阐述其抗骨质疏松药效物质基础[J]. 中草药 , 2014, 45 (5) :721–729. |
| [4] | 李锐华, 徐小倩, 张小强, 等. HPLC法同时测定淫羊藿总黄酮胶囊中5种黄酮类成分[J]. 世界科学技术-中医药现代化 , 2015, 17 (9) :1813–1817. |
| [5] | 韩惠, 单淇, 周福军, 等. 淫羊藿中活性成分的代谢产物研究进展[J]. 现代药物与临床 , 2013, 28 (1) :78–82. |
| [6] | 徐文芬, 杨雯, 何顺志, 等. 一测多评法测定淫羊藿中淫羊藿苷和朝藿定A、B、C[J]. 中草药 , 2016, 47 (1) :130–137. |
| [7] | Chen Y, Wang J Y, Jia X B, et al. Role of intestinal hydrolase in the absorption of prenylated flavonoids present in Yinyanghuo[J]. Molecules , 2011, 16 (2) :1336–1348. |
| [8] | 李杰, 孙娥, 谭晓斌, 等. 羊脂油促进淫羊藿总黄酮吸收转运的研究[J]. 中草药 , 2015, 46 (16) :2439–2444. |
| [9] | Zhou J, Chen Y, Wang Y, et al. A comparative study on metabolism of Epimedium koreanum Nakai-prenylated flavonoids in rats by intestinal enzyme (Lactase Phlorizin Hydrolase) and intestinal flora[J]. Molecules , 2014, 19 (1) :177–203. |
| [10] | 中国药典[S]. 一部. 2015. |
| [11] | 高霞, 陈彦, 王莹, 等. 淫羊藿苷仿生酶解过程的多因素考察[J]. 药学学报 , 2013, 48 (11) :1716–1721. |
| [12] | 陈彦, 贾晓斌, 谭晓斌, 等. 大鼠肠道水解酶对淫羊藿黄酮苷的处置影响[J]. 中国中药杂志 , 2010, 45 (7) :516–519. |
| [13] | 彭静, 马益华, 陈彦, 等. 微乳化-凝胶法制备微球固定化蜗牛酶并生物转化淫羊藿苷研究[J]. 中草药 , 2015, 46 (22) :3326–3332. |
| [14] | 平其能. 中药成分的胃肠道转运与剂型设计[M]. 北京: 化学工业出版社, 2010 . |
| [15] | 贾东升, 赵江丽, 施峰, 等. 淫羊藿苷元磷脂复合物的制备及其固体分散体研究[J]. 中草药 , 2010, 41 (9) :1449–1453. |
| [16] | 冯传平, 李福元, 丁海霞. 补肾温肺微乳中淫羊藿苷的大鼠在体肠吸收特征研究[J]. 中国药师 , 2015, 18 (9) :1456–1459. |
| [17] | 王晋艳, 陈彦, 张振海. 淫羊藿苷元自微乳在Caco-2细胞模型的肠吸收特性初步研究[J]. 中草药 , 2012, 43 (3) :476–481. |
| [18] | 刘丛丛, 郭涛, 颜鸣. 淫羊藿苷固体脂质纳米粒大鼠肠吸收动力学研究[J]. 沈阳药科大学学报 , 2011, 28 (9) :736–739. |
 2016, Vol. 47
2016, Vol. 47


