粗齿冷水花Pilea sinofasciata C. J. Chen,又名紫绿草、青药、水麻叶、水甘草、大茴香、宫麻,为荨麻科(Urticaceae)冷水花属Pilea Lindl.粗齿冷水花的全草,分布于我国广西、贵州、四川和云南等省,具有清热解毒、活血祛风、理气止痛的功效,主治高热、喉蛾肿痛、鹅口疮、跌打损伤、骨折、风湿痹痛[1],广西民间用其于健脾、催乳、止咳、消炎、防治附件炎和盆腔炎等妇科疾病。目前关于该植物的研究较少,其药理活性和物质基础均不明确。前期本课题组采用GC-MS法对粗齿冷水花的脂溶性成分进行了分析,其主要成分为1-甲基-4-(5-甲基-1-亚甲基-4-己烯基)-(S)-环己烯(30.349%)、7, 11-二甲基-3-亚甲基-(E)-l, 6, 10-十二碳三烯(23.750%)、1, 2, 3, 5, 6, 7, 8, 8a-八氢-1, 8α-二甲基-7-(1-甲基乙烯基)-[1S-(1α, 7α, 8aα)]-萘(15.541%)和角鲨烯(11.485%)[2],并对药材进行了薄层鉴定研究[3];牛延慧等[4]采用化学反应鉴别方法对冷水花属植物进行化学成分预实验研究,发现粗齿冷水花中可能含有多糖、皂苷、多肽、还原糖、鞣质、有机酸、香豆素、黄酮类、挥发油等多种化学成分。本实验对粗齿冷水花全草的乙醇提取物的化学成分进行了系统研究,分离鉴定了19个化合物,分别为α-生育酚(α-tocopherol,1)、豆甾醇(stigmasterol,2)、epihernandulcin(3)、hernandulcin(4)、苯甲酸(benzoic acid,5)、亚麻油酸乙酯(ethyl linolenate,6)、十六酸乙酯(ethyl hexadecanoate,7)、α-香树精(α-amyrin,8)、棕榈酸(palmitic acid,9)、二十二烷酸(behenic acid,10)、腺苷(adenosine,11)、吲哚-3-甲酸(indole-3-carboxylic acid,12)、原儿茶酸(protocatechuate,13)、没食子酸(gallic acid,14)、白桦脂酸(betulinic acid,15)、齐墩果酸(oleanolic acid,16)、硝酸钾(potassium nitrate,17)、香叶木素-7-O-β-D-葡萄糖苷(diosmetin 7-O-β-D-glucopyranoside,18)、3-O-β-D-吡喃木糖基(1→2)-β-D-吡喃葡萄糖-齐墩果酸-28-O-β-D-吡喃葡萄糖酯苷[3-O-β-D-xylopyranosyl(1→2)-β-D-glucopyranosyl-28-O-β-D-glucopyranosyl oleanolic acid,19]。所有化合物均为首次从该植物中分离得到。
1 仪器与材料RE-52A型旋转蒸发仪(上海亚荣生化仪器厂);X-4熔点仪(上海精科物理光学仪器厂);Bruker DRX-500 MHz超导核磁共振仪(德国布鲁克公司);Bruker AM-400 MHz超导核磁共振仪(德国布鲁克公司);Agilent 5973N气相色谱/四级杆质谱联用仪(美国安捷伦公司);Sephadex LH-20葡聚糖凝胶(瑞典Pharmacia Biotech公司);柱色谱和薄层色谱用硅胶由青岛海洋化工厂生产;所用试剂均为分析纯。
粗齿冷水花全草,采集于广西百色,经广西中医药研究院何开家主任药师鉴定为荨麻科冷水花属粗齿冷水花Pilea sinofasciata C. J. Chen。
2 提取与分离粗齿冷水花枝叶晾干后切碎,称取15 kg,经95%乙醇回流提取3次,每次2 h,滤过,合并提取液,回收乙醇至干得乙醇提取物。将乙醇提取物用水悬浮后,依次用石油醚、醋酸乙酯、正丁醇萃取,回收溶剂,得石油醚部位869 g、醋酸乙酯部位39 g和正丁醇部位210 g。
取石油醚部位869 g进行硅胶柱色谱分离,石油醚-醋酸乙酯(100:0→1:1)梯度洗脱,共得到164个流分。石油醚-醋酸乙酯(95:5)洗脱部分反复进行硅胶柱色谱分离,得到化合物1(4.3 mg)。石油醚-醋酸乙酯(90:10)洗脱部分反复进行硅胶柱色谱分离得到化合物2(100.0 mg)、3(25.3 mg)、4(39.4 mg)。
取醋酸乙酯部位39 g进行硅胶柱色谱分离,石油醚-醋酸乙酯(100:0→1:1)梯度洗脱,500 mL/份,共得到512个流分,用TLC薄层色谱进行检识,将Rf值和颜色斑点相似者合并,得到E1~E5组分。E1部分经反复硅胶柱色谱分离纯化得到化合物5(9.1 mg)、6(15 mg)和7(12 mg)。E2部分经硅胶H柱色谱洗脱得到化合物8(11 mg)、9(24 mg)、10(15 mg)。E3部分经硅胶柱色谱和Sephadex LH-20葡聚糖凝胶柱色谱反复分离纯化得到化合物11(16 mg)和12(7 mg)。E4部分经硅胶柱色谱和Sephadex LH-20葡聚糖凝胶柱色谱洗脱分离得到化合物13(8 mg)、14(10 mg)。E5部位经硅胶H柱色谱分离得到化合物15(14 mg)和16(10 mg)。
取正丁醇部位浸膏136 g,用水溶解,湿法上样,经D101型大孔树脂分离得到90%乙醇、60%乙醇、30%乙醇和水4个部分。水部分洗脱得到大量白色针状结晶化合物17(3.2 g)。60%乙醇部分经反复硅胶柱色谱(300~400目)和制备液相色谱进行分离得到化合物18(12 mg)和19(9 mg)。
3 结构鉴定化合物1:淡黄色油状物,EI-MS m/z: 430 [M]+。1H-NMR (500 MHz, CDC13) δ: 4.22 (1H, s, -OH), 2.61 (2H, t, J=6.5 Hz, H-4), 2.19 (3H, s, H-10), 2.14 (6H, s, H-5a, 7a), 1.23 (3H, m, H-2a), 0.87 (6H, m, H-12′a, 13′), 0.84 (3H, m, H-8′a), 0.83 (3H, m, H-4′a);13C-NMR (125 MHz, CDC13) δ: 145.5 (C-8a), 144.5 (C-6), 122.6 (C-8), 120.9 (C-7), 118.5 (C-5), 117.4 (C-4a), 74.5 (C-2), 39.8 (C-1′), 39.4 (C-11′), 37.4, 37.3 (C-3′, 5′, 7′, 9′), 32.8, 32.7 (C-4′, 8′), 31.6 (C-3), 27.9 (C-12′), 24.8, 24.4 (C-2′, 10′), 23.8 (C-2a), 22.7, 22.6 (C-12′a, 13′), 21.0 (C-6), 20.8 (C-4), 19.7, 19.6 (C-4′a, 8′a), 12.2 (C-7a), 11.8, 11.3 (C-5a, 8b)。以上数据与文献报道基本一致[5],故鉴定化合物1为α-生育酚。
化合物2:无色针状结晶(石油醚-醋酸乙酯),mp 145~146 ℃,溶于乙醚、石油醚、氯仿、醋酸乙酯、丙酮。TLC薄层色谱喷10%浓硫酸加热后显紫红色单一斑点,Liebermann-Burchard反应呈阳性(紫→红→蓝绿),表明该化合物可能为甾体类化合物。与豆甾醇对照品在同一块薄层板上展开,Rf值完全一致,且显色也相同,混合后测定熔点未下降,故鉴定化合物2为豆甾醇。
化合物3:无色油状物。EI-MS m/z: 236 [M]+。1H-NMR (400 MHz, CDC13) δ: 5.83 (1H, brs, H-2), 5.06 (1H, brs, -OH), 5.07 (1H, brt, J=7.5 Hz, H-4′), 2.34 (1H, dd, J=4.4, 14.0 Hz, H-6), 1.94 (3H, s, H-7), 1.64 (3H, s, H-6′), 1.58 (3H, s, H-7′), 1.17 (3H, s, H-8′);13C-NMR (100 MHz, CDC13) δ: 203.6 (C-1), 127.3 (C-2), 163.7 (C-3), 31.5 (C-4), 22.0 (C-5), 55.2 (C-6), 24.1 (C-7), 74.3 (C-1′), 36.8 (C-2′), 22.0 (C-3′), 124.5 (C-4′), 131.4 (C-5′), 25.7 (C-6′), 17.6 (C-7′), 25.3 (C-8′)。以上数据与文献报道基本一致[6-7],故鉴定化合物3为epihernandulcin。
化合物4:无色油状物。EI-MS m/z: 236 [M]+。1H-NMR (400 MHz, CDC13) δ: 5.88 (1H, brs, H-2), 5.30 (1H, brs, -OH), 5.11 (1H, brt, J=7.1 Hz, H-4′), 2.41 (1H, dd, J=4.4, 14.0 Hz, H-6), 1.96 (3H, s, H-7), 1.68 (3H, s, H-6′), 1.62 (3H, s, H-7′), 1.17 (3H, s, H-8′);13C-NMR (100 MHz, CDC13) δ: 204.4 (C-1), 127.3 (C-2), 164.2 (C-3), 31.2 (C-4), 24.9 (C-5), 51.8 (C-6), 24.1 (C-7), 74.2 (C-1′), 40.1 (C-2′), 21.4 (C-3′), 124.2 (C-4′), 131.5 (C-5′), 25.6 (C-6′), 17.5 (C-7′), 23.4 (C-8′)。以上数据与文献报道基本一致[6-7],故鉴定化合物4为hernandulcin。
化合物5:无色针状晶体(甲醇)。EI-MS m/z: 122 [M]+。1H-NMR (500 MHz, CDC13) δ: 8.14 (2H, d, J=7.5 Hz, H-3, 7), 7.63 (1H, t, J=7.5 Hz, H-5), 7.48 (2H, t, J=7.5 Hz, H-4, 6);13C-NMR (125 MHz, CDC13) δ: 172.5 (C-1), 129.4 (C-2), 130.7 (C-3, 7), 128.5 (C-4, 6), 133.8 (C-5)。以上数据与文献报道[8]基本一致,故鉴定化合物5为苯甲酸。
化合物6:黄色油状物。EI-MS m/z: 307 [M-H]+。1H-NMR (500 MHz, CDCl3) δ: 0.88 (3H, t, J=7.0 Hz, -CH3), 2.28 (3H, t, J=7.5 Hz, COOCH2CH3), 4.11 (2H, q, J=7.5 Hz, COOCH2CH3), 5.31~5.39 (6H, m, 3×-CH=CH-);13C-NMR (125 MHz, CDCl3) δ: 14.02 [CH3(CH2)17], 14.20 (COOCH2CH3), 60.11 (COOCH2CH3), 173.9 (COO), 127.8~130.2 [(-CH2=CH2-)3], 22.5~34.3 (CH2)。以上数据与文献报道[9]基本一致,故鉴定化合物6为亚麻油酸乙酯。
化合物7:淡黄色油状体。EI-MS: m/z 284 [M]+。1H-NMR (500 MHz, CDCl3) δ: 4.10 (2H, q, J=7.0 Hz, H-1), 2.26 (2H, t, J=7.5 Hz, H-2), 1.59 (2H, m, H-3), 0.87 (3H, d, J=6.5 Hz, H-16)。经质谱分析并结合文献报道[9]可确定化合物7为十六酸乙酯。
化合物8:白色粉末。EI-MS m/z: 426 [M]+。1H-NMR (500 MHz, CDCl3) δ: 0.78 (3H, d, J=6.0 Hz, 24-CH3), 0.79 (3H, s, 25-CH3), 0.80 (3H, s, 26-CH3), 0.91 (3H, d, J=6.0 Hz, 29-CH3), 0.95 (3H, s, 30-CH3), 1.00 (3H, s, 27-CH3), 1.01 (3H, s, 23-CH3), 1.07 (3H, s, 28-CH3), 3.23 (1H, dd, J=11.0, 5.0 Hz, H-3), 5.12 (1H, m, H-12);13C-NMR (125 MHz, CDCl3) δ: 38.7 (C-1), 27.2 (C-2), 79.0 (C-3), 38.7 (C-4), 55.1 (C-5), 18.3 (C-6), 32.9 (C-7), 39.6 (C-8), 47.6 (C-9), 36.8 (C-10), 23.2 (C-11), 124.3 (C-12), 139.5 (C-13), 41.5 (C-14), 28.7 (C-15), 26.6 (C-16), 33.7 (C-17), 59.0 (C-18), 39.5 (C-19), 39.6 (C-20), 31.2 (C-21), 41.4 (C-22), 28.1 (C-23), 15.5 (C-24), 15.6 (C-25), 16.8 (C-26), 23.3 (C-27), 28.1 (C-28), 17.4 (C-29), 21.4 (C-30)。以上波谱数据与文献报道基本一致[10],故鉴定化合物8为α-香树精。
化合物9:白色蜡状固体。EI-MS m/z: 256 [M]+。1H-NMR (500 MHz, CDCl3) δ: 2.34 (2H, t, J=7.5 Hz, H-2), 1.62 (2H, t, J=7.0 Hz, H-15), 0.88 (3H, t, J=6.8 Hz, CH3);13C-NMR (125 MHz, CDCl3) δ: 180.4 (C-1), 34.1 (C-2), 24.7 (C-3), 31.9 (C-14), 22.5 (C-15), 14.1 (C-16)。以上数据与文献报道基本一致[11],故鉴定化合物9为棕榈酸。
化合物10:白色片状结晶(石油醚-醋酸乙酯)。EI-MS m/z: 340 [M]+,326,312以下依次递减14(CH2)质量单位,峰的强度随质荷比的增加而减小,呈现一系列相差CH2的碎片峰,显示典型长链脂肪酸的特征。1H-NMR (500 MHz, CDCl3) δ: 2.34 (2H, t, J=7.5 Hz, H-2), 1.62 (2H, t, J=7.0 Hz, H-21), 0.88 (3H, t, J=6.8 Hz, CH3)。以上数据与文献报道基本一致[12],故鉴定化合物10为二十二烷酸。
化合物11:白色粉末。EI-MS m/z: 267 [M]+。1H-NMR (500 MHz, CD3OD) δ: 8.30 (1H, s, H-2), 8.17 (1H, s, H-8), 5.96 (1H, d, J=6.5 Hz, H-1′);13C-NMR (125 MHz, CD3OD) δ: 153.7 (C-2), 150.0 (C-4), 121.0 (C-5), 157.6 (C-6), 142.0 (C-8), 91.2 (C-1′), 75.4 (C-2′), 72.7 (C-3′), 88.2 (C-4′), 63.5 (C-5′)。以上数据与文献报道基本一致[13],故鉴定化合物11为腺苷。
化合物12:淡黄色粉末。EI-MS m/z: 161 [M]+。1H-NMR (500 MHz, CD3OD) δ: 8.06 (1H, m, H-4), 7.94 (1H, s, H-2), 7.42 (1H, m, H-7), 7.17 (2H, m, H-5, 6);13C-NMR (125 MHz, CD3OD) δ: 169.4 (COOH), 138.2 (C-8), 133.3 (C-2), 127.6 (C-9), 123.6 (C-5), 122.4 (C-6), 122.0 (C-4), 112.9 (C-7), 108.9 (C-3)。以上数据与文献报道基本一致[14],故鉴定化合物12为3-吲哚甲酸。
化合物13:无色结晶(甲醇)。EI-MS m/z: 154 [M]+。1H-NMR (500 MHz, CDCl3) δ: 7.47 (1H, d, J=2.0 Hz, H-2), 7.44 (1H, dd, J=2.0, 8.0 Hz, H-6), 6.80 (1H, d, J=8.0 Hz, H-5);13C-NMR (125 MHz, CDCl3) δ: 169.5 (COOH), 123.0 (C-1), 110.6 (C-2, 6), 147.7 (C-3, 5), 140.6 (C-4)。以上数据与文献报道基本一致[15],故鉴定化合物13为原儿茶酸。
化合物14:无色结晶(甲醇)。EI-MS m/z: 170 [M]+。1H-NMR (500 MHz, Pyr-d6) δ: 7.56 (2H, s, H-2, 6);13C-NMR (125 MHz, Pyr-d6) δ: 169.7 (COOH), 121.7 (C-1), 114.6 (C-2), 144.0 (C-3), 149.7 (C-4), 116.4 (C-5), 123.5 (C-6)。以上数据与文献报道基本一致[16],故鉴定化合物14为没食子酸。
化合物15:白色粉末。EI-MS m/z: 456 [M]+。1H-NMR (500 MHz, CDCl3) δ: 0.75, 0.82, 0.93, 0.96, 0.97, 1.69 (各3H, s, 6×CH3), 3.18 (1H, m, H-3), 4.73 (1H, d, J=2.0 Hz, H-29b), 4.60 (1H, d, J=2.0 Hz, H-29a);13C-NMR (125 MHz, CDCl3) δ: 38.7 (C-1), 27.4 (C-2), 79.0 (C-3), 38.8 (C-4), 55.3 (C-5), 18.2 (C-6), 34.2 (C-7), 40.6 (C-8), 50.5 (C-9), 37.2 (C-10), 20.7 (C-11), 25.5 (C-12), 38.3 (C-13), 42.4 (C-14), 30.5 (C-15), 32.0 (C-16), 56.1 (C-17), 46.9 (C-18), 49.2 (C-19), 150.6 (C-20), 29.4 (C-21), 37.0 (C-22), 27.9 (C-23), 15.3 (C-24), 16.0 (C-25), 16.0 (C-26), 14.7 (C-27), 180.3 (C-28), 109.7 (C-29), 19.4 (C-30)。以上波谱数据与文献报道基本一致[17],故鉴定化合物15为白桦脂酸。
化合物16:白色粉末。EI-MS m/z: 456 [M]+。1H-NMR (500 MHz, CDCl3) δ: 0.75 (3H, s, 24-CH3), 0.77 (3H, s, 25-CH3), 0.90 (3H, s, 26-CH3), 0.91 (3H, s, 30-CH3), 0.93 (3H, s, 27-CH3), 0.98 (3H, s, 23-CH3), 1.13 (3H, s, 29-CH3), 3.21 (1H, m, H-3), 5.30 (1H, m, H-12);13C-NMR (125 MHz, CDCl3) δ: 38.6 (C-1), 27.5 (C-2), 79.2 (C-3), 38.9 (C-4), 55.4 (C-5), 18.5 (C-6), 32.8 (C-7), 39.4 (C-8), 47.8 (C-9), 37.2 (C-10), 23.2 (C-11), 122.8 (C-12), 143.8 (C-13), 41.8 (C-14), 27.8 (C-15), 23.6 (C-16), 46.7 (C-17), 41.1 (C-18), 46.0 (C-19), 30.8 (C-20), 34.0 (C-21), 32.6 (C-22), 28.2 (C-23), 15.8 (C-24), 15.6 (C-25), 17.3 (C-26), 26.1 (C-27), 183.5 (C-28), 32.2 (C-29), 23.7 (C-30)。以上波谱数据与文献报道基本一致[18],故鉴定化合物16为齐墩果酸。
化合物17:白色针状结晶(甲醇),310 ℃以上不熔。易溶于水,难溶于无水乙醇、丙酮等有机溶剂。灼烧不灰化,其水溶液与亚硝酸钠试剂作用生成黄色结晶,证实含有钾离子。与硫酸亚铁反应在界面生成棕色环,与铜丝加硫酸反应出现红棕色气体,证实含有硝酸根。 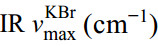
化合物18:淡黄色粉末。EI-MS m/z: 462 [M]+。1H-NMR (500 MHz, CD3OD) δ: 7.37 (1H, dd, J=2.0, 8.5 Hz, H-6′), 7.33 (1H, d, J=2.0 Hz, H-2′), 6.82 (1H, d, J=8.5 Hz, H-5′), 6.71 (1H, d, J=2.5 Hz, H-8), 6.60 (1H, d, J=2.5 Hz, H-6), 6.48 (1H, s, H-3), 4.74 (1H, d, J=8.0 Hz, Glc-H-1), 3.85 (3H, s, -OCH3);13C-NMR (125 MHz, CD3OD) δ: 180.3 (C-4), 164.8 (C-2), 164.1 (C-7), 160.6 (C-5), 158.0 (C-9), 151.8 (C-3′), 149.4 (C-4′), 123.4 (C-1′), 116.7 (C-6′), 110.4 (C-5′), 106.8 (C-2′), 105.0 (C-10), 104.7 (C-3), 99.3 (C-6), 96.7 (C-8), 56.6 (OCH3), 104.4 (C-1″), 74.7 (C-2″), 78.6 (C-3″), 71.2 (C-4″), 77.2 (C-5″), 62.5 (C-6″)。以上数据与文献报道一致[20],故鉴定化合物18为香叶木素-7-O-β-D-葡萄糖苷。
化合物19:白色粉末。1H-NMR (500 MHz, C5D5N) δ: 0.83, 1.02, 1.06, 1.20, 1.43, 1.71 (各3H, s, 6×CH3), 1.12 (3H, d, J=6.5 Hz, CH3), 4.94 (1H, d, J=6.8 Hz, xyl-H-1), 5.50 (1H, d, J=6.8 Hz, glc-H-1), 6.01 (1H, brs, H-12);13C-NMR (100 MHz, C5D5N) δ: 38.6 (C-1), 26.6 (C-2), 89.3 (C-3), 39.5 (C-4), 55.7 (C-5), 18.5 (C-6), 33.2 (C-7), 39.9 (C-8), 48.0 (C-9), 36.9 (C-10), 23.4 (C-11), 122.9 (C-12), 144.2 (C-13), 42.1 (C-14), 28.3 (C-15), 23.8 (C-16), 47.0 (C-17), 42.1 (C-18), 46.2 (C-19), 30.8 (C-20), 34.0 (C-21), 32.6 (C-22), 28.2 (C-23), 17.0 (C-24), 15.6 (C-25), 17.5 (C-26), 26.2 (C-27), 176.5 (C-28), 33.1 (C-29), 23.7 (C-30), 105.4 (glc-H-1′), 83.7 (glc-H-2′), 78.5 (glc-H-3′), 71.1 (glc-H-4′), 73.5 (glc-H-5′), 62.2 (glc-H-6′), 107.0 (xyl-H-1″), 76.2 (xyl-H-2″), 78.3 (xyl-H-3″), 71.6 (xyl-H-4″), 78.3 (xyl-H-5″), 95.8 (glc-H-1′′′), 74.2 (glc-H-2′′′), 78.9 (glc-H-3′′′), 71.1 (glc-H-4′′′), 79.5 (glc-H-5′′′), 62.2 (glc-H-6′′′)。以上数据与文献报道一致[21],故鉴定化合物19为3-O-β-D-吡喃木糖基(1→2)-β-D-吡喃葡萄糖-齐墩果酸-28-O-β-D-吡喃葡萄糖酯苷。
| [1] | 国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学出版社, 1999. |
| [2] | 文建文, 黄艳, 何开家, 等. GC-MS法分析粗齿冷水花石油醚部位的脂溶性成分[J]. 安徽农业科技 , 2010, 41 (36) :14156. |
| [3] | 武旭, 柴玲, 黄艳, 等. 粗齿冷水花药材的薄层鉴别研究[J]. 现代中药研究与实践 , 2016, 30 (1) :17–20. |
| [4] | 牛延慧, 梁志远, 甘秀海. 贵州三种冷水花化学成分预试研究[J]. 贵州师范学院学报 , 2010, 26 (3) :26–28. |
| [5] | 程凡, 周媛, 邹坤, 等. 木果楝果实的化学成分研究[J]. 中药材 , 2009, 8 (32) :1220–1223. |
| [6] | Compadre C M, Hussain R A, de Compadre R L L, et al. The intensely sweet sesquiterpene hernandulcin:Isolation, synthesis, characterization, and preliminary safety evaluation[J]. J Agric Food Chem , 1987, 35 (2) :273–279. DOI:10.1021/jf00074a027 |
| [7] | Compadre C M, Pezzuto J M, Kinghorn A D, et al. Hernandulcin:An intensely sweet compound discovered by review of ancient literature[J]. Science , 1985, 227 (4685) :417–419. DOI:10.1126/science.3880922 |
| [8] | 梁琼, 杨胜祥, 况燚, 等. 苦竹嫩茎化学成分的研究[J]. 中草药 , 2015, 46 (8) :1125–1128. |
| [9] | 甘秀海, 梁志远, 杨小生, 等. 冷水花化学成分研究[J]. 中成药 , 2012, 34 (4) :689–691. |
| [10] | 白玉华, 于辉, 常乃丹, 等. 日本苦苣菜的化学成分[J]. 中国药科大学学报 , 2008, 39 (3) :279–281. |
| [11] | 王慧, 邹坤, 吴军. 十雄角果木树皮的化学成分研究[J]. 华中师范大学学报:自然科学版 , 2013, 47 (6) :794–796. |
| [12] | 许文清, 龚小见, 周欣, 等. 马兰化学成分研究[J]. 中草药 , 2010, 41 (7) :1056–1060. |
| [13] | 张伟东, 王晓娟, 杨万军, 等. 射干的化学成分研究[J]. 中国医院药学杂志 , 2011, 31 (6) :435–436. |
| [14] | 温晶, 史海明, 昝珂, 等. 刘寄奴的化学成分研究[J]. 中草药 , 2010, 41 (6) :870–873. |
| [15] | 罗娅君, 肖新峰, 王照丽. 大叶金花草化学成分的研究(Ⅱ)[J]. 中草药 , 2009, 40 (2) :190–192. |
| [16] | 周兴栋, 余绍福, 程淼, 等. 锡叶藤的化学成分[J]. 暨南大学学报:自然科学与医学版 , 2015, 36 (4) :302–306. |
| [17] | 潘萍, 孙启时. 大叶紫珠的化学成分[J]. 沈阳药科大学学报 , 2006, 23 (9) :565–567. |
| [18] | 刘俊霞, 侯微, 窦凤鸣, 等. 五味子藤茎正丁醇部位化学成分研究[J]. 中草药 , 2015, 46 (13) :1878–1882. |
| [19] | 王梦月, 李外, 李晓波. 荨麻水溶性化学成分研究[J]. 中国药学杂志 , 2005, 40 (24) :1853–1855. |
| [20] | 李胜华, 牛友芽. 鸭儿芹的化学成分研究[J]. 中草药 , 2012, 43 (12) :2365–2368. |
| [21] | Liang C, Ding Y, Nguyen H T, et al. Oleanane-type triterpenoids from Panax stipuleanatus and their anticancer activities[J]. Bioorg Med Chem Lett , 2010, 20 (23) :7110–7115. DOI:10.1016/j.bmcl.2010.09.074 |
 2016, Vol. 47
2016, Vol. 47


