2. 四川农业大学动物医学院 药学系, 四川 成都 611130 ;
3. 柳州市人民医院 柳州市文昌司法鉴定所, 广西 柳州 545006
2. Department of Pharmacy, College of Veterinary Medicine, Sichuan Agricultural University, Chengdu 611130, China ;
3. Liuzhou Wenchang Judicial Identification Institution, Liuzhou People's Hospital, Liuzhou 545006, China
姜黄素(curumin,Cur)是从多年生草本植物姜黄的根茎中提取出来的一种多酚类化合物,具有抗炎、抗癌、抗氧化等药理作用[1-6]。但由于其水中溶解度极低、口服生物利用度低、成药性差等缺点,严重限制了姜黄素的临床应用[7]。有学者尝试了采用制剂学方法改善姜黄素的溶解度及口服生物利用度,取得了一定效果[8-12]。
近年来,无机纳米材料以其独特的优势,在药剂学领域得到越来越多的应用。其中介孔二氧化硅纳米粒(mesoporous silica nanoparticles,MSN)作为一种新型无机高分子药物载体,逐渐成为研究热点[13-16],其具有良好的生物相容性、稳定性及吸附性能,有望成为一种新型固体分散体(SD)载体材料[17],但目前研究多局限于化学药物载药领域。为了克服姜黄素的水溶性差、生物利用度低等问题,在本研究中,首次采用了MSN为载体材料,制备姜黄素-介孔二氧化硅纳米粒固体分散体(Cur- MSN-SD),以提高药物的溶出速率和溶解度,增强药物成药性。
1 仪器与材料S4800型扫描电镜,日本Hitachi公司;Q2000差示扫描仪,美国TA公司;Quadrasorb SI比表面孔径分析仪,美国Quantachrome公司;IRAffinity-1红外光谱仪,日本Shimadzu公司;UV-2401PC紫外分光光度计,日本Shimadzu公司;Optima L-80xp超速冷冻离心机,美国Beckman公司;BS210S电子天平,德国Sartorius公司。Cur,批号20140516,质量分数>98%,购自成都科龙化工有限公司;正硅酸四乙酯(tetraethoxysilane,TEOS)和十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)购自上海阿拉丁试剂有限公司;其他试剂均为分析纯,水为重蒸水。
2 方法与结果 2.1 MSN的制备根据参考文献的方法[18]并加以改进:将0.56 g CTAB置于250 mL圆底烧瓶中,加入150 mL蒸馏水使其完全溶解,然后加入6 mL 2 mol/L的NaOH溶液,水浴升温至60 ℃,持续高速搅拌下缓慢滴加6 mL TEOS,并维持恒温高速搅拌2 h后,经抽滤、洗涤后得到白色固体,转入三口烧瓶中,加入150 mL酸性乙醇溶液(乙醇-盐酸4∶1)充分分散后,80 ℃加热回流3 h除去CTAB,再次经抽滤、洗涤后,50 ℃真空干燥,即得。
2.2 Cur-MSN-SD的制备按照Cur与MSN质量比为1∶1、1∶2、1∶4,分别制备不同比例的Cur-MSN-SD:精密称取100 mg Cur,溶于100 mL 80%乙醇溶液后,按照质量比加入适量的MSN粉末,水浴超声将载体完全分散,磁力搅拌4 h后,于50 ℃旋转蒸发溶剂,得到均一的黄色固体,进一步真空干燥24 h后,研细,过80目筛,即得。
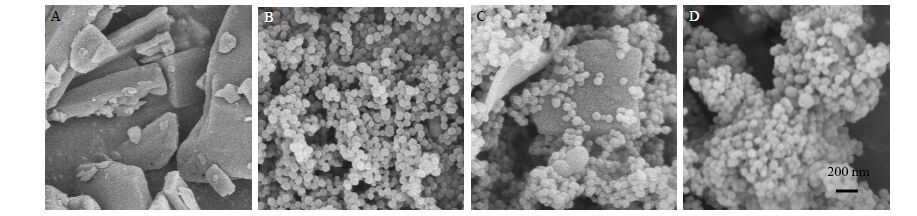
2.3 外观形态以Cur与MSN质量比为1∶2制备的SD为例,与Cur原药、MSN以及两者物理混合物(1∶2)进行微观显微比较。将样品粉末均匀置于样品平台上,用导电胶固定后喷金。电压加至5 kV,扫描电镜观察样品外观形貌、分散性和均匀性。结果如图 1所示,Cur微观结构呈现明显的晶体颗粒状(图 1-A);MSN则是外观为球形,大小均一,分散性好的纳米粒,粒径大小约为100 nm(图 1-B);Cur和MSN等量混合物样品呈现纳米粒与晶体掺杂在一起(图 1-C);而Cur-MSN-SD完全不同于混合物样品,未见明显的晶体颗粒(图 1-D),说明Cur已经很好地分散到MSN中。
|
图 1 Cur (A)、MSN (B)、Cur和MSN物理混合物 (1∶2,C) 和Cur-MSN-SD (D) 的扫描电镜图(放大倍数:×20 000) Fig.1 Scanning electron microscopy imagings of Cur (A),MSN (B),physical mixture of Cur crystal and MSN (1∶2,C),and Cur-MSN-SD (D) (magnification: × 20 000) |
2.4 氮气吸附-解吸实验
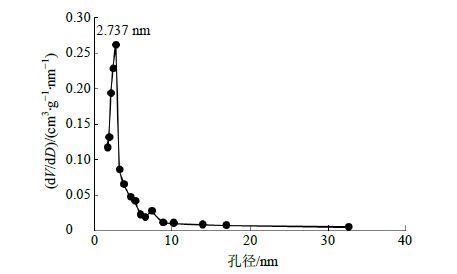
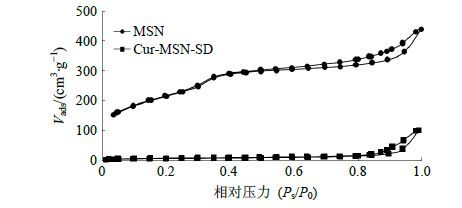
将MSN以及Cur-MSN-SD(选择1∶2的样品为例)样品适量,置于真空干燥箱干燥12 h以上,随后将样品装入样品管中,80 ℃下脱气4 h后,于液氮下测定样品比表面积、孔径分布以及孔容积分析。结果如图 2所示,MSN孔径分布曲线在2~4 nm处出现尖峰,说明MSN具有均匀且较窄的孔径分布,平均孔径为2.737 nm,孔径大小主要分布在10 nm以下(图 2);图 3呈现了MSN和Cur-MSN-SD的氮气吸附/脱附等温线,MSN曲线形状接近IV型吸附/脱附等温线,说明制备的MSN具有典型的介孔(2~50 nm)结构特征。MSN载药前后,吸附比表面积显著下降。经计算,比表面积和孔容积分别为788.6 m2/g和681.8 mm3/g;载药后,Cur-MSN-SD的比表面积和孔容积为25.05 m2/g和157.2 mm3/g,说明Cur已经被吸附到MSN孔道中。
|
图 2 MSN介孔孔径分布 (dV/dD代表吸附总量-孔径微分量) Fig.2 MSN pore diameter distribution (dV/dD is the total adsorption-aperture micro components) |
|
图 3 MSN及Cur-MSN-SD氮气吸附/脱附等温线 (Vads代表吸附气量) Fig.3 Nitrogen adsorption/desorption isotherms of MSN and Cur-MSN-SD (Vads is adsorbed gas content) |
2.5 红外光谱分析
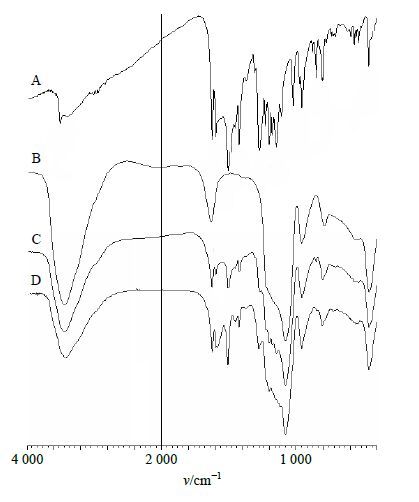
取Cur原药、MSN、Cur与MSN物理混合物(1∶2)以及Cur-MSN-SD(1∶2)适量,分别于KBr压片后进行红外光谱扫描。结果见图 4,Cur的特征吸收峰清晰可见,如O-H 3 510 cm−1,C=C 1 628、1 508 cm−1;MSN的特征吸收峰主要集中在1 086、964、797 cm−1,对应于Si-O-Si产生的振动峰;物理混合物以及Cur-MSN-SD的图谱中均可见Cur的吸收振动峰,而且无明显迁移,说明Cur与MSN并未形成新的化学键,只存在相互作用的范德华力和氢键。
|
图 4 Cur (A)、MSN (B)、Cur与MSN物理混合物 (1∶2,C) 和Cur-MSN-SD(D) 的红外光谱图 Fig.4 FTIR spectra of Cur (A),MSN (B),physical mixture of Cur and MSN (1∶2,C),and Cur-MSN-SD (D) |
2.6 差示扫描量热法(DSC)分析
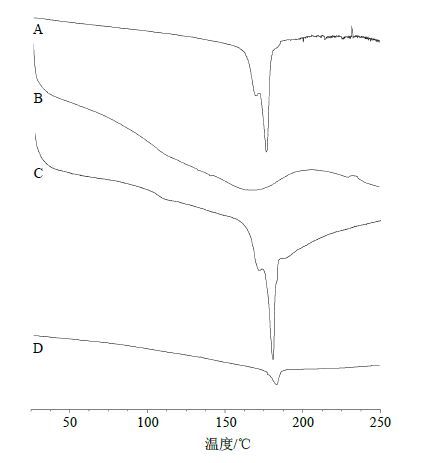
取Cur原药、MSN、Cur与MSN物理混合物(1∶2)以及Cur-MSN-SD(1∶2)适量,分别进行DSC分析。扫描范围:25~250 ℃,扫描速度:10 ℃/min。由图 5可知,Cur原药在177 ℃处有1个明显的吸热峰,对应于Cur的熔点;MSN在100~200 ℃出现吸热峰,可能是纳米粒表面的硅醇基脱去产生的;混合物中,仍可见Cur的吸热峰,而Cur-MSN-SD在177 ℃的吸热峰强度明显降低,可能是少量药物吸附在MSN表面造成的。
|
图 5 Cur (A)、MSN (B)、Cur晶体与MSN物理混合物 (1∶2,C) 和Cur-MSN-SD(D) 的DSC图谱 Fig.5 DSC thermograms of Cur (A),MSN (B),physical mixture of Cur and MSN (1∶2,C),and Cur-MSN-SD (D) |
2.7 溶出度比较 2.7.1 标准曲线的建立
精密称取Cur对照品,用无水乙醇配制成105.0 μg/mL的溶液,得对照品储备液。精密量取储备液适量,分别置于10 mL量瓶中,用0.2% SDS溶液稀释至刻度,摇匀,得到质量浓度分别为0.526、1.052、2.104、4.208、6.312、8.416 μg/mL工作液,运用紫外分光光度计测定各质量浓度样品在425 nm检测波长下的吸光度(A)[19]。将A和质量浓度进行回归,得到回归方程Y=0.137 X-0.002,r=0.999 9,表明Cur在0.526~8.416 μg/mL线性关系良好。高、中、低3种质量浓度样品的加样回收率分别为(102.10±1.36)%、(98.50±3.76)%、(95.90±4.35)%,日内精密度RSD为2.65%,日间精密度RSD为3.58%,符合要求。
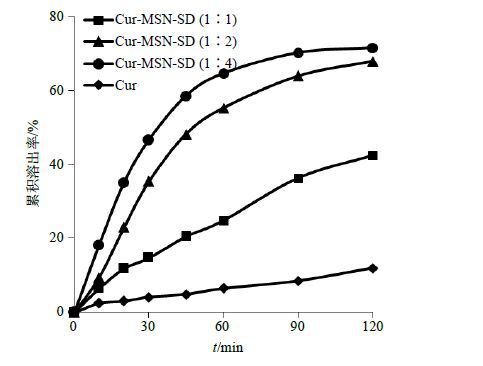
2.7.2 溶出度测定按照《中国药典》2015年版规定的溶出度测定法第二法(桨法)进行实验[20]。以0.2% SDS水溶液900 mL为溶出介质,转速为100 r/min,水浴温度为(37.0±0.5)℃。将精密称取的Cur以及各种比例Cur-MSN-SD(均含有约10 mg Cur),分别均匀分散到介质中,分别于5、10、20、30、45、60、90、120 min取样5 mL,并补加预热的等量溶出介质。样品立即以15 000 r/min离心3 min,取上清液于425 nm检测波长下测定A。所得A值根据回归方程计算药物累积溶出度。每个样品平行试验6次,计算平均值,绘制累积溶出率曲线。结果如图 6所示,可见SD的溶出速率均明显快于Cur原药,随着MSN用量的增加,Cur-MSN-SD中药物的溶出速率和相同时间点的累积溶出率均明显增加,其中以Cur-MSN(1∶4)时制备的Cur-MSN- SD溶出效果最好,120 min累积溶出率可达71.49%。
|
图 6 累积溶出率曲线比较 (n= 6) Fig.6 Comparison on cumulative dissolution curves (n = 6) |
2.8 溶解度比较
取过量Cur以及Cur-MSN-SD(1∶4)置于10 mL容量瓶中,加入溶液后,超声得到过饱和溶液,再置于25 ℃恒温振荡器内振摇24 h,使其达到溶解平衡。取出样品15 000 r/min离心10 min,取上清液适当稀释后于245 nm处测定A值,计算溶解度。Cur在水和0.2% SDS溶液中的溶解度分别为(0.23±0.08)和(51.48±4.60)μg/mL,而Cur-MSN- SD在上述2种溶液中的溶解度(以Cur计算)分别为(2.48±0.17)和(338.20±21.90)μg/mL,可见Cur-MSN-SD显著增加了Cur的溶解度。
3 讨论MSN作为一种生物相容性好、载药性能强的无机物载体,在药剂学领域有很好的应用前景,近年来正日益受到关注,但目前MSN多限于化学药的载药[21-24],对中药及其有效成分的载药研究报道较少。本实验创新地采用MSN作为载体,解决姜黄素水溶性差的问题,为MSN在中药及其有效成分载药领域的研究提供了新思路。
在溶出度样品制备过程中,通常会选用0.22 μm或0.45μm的微孔滤膜过滤样品,以便紫外测定。在本研究中,由于所制备的Cur-MSN-SD粒径约为100 nm,采用上述方法不可能完全除去Cur-MSN- SD,会严重影响紫外测定结果;同时,在实验中发现,滤膜对Cur有较强的吸附作用,这也势必会影响测定的准确性,因此本研究参照了黄秀旺等[25]采用的取样后短时间高速离心的方法,以便后续测定准确且方便。Cur具有较强的生物活性,但由于其极低的水溶性,生物利用度低,限制了其药效的发挥。为了解决上述问题,有研究报道可采用PVP、F68等高分子材料与Cur制备SD[25-26]。本研究中,首次报道了运用MSN为载体,与Cur形成SD,实现增加Cur溶出速率和溶解度的目的。MSN良好的生物相容性及生物可降解性能,使得Curr-MSN-SD具有良好的应用前景,这也为后期的进一步研究奠定了基础。
| [1] | 张梦翔, 施高翔, 严园园, 等. 姜黄素对5种非白念珠菌菌丝及生物膜形成的抑制作用[J]. 中草药 , 2015, 46 (4) :549–553. |
| [2] | Babaei E, Sadeghizadeh M, Hassan M, et al. Dendrosomal curcumin significantly suppresses cancer cell proliferation in vitro and in vivo[J]. Int Immunopharmacol , 2012, 12 (1) :226–234. |
| [3] | 李小江, 贾英杰, 张文治, 等. 姜黄素对A549细胞亚群SP及NON-SP细胞凋亡的诱导作用[J]. 中草药 , 2013, 44 (18) :2581–2584. |
| [4] | Cai X Z, Wang J, Li X D, et al. Curcumin suppresses proliferation and invasion in human gastric cancer cells by downregulation of PAK1 activity and cyclin D1 expression[J]. Cancer Biol Ther , 2009, 8 (14) :1360–1368. |
| [5] | 狄建彬, 顾振纶, 赵笑东, 等. 姜黄素的抗氧化和抗炎作用研究进展[J]. 中草药 , 2010, 41 (5) :853–856. |
| [6] | 郭立达, 薛佳伟, 渠开跃, 等. 姜黄素联合奥沙利铂对人结肠癌LoVo细胞裸鼠移植瘤的抗癌作用研究[J]. 中草药 , 2013, 44 (16) :2261–2266. |
| [7] | Anand P, Kunnumakkara A B, Newman R A, et al. Bioavailability of curcumin: problems and promises[J]. Mol Pharm , 2007, 4 (6) :807–18. |
| [8] | 李纳, 汤丹丹, 王丽雯, 等. 喷雾干燥法制备姜黄素磷脂复合物壳聚糖微球干粉吸入剂及其表征[J]. 中草药 , 2014, 45 (17) :2475–2481. |
| [9] | 柯秀梅, 杨荣平, 郭响香, 等. 自乳化释药系统(SEDDS) 对姜黄素类组分增溶作用的研究[J]. 中草药 , 2014, 45 (7) :935–941. |
| [10] | 戴东波, 尤佳, 何雯洁, 等. 姜黄素聚乙二醇-聚乳酸嵌段共聚物纳米粒的制备及其质量评价[J]. 中草药 , 2014, 45 (2) :194–199. |
| [11] | 张玉霞, 贾运涛, 田睿, 等. 新型载姜黄素结肠定位胶囊的制备及其体外释药行为研究[J]. 中草药 , 2014, 45 (1) :42–45. |
| [12] | 琚辉, 郝存江, 尹飞, 等. 姜黄素固体脂质纳米粒的制备及表征[J]. 药物评价研究 , 2010, 33 (6) :420–426. |
| [13] | Slowing I I, Vivero-Escoto J, Wu C W, et al. Mesoporous silica nanoparticles as controlled release drug delivery and gene transfection carriers[J]. Adv Drug Deliv Rev , 2008, 60 (11) :1278–1288. |
| [14] | Wang Y, Zhao Q, Han N, et al. Mesoporous silica nanoparticles in drug delivery and biomedical applications[J]. Nanomedicine , 2015, 11 (2) :313–327. |
| [15] | Park S B, Joo Y H, Kim H, et al. Biodegradation-tunable mesoporous silica nanorods for controlled drug delivery[J]. Mater Sci Eng C Mater Biol Appl , 2015, 50 (1) :64–73. |
| [16] | 郭曼曼, 王国伟, 徐骏军, 等. 载三氧化二砷pH值响应介孔二氧化硅纳米粒的制备及体内外评价[J]. 中草药 , 2015, 46 (7) :982–989. |
| [17] | Xu W, Riikonen J, Lehto V P. Mesoporous systems for poorly soluble drugs[J]. Int J Pharm , 2013, 453 (1) :181–197. |
| [18] | 王彦竹, 孙立章, 宋爱华, 等. 介孔二氧化硅纳米粒的制备及对载药与药物溶出度的影响[J]. 沈阳药科大学学报 , 2012, 29 (4) :258–263. |
| [19] | 张李巧, 栾立标, 吴炎, 等. 姜黄素CTPP-PEG-PCL胶束的制备及体外评价[J]. 中国中药杂志 , 2013, 38 (13) :2109–2113. |
| [20] | 中国药典 [S]. 四部. 2015. |
| [21] | 王天怡, 赵勤富, 韩旭, 等. 介孔二氧化硅制备尼莫地平纳米固体分散体[J]. 中国药学杂志 , 2014, 49 (13) :1139–1145. |
| [22] | 王彦竹, 赵勤富, 孙清, 等. 两种介孔二氧化硅载体用于改善西洛他唑溶出度的比较[J]. 沈阳药科大学学报 , 2014, 31 (1) :1–8. |
| [23] | 徐爱仁, 马卫成, 应景艳, 等. 载多柔比星介孔二氧化硅-聚乙二醇纳米粒的制备及体外评价[J]. 中国药学杂志 , 2011, 46 (24) :1901–1905. |
| [24] | 任丽霞, 王柏. 卡维地洛-中空介孔二氧化硅固体分散体的制备与表征[J]. 中国药科大学学报 , 2014, 45 (1) :59–64. |
| [25] | 黄秀旺, 许建华, 吴国华, 等. 姜黄素固体分散体的制备及体外溶出特性[J]. 福建中医学院学报 , 2008, 18 (5) :30–33. |
| [26] | 黄秀旺, 许建华, 温彩霞. 姜黄素-聚维酮固体分散体的制备及溶出度的测定[J]. 中国医院药学杂志 , 2008, 28 (21) :1819–1822. |
 2016, Vol. 47
2016, Vol. 47


