绞股蓝Gynostemma pentaphyllun (Thunb.)Makino隶属于葫芦科(Cucurbitaceae)绞股蓝属Gynostemma Bl. 多年生草质攀援藤本植物,在印度、缅甸、越南、老挝、马来西亚、印度尼西亚、朝鲜、日本等国家均有分布,呈典型的亚热带分布类型[1]。我国绞股蓝植物资源非常丰富,主要分布于秦岭南坡、长江流域和淮河流域及其南部广大地区。因其含有与人参皂苷相似的达玛烷型皂苷,又被誉为“南方人参”,引起人们的广泛兴趣和重视。此外,绞股蓝还含有氨基酸、蛋白质、小分子多糖、脂肪、黄酮类、微量元素和维生素等生物活性物质。现代药理研究表明,绞股蓝具有降血糖、调血脂、抗肿瘤、抗氧化、抗衰老、增强免疫力等多种功效[2, 3, 4, 5, 6]。
迄今为止,在绞股蓝种质资源的收集、保存、分类鉴定及栽培育种等方面取得了一定的进展[7, 8, 9, 10],但仍然存在不少问题,其中种质分类鉴定困难及品系混乱问题尤为突出。长期以来,对绞股蓝种质分类鉴定多是根据其表型性状的差别,而遗传多样性的差异更重要的是表现在蛋白质、染色体和DNA水平上。分子标记的发展为从DNA水平检测种质资源的遗传多样性,区别鉴定不同种质提供了有利的工具。目前DNA标记技术已有几十种[10],其中ISSR(inter-simplesequence repeats)是由加拿大蒙特利尔大学Zietkiewice等[11]于1994年提出的一种建立在PCR反应基础上的新型微卫星类分子标记,即简单序列重复区间扩增多态性的分子标记。该技术是基于SSR标记基础上发展而来,其基本原理是利用若干串联重复碱基和几个非重复的锚定碱基所组成的序列作为引物,对两侧具有反向排列SSR的一段基因组DNA序列进行扩增,扩增产物会获得较多大小不一的片段,经电泳后,片段在凝胶上的位置能显示不同样品间的ISSR标记差异[12]。该技术无需预知基因组背景信息,具有DNA样品用量少、操作简单快捷、实验成本低等优点,且稳定性较高,实验重复性好,更适合大批量样本的检测[13]。近年来已广泛应用于各种种质资源的鉴定、遗传关系和遗传多样性分析以及种质资源指纹图谱的建立[14, 15, 16, 17]。
绞股蓝作为我国重要的药用植物资源,已被列为《中国重点保护植物名录》II级保护,说明其自然植物资源已经受到了外在环境和人类活动的严重威胁[18]。近年来由于大量的人为采挖和利用,致使其野生资源变得更为稀少。因此,广泛而深入地开展绞股蓝种质资源的调查、收集并对其遗传多样性进行研究已变得十分必要和迫切。庞敏等[19]利用RAPD分子标记技术,从66个随机引物中筛选出5个多态性好的引物,构建了19份绞股蓝种质的指纹图谱,并对其进行聚类分析,初步探讨了绞股蓝种质的遗传多态性。Wang等[20]利用ISSR分子标记研究了绞股蓝14个居群的遗传多态性和地理结构。结果表明,ISSR标记能有效揭示绞股蓝居群间的遗传分化和分子变异水平,但取材范围相对较狭窄。本研究采用ISSR分子标记对本实验室收集的来自全国12个省市区不同生态环境的野生绞股蓝种质资源的遗传多样性和亲缘关系进行分析,取材范围更为广泛,生境条件更为复杂,目的在于从分子水平上揭示整个基因组的遗传变异及遗传多样性,从而为全面掌握绞股蓝种质资源,加强资源的有效保护和合理利用提供科学参考依据。
1 材料和方法 1.1 材料绞股蓝种质材料是本实验室于2012—2013年5~8月采自云南、贵州、四川、重庆、陕西、河南、湖北、湖南、安徽、浙江、广西、福建省市区共48份,经陕西师范大学植物教研室田先华教授鉴定为葫芦科绞股蓝属植物绞股蓝Gynostemma pentaphyllum (Thunb.) Makino。野外采集时,详细记录其生境和生物学特性等信息后,采挖植株根茎移栽成活至陕西省平利县绞股蓝种植基地的种质资源圃内,并进行编号及相关信息整理及记录,具体来源见表 1。
| 表 1 材料及来源 Table 1 Experimental materials and sources |
以种质资源圃内生长1年的植株为植物材料,采集其幼嫩叶片装入塑封袋内,每袋8~10片小叶,加入硅胶,使硅胶充满到袋子的2/3,保持少量空气封袋,确保叶片与硅胶混匀,以便快速干燥。第1次加入的硅胶量一定要充足,确保叶片完全干燥,待叶片彻底干燥后存放于−80 ℃的冰箱中备用。每个材料选取5株,等量嫩叶混合提取总DNA。
1.2 方法 1.2.1 总DNA的提取及检测采用改良CTAB法提取植物基因组DNA,用1%琼脂糖凝胶电泳检测DNA浓度及完整度,经核酸蛋白分析仪测定质量浓度和相对纯度后,将其稀释至20 ng/μL终质量浓度,−20 ℃保存备用。
1.2.2 引物的筛选本实验根据加拿大哥伦比亚大学(University ofBritish Columbia,UBC)核算蛋白工作室公布的100条ISSR引物序列设计,由北京华大基因科技服务公司合成。随机挑选3个样本对100条引物进行筛选,最终筛选出结果稳定、背景清晰且多态性好的引物用于绞股蓝种质材料样本的分析。
1.2.3 PCR扩增及检测ISSR-PCR扩增反应体系采用本实验室优化后的体系:总体积20 μL,包含2 μL 10×PCR 缓冲液、模板DNA 40 ng、Mg2+ 2.0 mmol/L、dNTPs 0.25 mmol/L、引物0.8 μmol/L、TaqDNA聚合酶1.0 U。扩增反应程序为94 ℃预变性5 min,之后94 ℃变性45 s,40~60 ℃退火30 s,72 ℃延伸2 min,进行35个循环,最后延伸8 min,4 ℃保存。反应产物在含有EB(ethidium bromide,溴化乙锭)的2%琼脂糖凝胶中电泳分离,在凝胶成像系统中检测并照相。
1.2.4 数据处理与分析ISSR通常被认为是显性标记,视每条多态性为一个等位基因。凝胶上相同迁移率位置上有DNA条带的记为1,没有DNA的记为0,将结果输入Excel表格,得到ISSR表型数据矩阵。利用POPGENE 32(Version 1.32)软件计算ISSR-PCR扩增产物的多态位点数、多态性位点比率(PPL)、观测等位基因数(Na)、有效等位基因数(Ne)、Nei’s基因多样性指数(H)、Shannon多样性信息指数(I)。运用NTSYS-PC(Version 2.10e)软件的Similarity程序下Qualitatice data 对原始矩阵进行Nei遗传相似系数(genentic similarity,GS)计算,选用Clustering中ANAN程序的非加权成组配对算术平均法(UPGMA)对绞股蓝种质材料进行相似系数聚类分析,最后在Graphic中的Tree plot程序下建立树状图[21]。
2 结果与分析 2.1 ISSR扩增产物及多态性分析利用筛选出的最优反应体系及反应程序,从100条ISSR引物里最终筛选出特异性好、多态性高且重现性好的15条引物,用于48份绞股蓝种质材料基因组DNA的PCR扩增,其中引物UBC-807对48份种质的扩增图谱见图 1。据表 2的统计结果显示,15条引物共扩增出214个位点,其中多态性位点206个,平均PPL达96.26%;每个引物扩增位点10~18个,平均14.27个,其中多态性位点9~18个,平均13.73个;引物UBC-807、UBC-862、UBC-866、UBC-887、UBC-888、UBC-889、UBC-891、UBC-895引物多态性比率都高达100%,引物UBC-834的多态性最低也达88.24%,其中UBC-888扩增位点最多,为18个,引物UBC-864扩增位点最少。这说明供试绞股蓝种质资源间存在较高的遗传变异,且ISSR分子标记能有效地从分子水平上揭示材料间的多态性。
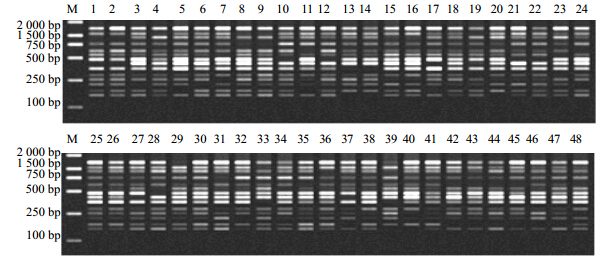 | 1~48为绞股蓝,编号同表 1 M-Marker 1—48-Accession of G. pentaphyllungermplasm reseources, numbers were showed in Table 1 M-Marker 图 1 引物UBC-807对48份绞股蓝种质资源扩增图谱Fig.1 ISSR amplification result of G. pentaphyllun with Primer UBC-807 |
| 表 2 引物序列及位点多态性 Table 2 Sequence and amplified loci polymorphism of 15 primers |
将48份绞股蓝种质材料的ISSR扩增谱带输入POPGENE32软件中进行分析,结果表明,绞股蓝种质材料的平均Na、Ne、I和H分别为1.962 6、1.3358、0.221 1和0.3598。
2.3 遗传相似性分析GS是用来比较群体或个体间相似程度的度量参数,平均相似系数越高,说明相似程度越大,遗传背景一致性越强[22]。48份绞股蓝种质材料间的GS变化范围为0.57~0.96,平均为0.72。由GS获得的次数分布图(图 2)可知,遗传相似性系数主要集中在0.60~0.75内,所占比例高达88.21%,说明不同生态环境绞股蓝的遗传性状差异较大,多样性较高。其中亲缘关系最近的是来源于广西金秀的2份种质,GS值为0.96;GS最低的来源于广西阳朔1和四川青城1 2份种质,GS值为0.57,亲缘关系最远。由此可知48份绞股蓝种质资源遗传变异水平较高,可作为育种材料来源。
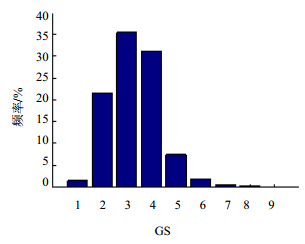 | 1-0.55~0.60 2-0.60~0.65 3-0.65~0.70 4-0.70~0.75 5-0.75~0.80 6-0.80~0.85 7-0.85~0.90 8-0.90~0.95 9-0.95~1.00 图 2 48份绞股蓝种质资源遗传相似性系数的次数分布Fig.2 Genetic similarity coefficient of frequency distribution on 48 G. pentaphyllun germplasm reseources |
利用NTsys-pc1.2e软件的UPGMA对48份绞股蓝种质材料进行聚类分析并建立聚类分支树状图(图 3)。结果显示,供试材料以遗传相似系数0.71为分界限,聚为4大类:第I类共计14份种质材料,分别为源自陕西7份、福建4份、安徽2份、浙江杭州1份;第II类共计15份种质材料,分别源自河南2份,广西5份,湖北5份,福建、贵州、云南各1份;第III类最少,共计6份,分别为云南勐腊、云南景洪药用植物园、广西阳朔1和2各1份及广西金秀2份;第IV类共计13份种质材料,分别源自贵州3份,湖南2份,四川2份,湖北3份,云南、陕西和重庆各1份。
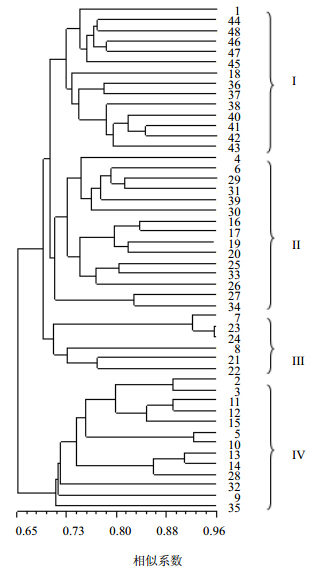 | 1-0.55~0.60 2-0.60~0.65 3-0.65~0.70 4-0.70~0.75 5-0.75~0.80 6-0.80~0.85 7-0.85~0.90 8-0.90~0.95 9-0.95~1.00 图 3 48份绞股蓝种质资源UPGMA聚类图Fig.3 Dendrogram of cluster analysis based on ISSR of 48 G. pentaphyllun germplasm reseources |
育种实践表明,每个优良品种的产生均有赖于优良基因的发现和利用。鉴定、分析种质材料及其遗传多样性是发现新的基因资源、改良现有育种材料和选育新品种的基础性工作[23]。植物分子生物学尤其是分子标记的发展使得植物资源的遗传背景更为清晰变为可能,从DNA水平上揭示样本材料间遗传多样性和亲缘关系不受环境条件、发育时期、器官种类等的限制。亲本间遗传差异大说明亲缘关系较远,杂交优势明显提高,这对种质资源的保护和有效利用具有重要意义。
本研究通过ISSR标记对来自云南、贵州、四川、重庆、陕西、河南、湖北、湖南、安徽、浙江、广西、福建12个省市区共48份野生绞股蓝种质材料进行遗传多样性分析。材料来源地囊括了绞股蓝在我国分布的大部分地区,具有明显的地域代表性。结果分析显示,15条ISSR引物共检测到214个位点,平均PPL为96.26%;48份种质材料平均I和H分别为0.221 1和0.359 8,遗传相似系数变幅为0.57~0.96,平均为0.72,这表明绞股蓝在长期的适应和进化过程中形成了广泛的遗传变异,不同种质材料间存在着丰富的遗传变异。
UPGMA聚类分析显示,以遗传系数0.71为界,将48份种质划分为4大类,其中第I类中包括来自陕西和福建的绝大部分种质,表明陕西和福建的绞股蓝种质亲缘关系更为紧密,此外,安徽和浙江杭州的种质材料也聚在了第I类中;来自湖北宣恩、恩施、房县、神农架和广西大新、扶绥、桂林的种质则聚类在第II类中;而来自广西阳朔和金秀的4份种质则聚类在第III类中;第IV类则囊括了来自重庆、四川、湖南、湖北、陕西、云南及贵州的大部分种质。由此可见,聚类结果与其地理距离远近和生态环境并不完全一致,这与Wang等[20]的研究结果一致。很多种质并未按种源聚类在一起,不同种源的种质存在明显的交叉聚类现象,这些地区的种质表现出较大的地域分布差异性,即各种种质材料间的遗传分化程度较大,并且没有依据地理位置的渐变而呈现出遗传距离上的渐变规律,如来自云南的种质材料分散聚类在II、III、IV类中。推测绞股蓝野生自然居群的分化可能是因为其生活史特性、地理隔离与人类活动综合作用的结果。近年来由于大量的人为开发和利用,致使绞股蓝自然植物资源逐渐变的稀少,居群大量呈现片段化分布状态,加之绞股蓝适宜阴湿、温和的气候,其生活环境多在山涧、林下、小溪边等荫蔽处,导致了明显的居群遗传分化。生境片段化不仅影响生态系统的种类组成、数量结构、生态过程以及非生物因素,同时也会对物种的遗传结构产生较大的影响[24]。因此,在后续的开发应用中,继续广泛而深入地收集更多地区的绞股蓝种质资源建立种质资源圃的同时,也该注重对野生绞股蓝种质资源的原生境保护工作,建立绞股蓝地方种质资源库,并加强当地农户和科普教育,防止人类活动对野生绞股蓝种质资源的破坏,保护其独特的基因资源,为绞股蓝的遗传生物学进化和物种形成等研究奠定必要分子基础。
本研究结果表明,ISSR标记能有效区分绞股蓝种质材料,检测其遗传多样性水平,这为后续利用ISSR技术构建绞股蓝DNA指纹图谱奠定了基础。此外,本研究较为全面地揭示了所收集的绞股蓝种质材料遗传背景,为绞股蓝种质资源全面、有效利用提供了重要理论依据,并且可将ISSR聚类分析结果直接应用到选育工作中,选择亲缘关系较远的材料,增加后代的遗传变异,选育出杂交优势强、综合性状良好的优良品种,为绞股蓝品种的改良和优良新品种的培育提供了方便,减少育种工作中亲本选配的盲目性。
| [1] | 陈书坤. 绞股蓝属植物的分类系统和分布 [J]. 植物分类学报, 1995, 33(4): 403-410. |
| [2] | 黄萍, 陈竞龙, 张雷, 等. 绞股蓝皂甙对2型糖尿病肾病的血脂、微量白蛋白尿的影响 [J]. 中国现代医学杂志, 2007, 17(2): 206-207. |
| [3] | Wang Z J, Luo D H. An-tioxidant activities of different fractions of polysaccharide purified from Gynostemma pentaphyllum Makino [J]. Carbohydr Polym, 2007, 68(1): 54-58. |
| [4] | Lu H F, Chen Y S, Yang J S, et al. Gypenoside induced G0/G1 arrest via inhibition of cyclin E and induction of apoptosis via activation of caspase-3 and -9 in human lung cancer A-549 cells [J]. In Vivo, 2008, 22(2): 215-221. |
| [5] | Chen J C, Lu K W, Tsai M L, et al. Gypenosides induced G0/G1 arrest via CHk2 and apoptosis through endoplasmic reticulum stress and mitochondria-dependent pathways in human tongue cancer SCC-4 cells [J]. Oral Oncol, 2009, 45(3): 273-283. |
| [6] | 张涛, 袁弟顺. 中国绞股蓝种质资源研究进展 [J]. 云南农业大学学报, 2009, 24(3): 460-464. |
| [7] | 刘金龙. 药用植物绞股蓝新品种"恩七叶田"的选育及栽培技术与系列产品的研究 [D]. 武汉: 华中农业大学, 2006. |
| [8] | 庞敏. 药用植物绞股蓝种质资源研究 [D]. 西安: 陕西师范大学, 2006. |
| [9] | 张涛. 绞股蓝种质资源库的建立及其主要活性成分的研究 [D]. 福州: 福建农林大学, 2009. |
| [10] | 周延清. DNA分子标记技术在植物研究中的应用 [M]. 北京: 化学工业出版社, 2005. |
| [11] | Zietkiewicz E, Rafalski A, Labuda D. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification [J]. Genomics, 1994, 20: 176-183. |
| [12] | 吴志祥, 潘俊松. 利用ISSR对矮牵牛品种遗传多样性的聚类分析 [J]. 上海交通大学学报: 农业科学版, 2012, 30(2): 36-44. |
| [13] | 孔祥彬, 张春庆, 许子锋. DNA指纹图谱技术在作物品种 (系) 鉴定与纯度分析中的应用 [J]. 生物技术, 2005, 15(4): 74-77. |
| [14] | 黄颖桢, 陈菁瑛, 赵云青, 等. 金线莲遗传多样性的ISSR分析 [J]. 中草药, 2014, 45(15): 2230-2234. |
| [15] | 王薇, 刘超, 崔九成, 等. 珠子参种质资源遗传多样性的ISSR分析 [J]. 中草药, 2014, 45(17): 2525-2529. |
| [16] | 贾媛, 李忠海.ISSR指纹图谱技术在种质资源研究上的应用 [J] 河北农业科学, 2013, 17(5): 63-68. |
| [17] | 朱田田, 晋玲, 杜弢, 等. 基于ISSR的甘肃中麻黄遗传多样性研究 [J]. 中草药, 2014, 45(12): 1764-1768. |
| [18] | 李忠虎, 刘占林, 赵鹏, 等. 绞股蓝属植物系统进化研究进展述评 [J]. 西北植物学报, 2012, 32(10): 2133-2138. |
| [19] | 庞敏, 邹芳平, 肖娅萍. 应用RAPD技术构建绞股蓝DNA指纹图谱 [J]. 陕西师范大学学报: 自然科学版, 2006, 34(3): 87-91. |
| [20] | Wang C, Zhang H, Qian Z Q, et al. Genetic differentiation in endangered Gynostemma pentaphyllum (Thunb.) Makino based on ISSR polymorphism and its implications for conservation [J]. Biochem Syst Ecol, 2008, 36: 699-705. |
| [21] | Nei M. Estimation of average heterozygosity and genetic distance from a small number of individuals [J]. Genetics, 1978, 89(3): 583-590. |
| [22] | 刘欢, 慕平, 赵桂琴. 燕麦种质资源遗传多样性的ISSR研究 [J]. 草叶学报, 2012, 21(4): 116-124. |
| [23] | 张怀山, 夏曾润, 栗孟飞, 等. 中型狼尾草种质资源遗传多样性的ISSR分析 [J]. 西北植物学报, 2014, 34(2): 256-264. |
| [24] | 陈小勇. 生境片断化对植物种群遗传结构的影响及植物遗传多样性保护 [J]. 生态学报, 2000, 20(5): 884-892. |
 2015, Vol. 46
2015, Vol. 46


