2. 赛默飞世尔科技中国有限公司, 上海 201206
2. ThermoFisher Scientific Corporation, Shanghai 201206, China
人参皂苷是三七Notoginseng Radix et Rhizoma、人参Ginseng Radix et Rhizoma等五加科植物中所含有的一类重要活性化合物[1-2],对中枢神经系统[3]、免疫系统[4]、心血管系统[5-6]都有药理作用。以人参、三七潜方入药的复方中药品种众多[7],部分药物在临床中的应用较为广泛[8]。由于药材的不同药用部位[9-10]、产地、生长年限和加工炮制方法[11-12]等因素影响均会引起总皂苷和单体皂苷量的变化,且不同用药部位或单体的药理作用具有多样性[13],决定了人参功效的发挥是多组分协同作用的结果。因此,需要对人参中多组分的量和比例进行研究,才能科学地评价和控制中药质量。液相色谱法是人参皂苷测定的主要方法[14-19]。然而当前液相色谱方法仍存在以下问题:一是方法主要以测定药材或提取物为主,以人参为君药的中药复方大多尚未建立人参皂苷的定量测定方法;二是部分以人参为君药的复方中药虽有人参皂苷的测定项,但测定成分较少,仅测定人参皂苷Rg1、Re等[16]少数几个量较高的成分,无法满足中药复方的质量控制要求;三是无论药材或中成药,样品制备过程极其复杂,尤其是提取过程,耗时费力,严重影响实际样品分析效率;四是各测定方法中样品提取方法、净化方法和色谱分析条件各异,方法缺乏普适性。因此建立简便、快速并能同时测定中药复方中多种人参皂苷的定量测定方法亟待解决。另外基于“一法多用(monomethod-heterotrait matrix)”[20]的思路,对于含有同类成分的不同中药或产品,采用统一的仪器分析方法,也具有重要的实际意义。
由于中药基质成分极其复杂,结构相近或类似化合物众多,常规色谱分离能力有限。近年来,随着商品化二维液相色谱仪器技术的逐渐成熟,结合多种分离模式的多维液相色谱法在中药分析应用中已越来越多[21-22],按照一维色谱的馏分是否直接转移到第二维色谱柱中,可分为离线二维(offline 2D)和在线二维(online 2D),其中在线二维液相色谱具有自动化程度高、分析速度快等优点,适于实际大量样品的检测分析。在线二维液相色谱按照一维馏分是否全部转移至第二维色谱柱中,又可分为全二维(LC×LC)和中心切割(LC-LC)模式,后者可选择性将目标成分进行分析,具有更好的普适性和可操作性,更适于定量分析。但在多组分定量过程中,传统二维中心切割通常采用1个或2个采样环的接口设计,常因第二维分离速度限制,导致采样频率的降低,造成系统分离能力的损失,尤其对于结构相似、保留时间相近的化合物的分离。集合有多个采样环的选择性全二维液相色谱(sLC×LC)法[23],可打破一维分离的色谱峰宽和二维分析速度的联系,能选择性地切割多个目标分析物,因此可充分优化和发挥一维色谱分离能力,而不再受制于低采样频率的影响[24],从而提升整体的二维系统的分离能力。在复杂基质的多组分分析中具有重要的应用前景。本实验根据sLC×LC法原理,构建了在线二维多中心切割液相色谱系统(online multi heart-cutting 2D LC,MHC-2D LC),并初步建立了三七、人参及其提取物,以及人参相关复方生脉注射液(SI)、参苓白术颗粒(SLBG)、血塞通注射液(XI)中8种人参皂苷的定量分析方法。
1 仪器与材料双三元液相色谱系统,配置有6通道真空脱气机SRD3600,双梯度分析型色谱泵DGP3600,二极管阵列检测器DAD3000,柱温箱TCC-3000,配有1个2位置6通切换阀,美国赛默飞世尔科技公司;6位置14通切换阀,美国IDEX公司;快速溶剂萃取仪ASE350,美国赛默飞世尔科技公司;Accucore phenyl-X(100 mm×2.1 mm,2.6 μm)、Accucore C18(50 mm×4.6 mm,2.6 μm),美国赛默飞世尔科技公司。正丁醇、三氯甲烷,分析纯,国药集团化学试剂有限公司;乙腈、甲醇,色谱纯,Fisher;去离子水,18.2 MΩ,Millipore纯水机;对照品人参皂苷Rg1(Rg1,供定量测定用,质量分数按96.3%计)、人参皂苷Re(Re,供定量测定用,质量分数按92.7%计)、人参皂苷Rf(Rf,供定量测定用,质量分数≥98%)、人参皂苷Rb1(Rb1,供定量测定用,质量分数按92.9%计)、人参皂苷Rb2(Rb2,供定量测定用,质量分数按94.8%计)、人参皂苷Rd(Rd,供定量测定用,质量分数按94.4%计)、人参皂苷Rb3(Rb3,供定量测定用,质量分数按92.7%计),中国食品药品检定研究院;对照品人参皂苷Rc(Rc,质量分数99%),北京上立方联合化工技术研究院。人参、三七购自上海养和堂药店,经上海中医药大学中药研究所王峥涛教授鉴定,人参为五加科人参属植物人参Panax ginseng C. A. Mey.的干燥根和根茎,三七为五加科人参属植物Panax notoginseng (Burk.) F. H. Chen的干燥根和根茎;红参粉、人参茎叶总皂苷提取物(TGGSL,总皂苷>80%),吉林宏久生物科技有限公司;SI,江苏苏中药业集团股份有限公司,批号15093002;SLBG,北京同仁堂股份有限公司,批号15111004;XI,由昆明制药集团股份有限公司提供,批号12EL03。
2 方法与结果 2.1 对照品溶液配制取人参皂苷Rg1、Re、Rf、Rb1、Rc、Rb2、Rb3、Rd对照品适量,精密称定,置10 mL量瓶中,加甲醇溶解并定容至刻度,制成质量浓度分别为2.6、2.6、2.5、2.6、2.0、2.2、2.6、2.6 mg/mL的对照品储备溶液。取上述对照品储备溶液各1 mL,置10 mL量瓶中,加甲醇分别稀释至一定量,制成混合对照品溶液。
2.2 样品溶液制备方法 2.2.1 人参、红参、三七药材粉末和SLBG人参、红参和三七粉碎成粉末,过4号筛,各取1 g,SLBG取3 g,精密称定,与硅藻土混匀后至10 mL萃取池中,采用加压溶剂萃取法,萃取溶剂分别为三氯甲烷和水饱和正丁醇。萃取温度为140 ℃,压力10 MPa[25],先采用三氯甲烷萃取2次,弃去萃取液,再采用水饱和的正丁醇溶液萃取2次,收集萃取液[25]。以水饱和的正丁醇溶液定容至25 mL量瓶中,混匀后,准确量取5 mL在水浴蒸干后,以5 mL甲醇溶解,滤过后进样分析。
2.2.2 其他精密称取TGGSL 20 mg置10 mL量瓶中,加甲醇溶解并定容后,滤过进样分析。精密取SI样品1 mL置10 mL量瓶中,加水定容至刻度,即可进样分析。精密取XI 2 mL置10 mL量瓶,加水定容至刻度,即可进样分析。
2.3 色谱条件一维分析泵的流动相A为乙腈,B为0.1%磷酸水溶液,采用Accucore phenyl-X(100 mm×2.1 mm,2.6 μm)为第一维分析柱,梯度洗脱:0~2 min,95% B;2~14 min,95%~72% B;14~25 min,72%~60% B;25~36 min,60%~5% B;体积流量为0.4 mL/min;柱温30 ℃,检测波长203 nm,进样量5 μL。二维分析泵的流动相A为乙腈,B为0.1%磷酸水溶液,采用Accucore C18(50 mm×4.6 mm,2.6 μm)为二维分析柱,每3分钟为1个循环,梯度洗脱:0~0.5 min,2% A;0.5~2.0 min,2%~45% A;2.0~2.5 min,45%~2% A;2.5~3 min,2% A。体积流量为2.0 mL/min,柱温30 ℃,检测波长203 nm。系统流路连接见图 1。
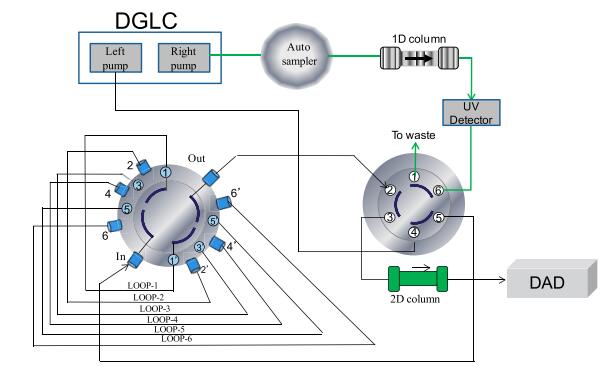
|
图 1 在线多中心切割二维分离系统连接 Fig.1 Flow scheme of online multi heart-cutting two dimensional column switching system |
按照本色谱条件,分别进样混合对照品和人参药材样品溶液,分离色谱图如图 2所示,本法在50 min内完成8种人参皂苷的测定,各化合物分离良好,无基质成分干扰,可进行准确定量。

|
图 2 8种混合对照品溶液 (A) 和人参药材样品 (B) 在一维 (1D)、二维 (2D) HPLC-UV (203 nm) 分离谱图 Fig.2 1D and 2D HPLC-UV (203 nm) of eight mixed reference substances (A) and GRR sample (B) |
2.4 线性关系考察
分别精密量取混合对照品溶液2.0、1.0、0.2、0.1、0.02 mL置10 mL量瓶中,加甲醇定容至刻度,摇匀后,制成系列质量浓度的对照品溶液,进样5 μL,结果分别为Rg1线性范围0.52~260 μg/mL,线性方程Y=0.340 2 X+0.269 8,R2=0.999 9,LOD(S/N=3:1)为0.17 μg/mL;Re线性范围0.52~260 μg/mL,线性方程Y=0.384 2 X-0.044 4,R2=0.999 9,LOD为0.18 μg/mL;Rf线性范围0.5~250 μg/mL,线性方程Y=0.526 1 X+0.437 2,R2=0.999 9,LOD为0.091 μg/mL;Rb1线性范围0.52~260 μg/mL,线性方程Y=0.346 4 X+0.403 8,R2=0.999 9,LOD为0.041 μg/mL;Rb2线性范围0.52~260 μg/mL,线性方程Y=0.249 7 X+0.221 2,R2=0.999 9,LOD为0.096 μg/mL;Rb3线性范围0.44~220 μg/mL,线性方程Y=0.406 7 X+0.147 9,R2=0.999 9,LOD为0.15 μg/mL;Rd线性范围0.52~260 μg/mL,线性方程Y=0.415 4 X+0.403 5,R2=0.999 9,LOD为0.055 μg/mL;Rc线性范围2.0~200 μg/mL,线性方程Y=0.807 2 X+0.516 5,R2=0.999 9,LOD为0.13 μg/mL。
2.5 精密度试验取质量浓度为52 μg/mL的混合对照品溶液,连续进样5次,结果Rg1、Re、Rf、Rb1、Rb2、Rb3、Rc、Rd保留时间的RSD均小于0.01%;峰面积的RSD分别为0.55%、0.78%、0.93%、0.99%、1.53%、0.86%、0.95%、0.52%。表明方法连续进样的精密度较好。
2.6 重复性和稳定性试验取SI样品,按照“2.2.2”项下方法制备进样溶液,按照“2.3”项下方法进行测定,结果Rg1、Re、Rf、Rb1、Rb2、Rb3、Rc、Rd保留时间的RSD均小于0.01%;质量浓度的RSD分别为2.87%、2.01%、1.47%、1.81%、2.24%、1.50%、1.92%、2.76%。表明方法重复性较好。
取同一SI样品溶液,室温下放置,分别在0、2、4、8、12、16、24 h测定,结果Rg1、Re、Rf、Rb1、Rb2、Rb3、Rc、Rd的峰面积的RSD分别为4.39%、2.72%、2.67%、2.20%、2.51%、4.52%、3.32%、2.28%。结果各目标物的峰面积的RSD%<5%,表明在24 h内样品溶液基本稳定。
2.7 加样回收率试验精密量取SI 6份,每份1 mL,置10 mL量瓶中,分别加入混合对照品溶液(Rg1、Re、Rf、Rb1、Rb2、Rb3、Rc、Rd的质量浓度分别为0.26、0.26、0.25、0.26、0.20、0.22、0.26、0.26 mg/mL)0.5、1、1.5 mL,再加甲醇定容至刻度,摇匀后,进样分析,按照“2.3”项下方法进行测定。计算回收率。结果人参皂苷Rg1、Re、Rf、Rb1、Rb2、Rb3、Rc、Rd的平均回收率分别为100.72%、100.35%、103.47%、94.57%、101.60%、101.85%、99.65%、101.80%,RSD分别为1.34%、0.44%、1.38%、4.58%、2.25%、2.80%、0.74%、2.03%。均满足方法学要求。
2.8 样品测定分别取各样品适量,精密称定,按照“2.2”项下的样品前处理方法制备样品溶液,测定各人参皂苷的量,结果见表 1。其中SI及SLBG样品分离谱图见图 3。
|
|
表 1 样品中8种人参皂苷的定量测定结果 Table 1 Quantitative results of eight ginsenosides in samples |

|
图 3 SI (A) 及SLBG样品 (B) 第二维分离谱图 Fig.3 Two-dimensional chromatographs of SI (A) and SLBG sample (B) |
2.9 样品中8种人参皂苷相对比例分析
除通过人参皂苷的绝对量对人参及其相关复方进行质量评价外,8种人参皂苷的相对比例在区分不同种属、不同入药部位等方面也具有重要参考价值[26-29]。本实验将各样品中所含的8种人参皂苷的相对质量分数绘制成雷达图[30-31](图 4、5),利用雷达图的整体轮廓及其关键皂苷比例(如Rg1/Re)可对不同种属及不同入药部位进行明显区分。如人参皂苷Rx/Rg1或Rx/Re的值常被用做评价人参产品质量[26-27]。XI及三七中人参皂苷Rf、Rc、Rb2、Rb3的相对质量分数较低,而人参皂苷Rg1和Rb1的相对质量分数较高,其中Rg1/Re值显著高于人参及TGGSL,与文献所报道的特征相一致[27],可据此对人参和三七进行区分;人参和人参茎叶中8种皂苷相对质量分数也存在较大差异,前者的Rg1/Re值显著大于后者,且后者所有人参皂苷Rx/Re均小于1,与文献报道特征基本一致[26, 28]。
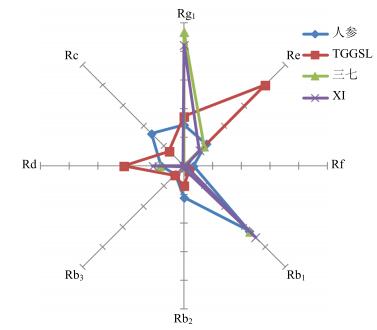
|
图 4 人参、TGGSL和三七、XI中8种人参皂苷的相对质量分数的雷达图 Fig.4 Radar graph of relative contents for eight ginsenosides in GRR, NRR, and XI |
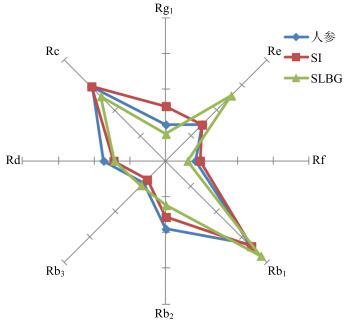
|
图 5 人参、SI和SLBG中8种人参皂苷的相对质量分数的雷达图 Fig.5 Radar graph of relative contents for eight ginsenosides in GRR, SI, and SLBG |
另外在复方评价上,SI与SLBG的总体特征与人参基本类似(图 5),但SLBG在Rg1/Re值上与其他2个有一定差异,可能与其制备工艺过程相关,需要继续进行深入研究。
3 讨论 3.1 样品制备方法本实验针对人参、三七不同产品形式,分别采用不同的样品制备方法。作为提取物和生脉注射液(由人参、麦冬和五味子组成),其基质成分相对较为简单,因此无需复杂样品制备过程,即可进样分析。而人参药材及其成方固体制剂均需要进行提取和净化过程,如在《中国药典》2015年版一部[7]人参就需要采用三氯甲烷和正丁醇溶剂分步进行回流提取,从药材浸泡过夜到制备完成约需16 h,整个过程耗时,且溶剂消耗量大。
加速溶剂萃取法(accelerated solvent extraction,ASE)是采用高温高压条件下进行萃取的一种方法,在高压和高温条件下,通过降低提取溶剂黏度和表面张力,使其更易浸润和穿透胞壁,并使化合物在溶剂中的扩散速率和溶解度增加,从而加快并提高目标物的提取率。因此本实验针对不同样品基质均采用相同的ASE法提取。提取温度、压力、静态萃取时间和循环次数等是影响提取率的重要因素,袁斌等[25]已对人参药材的提取条件进行了系统的优化,本实验参考其条件,分2步溶剂萃取,样品与少量硅藻土拌匀后置于萃取池中,第1步采用三氯甲烷,以去除脂溶性基质成分;第2步采用水饱和正丁醇溶液选择性提取人参皂苷部位,其他萃取条件相同,整个过程在密闭系统中30 min内自动完成,方法重复性较佳。
3.2 在线二维多中心LC系统的构建及其色谱条件优化Giddings[32]指出了二维分析方法开发中的2个基本挑战:一是色谱分离的正交性;二是第一维的分离效能要得以保持。后者实际上是由低采样频率而引起,Murphy等[33]研究了采样频率对全二维系统分离性能的影响,得出低采样频率会降低二维系统的分离性能,并指出第一维的每个色谱峰至少要完成3次切割,才能获得较高的分离效能。因此实际分析常以牺牲一维分离的部分柱效的方式,来实现全二维分离。而多中心切割模式可打破一维采样周期和二维分离循环时间之间的限制[22],在充分优化第二维色谱条件的同时,也充分发挥了第一维色谱柱的分离效能。因此,本实验建立了基于6个loop环的在线多中心切割模式,用于多组分的定量分析,如图 1所示,通过2位6通切换阀可选择性将目标待测组分转移至定量环中进行临时储存,左泵即第二维泵再将目标馏分转移至第二维色谱柱中进行分离。
目标分析物人参皂苷按照其苷元结构类型可分为原人参二醇型、原人参三醇型、齐墩果烷型和其他类型等;人参二醇型人参皂苷的成苷位置主要在C-3位和C-20位,糖多为葡萄糖、阿拉伯糖和木糖,而原人参三醇型皂苷成苷的位置主要在C-6位和C-20位,糖多为葡萄糖、鼠李糖和木糖,大多化合物的疏水基团及亲水基团比较类似,因此增加一维和二维分离机制的多样性和正交性,可提升系统的分离能力。反相色谱仍是LC较为普遍的一种分离模式,具有分离柱效高、重现性好和化学键合相丰富等优点,Snyder等[34-35]对反相色谱柱进行了系统研究,创建了疏水减法模型(Fs),用于筛选等效色谱柱或评价正交性。
Fs={[12.5 (H2-H1)]2+[100 (S2*-S1*)]2+[30 (A2-A1)]2+[143 (B2-B1)]2+[83 (C2-C1)2]}1/2
H为疏水作用(hydrophobicity),S为空间相互作用(steric interaction),A为酸性氢键作用(hydrogen-bond acidity),B为碱性氢键作用(hydrogen-bond basicity),C为离子交换作用(cation-exchange activity)
Fs值越大表示色谱柱间的分离机制差异越大,因此本实验在色谱柱组合中尝试了Polar-embedded C18×Accucore C18(Fs=47.2),PFP×Accucore C18(Fs=66.36),Phenyl-X×Accucore C18(Fs=40.77)和Phenyl-Hexyl×Accucore C18(Fs=15.21)等,前2种虽均具有较高的正交性,但考虑到人参皂苷Rg1和Re的分离,本实验最终选择了Phenyl-X与RP的组合,以8种目标待测皂苷进行预实验,调整保留时间在2种色谱柱上的相关系数为0.987 8,具有一定的正交性,且Phenyl-X较Phenyl-Hexyl具有更强的空间选择性,适于同系化合物分离,如图A-1D所示,8个目标人参皂苷化合物分离良好,且Rg1与Re分离度达到2.0以上。由于各目标待测物在紫外下均为末端吸收,高背景吸收的流动相体系(如甲醇)会影响目标物的检测灵敏度,同时考虑到溶剂的兼容性,因此一维和二维分离均采用乙腈和0.1%磷酸水溶液作为流动相。一维和二维在反相体系下,采用梯度分析有助于改善系统的分离性能和峰容量[36-37],因此本实验的二维分离均采用梯度分析,针对每个cycle优化了梯度条件,调整各目标物的保留时间和分离度。第二维色谱柱选择实心核-壳柱(Accucore C18),在2.0 mL/min的高流速下进行快速梯度分析,获得了较好的分离效果,同时系统背压也不会过高。综上,本实验确定了最终的色谱分离条件,混合标准品和样品第二维分离谱图见图 2-A-2D和2-B-2D,各目标化合物分离良好;由复方中药SI及SLBG第二维的分离谱图(图 3)也可看出,各目标物分离基本无基质干扰,可进行准确定量,且对于质量分数较低的组分(如人参皂苷Rf),通过第二维的超高效分离,峰宽由一维的18 s压缩为第二维的5 s以内,改善了目标物的检测灵敏度。
本实验采用在线二维多中心切割液相色谱方法(MHC-2D LC),初步对人参、三七药材及其相关产品中8种人参皂苷的量进行了测定,结合相对比例及关键峰的比值,可对人参等同属及其不同入药部位做出快速识别和质量评价。但与常规LC方法比较,本法从方法开发到实际运用尚存在一定距离,本法在应用过程中受到的影响因素更多,如色谱柱的稳定性及切割时间窗口等。未来在8种成分的相对比例分析方面,尚需积累更多的不同产地、不同采收期的样本,构建更加稳定、可靠的雷达图[30-31],以区分不同种属及其入药部位。另外在以人参或三七为君药的复方中药应用方面,还需继续拓展,以验证本法的稳定性。本实验结果初步证实了二维液相色谱的分离能力,可为中药复方多组分定量分析方法开发提供参考。
| [1] | 白敏, 毛茜, 徐金娣. 人参属药用植物地上部位皂苷类成分的化学和分析研究进展[J]. 中国中药杂志, 2014, 39(3):412–422. |
| [2] | Chen X P, Lin Y P, Hu Y Z, et al. Phytochemistry, metabolism, and metabolomics of ginseng[J]. Chin Herb Med, 2015, 7(2): 98–108. DOI:10.1016/S1674-6384(15)60026-0 |
| [3] | 王筠默. 人参药理研究的进展[J]. 人参研究, 2001, 13(3):2–8. |
| [4] | 窦德强, 靳玲, 陈英杰. 人参的化学成分及药理活性的研究进展与展望[J]. 沈阳药科大学学报, 1999, 16(2):151–156. |
| [5] | 王巍, 苏光悦, 胡婉琦, 等. 近10年人参皂苷对心血管疾病的药理作用研究进展[J]. 中草药, 2016, 47(20):3736–3741. |
| [6] | 钟国赣, 孙成文, 李云义. 人参二醇组皂苷Rb1, Rb2, Rb3, Rc和Rd的钙通道阻滞作用和抗自由基作用[J]. 中国药理学报, 1996, 16(3):255. |
| [7] | 中国药典.一部[S]. 2015. |
| [8] | 赵琛, 苏光悦, 赵余庆. 人参皂苷及其衍生物抗结肠癌作用及机制的研究进展[J]. 中草药, 2015, 46(16):2477–2483. |
| [9] | 鱼红闪, 陈琪, 金凤燮. 不同种类人参及其各部位中皂苷组成和比例的研究[J]. 食品与发酵工业, 2002, 28(2):24–28. |
| [10] | 李闯, 王义, 张美萍, 等. 人参不同部位皂苷成分的HPLC测定[J]. 吉林中医药, 2010, 30(4):347. |
| [11] | 王启祥, 吕修梅, 张晋秀. 人参皂苷含量变化研究概况[J]. 西北药学杂志, 2002, 17(5):233–235. |
| [12] | 李翔国, 全炳武, 李虎林, 等. 人参皂苷量变异的研究进展[J]. 中草药, 2012, 43(11):2300–2304. |
| [13] | 窦德强, 靳玲, 陈英杰. 人参的化学成分及药理活性的研究进展与展望[J]. 沈阳药科大学学报, 1999, 16(2):151–156. |
| [14] | Sun B S, Gu L J, Fang Z M, et al. Simultaneous quantification of 19 ginsenosides in black ginseng developed from Panax ginseng by HPLC-ELSD[J]. J Pharmaceut Biomed, 2009, 50(1): 15–22. DOI:10.1016/j.jpba.2009.03.025 |
| [15] | Ouyang L F, Wang Z L, Dai J G, et al. Determination of total ginsenosides in ginseng extracts using charged aerosol detection with post-column compensation of the gradient[J]. Chin J Nat Med, 2014, 12(11): 857–868. |
| [16] | 涂禾, 李希, 冯建安, 等. HPLC-ELSD法测定疲王颗粒中人参皂苷Rg1、Re、Rb1[J]. 中草药, 2014, 45(17):2487–2489. |
| [17] | Li W K, Fitzloff J F. HPLC with evaporative light scattering detection as a tool to distinguish asian ginseng (Panax ginseng) and north american ginseng (Panax quinquefolius)[J]. J Liq Chromatogr R T, 2002, 25(1): 17–27. DOI:10.1081/JLC-100108536 |
| [18] | Li L, Luo G A, Liang Q L, et al. Rapid qualitative and quantitative analyses of Asian ginseng in adulterated American ginseng preparations by UPLC/Q-TOF-MS[J]. J Pharmaceut Biomed, 2010, 52(1): 66–72. DOI:10.1016/j.jpba.2009.12.017 |
| [19] | 汤响林, 易剑峰, 梁乾德, 等. 人参-附子配伍比例对人参皂苷成分溶出影响研究[J]. 中草药, 2013, 44(1):36–41. |
| [20] | Yao C L, Yang W Z, Wu W Y, et al. Simultaneous quantitation of five Panax notoginseng saponins by multi heart-cutting two-dimensional liquid chromatography:Method development and application to the quality control of eight Notoginseng containing Chinese patent medicines[J]. J Chromatogr A, 2015, 1402(7): 71–81. |
| [21] | Cao J L, Wei J C, Chen M W, et al. Application of two-dimensional chromatography in the analysis of Chinese herbal medicines[J]. J Chromatogr A, 2014, 1371(12): 1–14. |
| [22] | 黄竞怡, 佟玲, 丁黎. 二维液相色谱在中药分析的应用[J]. 药学进展, 2015, 39(5):357–363. |
| [23] | Groskreutz S R, Michael M S, Secor L B, et al. Selective comprehensive multi-dimensional separation for resolution enhancement in high performance liquid chromatography part Ⅰ:Principles and instrumentation[J]. J Chromatogr A, 2012, 1228(3): 31–40. |
| [24] | Larson E D, Groskreutz S R, Harmes D C, et al. Development of selective comprehensive two-dimensional liquid chromatography with parallel first-dimension sampling and second-dimension separation-application to the quantitative analysis of furanocoumarins in apiaceous vegetables[J]. Anal Bioanal Chem, 2013, 405(13): 4639–4653. DOI:10.1007/s00216-013-6758-8 |
| [25] | 袁斌, 车金水, 金燕, 等. 快速溶剂萃取-高效液相色谱法测定人参药材中人参皂苷的含量[J]. 药物分析杂志, 2013, 33(7):188–191. |
| [26] | 徐静, 贾力, 赵余庆. 人参的化学成分与人参产品的质量评价[J]. 药物评价研究, 2011, 34(3):199–203. |
| [27] | 张玉婷, 冯克然, 曹进, 等. UPLC法评价多种人参提取物中人参皂苷的含量[J]. 食品科学, 2013, 34(24):102–106. |
| [28] | Wan J B, Li S P, Chen J M, et al. Chemical characteristics of three medicinal plants of the Panax genus determined by HPLC-ELSD[J]. J Sep Sci, 2007, 30(6): 825–832. DOI:10.1002/(ISSN)1615-9314 |
| [29] | Shi W, Wang Y T, Li J, et al. Investigation of ginsenosides in different parts and ages of Panax ginseng[J]. Food Chem, 2007, 102: 664–668. DOI:10.1016/j.foodchem.2006.05.053 |
| [30] | 崔建新.基于多元图表示的中药指纹图谱可视化模式分析方法研究[D].秦皇岛:燕山大学, 2012. |
| [31] | 万军, 周霞, 黄永亮, 等. 天麻配方颗粒制备中气味相关性研究[J]. 中草药, 2013, 44(7):825–828. |
| [32] | Giddings J C. Two-dimensional separations:concept and promise[J]. Anal Chem, 1984, 56(12): 1258–1270. DOI:10.1021/ac00276a717 |
| [33] | Murphy R E, Schure M R, Foley J P. Effect of sampling rate on resolution in comprehensive two-dimensional liquid chromatography[J]. Anal Chem, 1998, 70(8): 1585–1594. DOI:10.1021/ac971184b |
| [34] | Snyder L R, Dolan J W, Carr P W. A new look at the selectivity of RPC column[J]. Anal Chem, 2007, 79(9): 3254–3262. DOI:10.1021/ac071905z |
| [35] | Snyder L R, Dolan J W, Carr P W. The hydrophobic-subtraction model of reversed-phase column selectivity[J]. J Chromatogr A, 2004, 1060(1/2): 77–116. |
| [36] | Ikegami T, Hara T, Kimura H, et al. Two-dimensional reversed-phase liquid chromatography using two monolithic silica C18 columns and different mobile phase modifiers in the two dimensions[J]. J Chromatogr A, 2006, 1106(1/2): 112–117. |
| [37] | Jandera P, Hájek T, Cesla P. Effects of the gradient profile, sample volume and solvent on the separation invery fast gradients, with special attention to the second-dimension gradient in comprehensive two-dimensional liquid chromatography[J]. J Chromatogr A, 2011, 1218(14): 1995–2006. |
 2017, Vol. 48
2017, Vol. 48


