2. 中国中医科学院中药研究所, 北京 100700;
3. 中国人民解放军第三〇二医院全军中药研究所, 北京 100039
2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China;
3. China Military Institute of Chinese Medicine, Integrative Medical Center, 302 Military Hospital of China, Beijing 100039, China
由于中药材多来源、多产地等复杂情况,使中药产品的质量差异悬殊,特别是有效成分的量差异明显。在《中国药典》2015年版一部收录的中药材中,来源于2种或3种,甚至4种或5种的多基原情况较普遍(约占《中国药典》药材品种的三分之一),给质量评价和标准制定带来许多难题。特别是当用这类药材制成复方制剂时,如果基于测定一种或几种有效成分的量来进行质量评价,通常难以真正反映该中药的质量与疗效的关系。
当前中药质量控制的思路是控制中药中一种或者几种有效成分或特征性成分的量,以此作为该中药材或中成药的质量标准,以确保这些成分在样品检验时的质量可控性和稳定性。通过分析已发表的研究和评述性文章,发现许多大量有关中药质量研究的现状和存在问题[1, 2, 3, 4, 5, 6, 7, 8],以及评价模式创新[9, 10, 11, 12, 13, 14]和技术创新[15, 16, 17, 18, 19]等方面的内容,值得借鉴和参考。
2016年3月4日在国务院发布的《关于促进医药产业健康发展的指导意见》中,提出“完善质量标准体系,健全以《中国药典》为核心的国家药品标准体系”的要求,为今后完善中药、民族药及药品生产技术规范和质量控制标准,提高标准的科学性、合理性及可操作性,强化标准的权威性和严肃性指明了方向。为提升我国中药及其产品质量,本文在研究现有质量评价方法和存在问题的基础上,提出中药质量标志物的新概念,以期与同行们共同讨论,引起共鸣。
1 影响中药质量的因素质量是一切产品的生命线,更是中药质量的生命线,但因其质量受多种因素的影响,所以保证中药的质量,把好中药质量关,加强药材市场的品种、栽培、加工、运输、储存的监督管理,确保用药安全极其重要。
1.1 品种因素中药的品种真伪、质量优劣均能影响临床疗效,有的甚至危害人民的生命安全。由于各地用药习惯、自然条件等不同,使中药一药多源、同名异物、同物异名的现象十分常见。如白附子,历代本草都以毛茛科(Ranunculaceae)植物黄花乌头Aconitum anthoroideum DC. 的块根入药,而有的地方则用天南星科植物独角莲Typhonium giganteum Engl. 的块根作白附子用,两者疗效明显不同。五加科的人参Panax ginseng C. A. Mey.,功能大补元气、强心固脱、生津安神,但市场上发现有用商陆科(Phytolaccaceae)的商陆Phytolacca acinosa Roxb. 根冒充。历代本草贯众的记载不尽相同。在市场随机抽样1 436份药材样品,DNA条形码鉴定揭示4.2%为混伪品;存在混伪品的物种主要集中在人参Ginseng Radix et Rhizoma、降香Dalbergiae Odoriferae Lignum、石菖蒲Acori Tatarinowii Rhizoma、旋覆花Inulae Flos、金银花Lonicerae Japonicae Flos、五加皮Acanthopanacis Cortex和柴胡Bupleuri Radix等。又如红景天药材及饮片样品仅40%为《中国药典》规定的大花红景天正品药材,大部分为混伪品。
1.2 栽培种植及产地生态条件因素为了满足临床需要,我国许多常用中药为栽培品。目前我国许多栽培的中药材主要靠药农分散种植,种植技术粗放,缺乏规范的管理和技术指导,造成种质不佳、品种特性退化等问题,如牛膝的种质退化引起牛膝的根越种越小,黄芪的木化变异,防风根的分枝变异等。再加上栽培中滥施农药、化肥、刺激生长物质等,造成中药中农药残留和重金属含量超标,其质量受到影响,难以符合药用标准。产地因气候、土壤、水质等生态条件不同,成为影响中药质量的主要因素。“性从地变”,历代医家非常重视中药的道地性。甘草中的甘草酸量因产地不同有5~6倍的差异。所以,不同中药选择其适合的生态环境才能保证质优效佳。
1.3 采收加工因素中药的采收通常以药材质量的最优化和产量最大化为原则,但有时这两个指标是不一致的,因此,必须选择合适的采收时期和加工方法才能更好地保证临床疗效。如柴胡总皂苷的量一年生者高于两年生者,虽然后者根的长度直径和分支数目高于前者,但由于柴胡皂苷主要存在于皮层的厚角组织中,随着根的增粗,皮层所占比例下降。茵陈多为春季采收高6~10 cm的幼苗,有“三月茵陈四月蒿,五月拔来当柴烧”的说法,说明采收期的重要性。研究发现,茵陈4个主要利胆有效成分蒿属香豆精、对羟基苯乙酮和茵陈香豆酸A、B,以秋季花前期至花果期的量高。薄荷在花开末期收割也是因为这时挥发油中薄荷脑的量比其他时间都高。当归、川芎的挥发性成分和有效成分易氧化,其切片的薄厚在干燥时会对其挥发性成分的散失造成影响。
1.4 炮制加工因素中药根据制剂生产工艺和临床应用的需要,通常需要对药材进行加工炮制处理。炮制的目的包括减毒、增效、缓和药性、有利成分的煎出。如乌头炮制后,将二萜双酯类生物碱转化为低毒的二萜单酯类生物碱,达到减毒的目的。大黄的炮制从生大黄、醋炒、酒炒、炒制、熟大黄到大黄炭,化学成分从二蒽酮、结合蒽醌、游离蒽醌到蒽醌类消失,药性从峻泻、缓泻到止泻,起到改变药性的效果。含生物碱的药材如延胡索醋制后延胡索乙素、去氢紫堇碱等成盐,提高了其水溶性。许多药材酒制后,有利于物质迁移和有效成分的溶出。淫羊藿洋油炙后,溶解了叶片表皮的蜡质,增加淫羊藿苷的溶出。还有的炮制起到稳定药性的作用,如槐花炮制避免鼠李糖转化酶对芸香苷的转化。中药加工炮制是否得当直接影药效和有效物质的量。如当归、川芎、前胡、大黄诸类需水润切片的中药材,浸润过程可以使有效成分随水流失而使药效下降。如种皮厚、质地坚硬的药材,生品不得入药需炒制后应用。炒制时的火候不同其药性也有不同。还有商家以假充真、以次充好的现象时有发生。这些都会影响中药的质量和疗效。
1.5 运输贮藏条件因素中药在储存保管运输的过程中易受空气、温度、湿度、光照等影响,发生复杂的物理和化学变化。如丹皮主要有效成分丹皮酚贮藏一年后含量仅为原来的一半,贮藏4年后再下降一半;又如新鲜细辛的镇咳作用强,储藏半年后则无镇咳作用。
1.6 提取纯化过程对质量的影响中药的提取纯化过程是中药质量传递的关键环节,包括提取、分离、浓缩、干燥等工艺环节。中药的提取过程是对中药化学物质群的重新获取和纯化,其中包含对目标成分的取、舍和成分的变化,在中药的提取纯化方案的设计时,应有如下认识:(1)中药的药性、传统疗效是中药所有活性成分的综合效应的体现,即所谓中药的“系统质”;(2)提取纯化工艺设计时要有对有效成分、无效成分、毒性成分、未知成分的基本判断;(3)提取和纯化工艺的设计是基于药材所含成分理化性质及其之间的差异,包括分子大小、熔点、沸点、极性、溶解性、挥发性、酸碱性、色谱行为等;(4)单煎与合煎的效果不同,成分之间存在助溶、拮抗、分解、沉淀、络合、化合等物理化学变化;(5)中药及其方剂的传统用法是提取纯化工艺选择的重要依据;(6)提取纯化工艺是中药(中成药)质量再形成的关键因素。
工艺规程对药物制剂疗效有以下3方面的作用:(1)取舍有效成分的种类、数量及存在形式;(2)控制有效成分的释放速度;(3)直接控制药物的吸收速度。构成制剂工艺的粉碎、提取、分离、浓缩、干燥及制备方法、工艺条件等,必须通过不断实验来确定。其中低温提取、超临界提取、微囊、微球、脂质体技术、离心分离技术、超滤技术等先进技术应用于中药制剂是提高中药制剂水平的关键。因此,中药剂型和工艺规程的改革应尽可能吸取现代科学技术。
1.7 药物传输途径对质量的影响从药物的安全性和有效性的角度认识和评价中药质量,就不能孤立的评价药物自身的原型成分,还要进一步分析药物成分的传输途径、体内过程,了解药物最终的“效应成分”。中药化学成分复杂,药物成分存在以下5种情况:(1)药物成分以原型直接入血或直接作用于靶点;(2)药物成分仅是前体药物,经口服给药后,经过胃肠道微生物代谢及肝脏代谢产生代谢产物,代谢产物发挥作用,如多数苷类药物;(3)药物成分不是直接的活性成分,而是通过激活人体内源性物质的分泌来调节人体疾病的“内稳”失衡状态而发挥“中介治疗”作用;(4)药物成分不对人体病理过程发挥作用,而是干预体内微生态,并通过改善肠内菌群来增加其他原型药物代谢成有效成分而发挥治疗作用;(5)中药体内过程中,原型成分与代谢产物,代谢产物与代谢产物,原型成分、代谢产物与受体分子之间存在复杂的多种模式的相互作用。
1.8 复方及各成分之间交互作用对质量的影响中药的有效性多以复方的形式在临证配伍中体现。中药的有效性也可拆分为药性和药效两个相互关联的要素,药性和药效是药材整体化学物质群综合生物效应的体现,是整个药材的化学物质群总体属性的综合体现,即系统论中的“整体取性”“系统质”,而绝非某单一化学成分的单独作用。单一成分不能代替原药材的药性和药效,并且“整体不是各部分简单相加之和”。事实上,药物化学成分对人体病理过程的干预存在“功效网络”,各成分之间存在多种模式的交互作用。因此,中药质量也是中药化学物质群的综合生物效应的综合体现。中药有效性最终是针对疾病(证)的病理过程的干预效果,因此,更具有针对性和目的性。中药在临床是按照辨证论治的原则以复方的形式应用,主体(中药复方及客体(患者生理病理)均是两个复杂体系,中药组方更具有“系统质效应”,中药组方的系统质具有“非加和性”,复方中药的质量评价时,应有与组方配伍理论相关的整体思路。
2 中药产品的质量和质量标准与监管存在的问题 2.1 中药市场产品质量堪忧根据食品药品监督管理部门2016年1~3月公布的因质量问题不合格的药品80%以上是中药。公布的5次通报的结果,总计714批药品,其中中药不合格的占648批(表 1),特别中药材问题较大,说明质量存在问题,需要进一步的整顿治理。更有甚者,部分中成药中添加多种化学合成药物。
| 表 1 2016年1—3月公布的不合格中药批次统计 Table 1 Release batches of substandard Chinese materia medica from January to March in 2016 |
由于历史原因,相当多“地方标准”转为“国家标准”的品种被《中国药典》收载,“地方标准”品种的质量标准较低,产品成熟水平参差不齐。甚至由于品种保密原因,或申报新药时工艺保密或质量保密,一些中成药的各味药的剂量不公开,有明确药材或药用植物来源的药用植物提取物不公开其来源,由于是前几版药典延续下来的问题,一直延续到2015年版。不科学、不规范、甚至是错的制备工艺、质量标准也不能改,给质量监管和优劣检验带来困难。
2.3 《中国药典》标准制定的科学性从经典方或现代临床名方衍生而来的中成药处方,有的药味加减,有的配伍改变。因此除考虑药材饮片因素外,这类药味加减或配伍变化会影响药品的安全性和有效性,也会影响成药的质量标准的制定。这就是选择何种与疗效有关的物质成分进行定性、定量测定并建立质量标准的问题。通过阅读分析《中国药典》2010年版和2015年版一部发现有3个问题难以用于上市产品的质量管控:(1)原料与成药质量关联性,中成药制剂所含有效成分的量与所用药材(饮片)或提取物的量不配备。(2)根据中药复方配伍原则,同一药材在不同制剂中的地位不同,有的制剂选用的定量指标违背配伍原则,只选用好测定的化学成分进行定量控制。如在多个制剂中,不论芍药在方中的地位,用赤芍还是白芍,均选用芍药苷的量作为质量控制指标;甚至在多味药组成的复方中采用“使”药的甘草成分的量作为质量控制指标。有的根本不将“君”药成分作为质控指标。(3)同名品种的质量可比性与可替代性。在《中国药典》中发现相同处方的复方制剂制成不同剂型的产品,在剂量相同、给药途径相同时,同名药物的不同剂型之间是具有可替代性。可是由于收载的中成药同名不同剂型的品种,由于所定标准不一致,质量控制指标不一致,很难说明不同剂型之间的可替代性。《中国药典》2015年版中有3种以上剂型的同名中成药63个,形成了222个品种。相当多不同剂型的同名品种存在定性鉴别和定量测定成分数目和定量测定指标存在较大差别。
2.4 质量标准与质量监控过程质量是疗效的保证,是工艺的体现,质量标准是药品质量优劣的指标,中药生产现代化和质量标准科学化是中药发展的关键,由于中药的有效成分复杂、疗效多,根据传统经验的积累,作用于人体多强调整体性、互补性、协调性,而且目前中药制剂的质量标准水平相对较低,因此,如何采用现代分析技术手段与传统鉴定经验相结合制定出能指导生产操作和反映产品内在质量的均一性、有效性、稳定性、重现性的多元化可控指标是提高中药制剂质量,促进中药现代化的重点,也是难点。
在规范化执行中,人员素质技术水平也是重要因素。中药制剂产品质量取决于中药技术人员及管理人员的共同努力,在中药学研究、技术工程、生产以及贮存、销售的各个环节都需要他们提供服务,其中决策者的作用尤为重要,管理者应树立以人为本的思想,重视对各类人员基本素质的提高和培养。
2.5 医生个体化处方处方是中药制剂研究的基础和依据,是影响中药制剂疗效的主要因素,无论是古方、验方还是医院协定处方,在制备制剂前都必须进行处方中药味、各药味间用量比例及日服剂量的筛选,以使处方尽量精炼、严谨,符合中医辨证施治、理法方药的原则。
医生处方是中医根据中医治则治法开出个体化治疗处方,其疗效与处方药味增减的配伍应用关系密切。由于中医派系众多,对证认识不同以及治则、治法差异,遣药组方不同,对于同一病人同一病症,可以10个医生开出10张处方(组方不同、剂量不同)。常会出现(1)有的医院将方药开发成医院制剂成为“内部产品”用于临床治疗。由于各个医院条件的差别,所购进饮片的质量差异,对这些医院制剂如何保证质量和进行质量管控存在盲区;(2)有的医院开设中药煎制业务,由于人员和条件差异,如何保证煎制质量,达到处方个体治疗的目的也值得从质量角度予以重视。如煎煮时间、温度、水量、次数的控制是否严格执行。否则,煎制成的汤药看“无颜色”,闻“无气味”,喝“无药味”。
3 中药质量的物质基础的确定及质量标志物(Q-markers)的提出依据 3.1 中药化学成分的结构类型的复杂性中药含有多类化学成分,它们与中药的有效性和安全性有关,当具备了一定条件,中药成分就能成为反映中药质量的标志物(quality marker,Q-markers)。中药(药用植物)的生物学因素或非生物学因素所形成的次生代谢物是其有效成分的物质基础和发现药物作用的物质基础以及发现新药的重要来源。许多次生代谢物是由初生代谢物衍生而来,其结构具有复杂的多样性。常见的次生代谢物包括生物碱类、黄酮类、萜类、蒽醌类、香豆素类、木脂素类化合物。而且不同类型化合物具有类群(如科、属、种、亚种、变种等)的特异性,也具有显著的生物活性和医疗用途。
3.2 中药化学成分生物合成途径(生源途径)是化学生物学基础和亲缘学的依据如前所述,常见的次生代谢物生物碱类、黄酮类、萜类、蒽醌类、香豆素类、木脂素类化合物,具有不同的化学结构。而且不同类型化合物具有类群(如科、属、种、亚种、变种等)的差异,形成不同骨架的亚结构,从而奠定了受多种因素(生物遗传因素、生长发育分化因素、环境因素等)影响而形成存在于不同植物体内次生代谢产物的多样性。
这些化合物在植物体内通过乙酸-丙二酸途径、异戊二烯途径、莽草酸途径、氨基酸途径等复杂的生成过程和生物合成机制,形成具有千变万化的分子结构的化合物,并赋予其具有不同的生物活性和治疗用途[20]。
根据不同结构特点,可将主要的天然黄酮类化合物分为黄酮(flavone)、黄酮醇(flavonol)、黄烷酮(又称二氢黄酮,flavonone)、二氢黄酮醇(flavanonol)、异黄酮(isoflavones)、异黄烷酮(又称二氢异黄酮,isoflavanone)、查耳酮(chalcone)、二氢查耳酮(dihydrochalcone)、橙酮(又称澳咔,aurone)、双苯吡酮类(xanthones)、黄烷和黄烷醇、黄烷-3,4-二醇(flavan-3,4-diols)、花色素(anthocyanidins)、双黄酮(biflavonoid)等。另外,还有一些黄酮类化合物的结构很复杂,形成榕碱及异榕碱等生物碱型黄酮。存在于中药中的主要黄酮类化合物有11种基本骨架结构[21]。根据其结构的基本特点,发现有不同类型的骨架结构,而在骨架结构不同位置被羟基或糖取代形成不同的黄酮类化合物而分布在不同中药或药用植物中。槲皮素(quercetin)是最典型的黄酮类化合物。柑橘属的多种水果均含有大量的黄酮类化合物,如橘红素(tangeretin)和川陈皮素(nobiletin)。大豆中含有一种异黄酮类化合物大豆异黄酮,茶叶中的茶多酚是由没食子酸和黄酮类化合物儿茶酚组成[20]。
中药中的植物次生代谢物种类繁多、功能复杂,一些特定结构的化合物量差异极大而且量极低。植物次生代谢物是植物生物合成的产物,通常在中药生长的一定时间、在特定组织或器官或细胞中形成。植物次生代谢物质从其生物合成途径可以将次生物质的质和量与药用植物的种、亚种或变种密切关联起来。针对植物次生代谢物合成积累规律的综合研究认为:中药的道地性(地域、地理因素)、个体、品系、年龄、采样部位、采样时期、样品贮存时间等差异因素对植物次生代谢物合成积累产生影响。从分子水平认识对中药化学物质形成的影响,可以反映在基因水平、转录水平、转录后的不同步骤、不同合成方式等复杂过程的植物内在因素的影响。
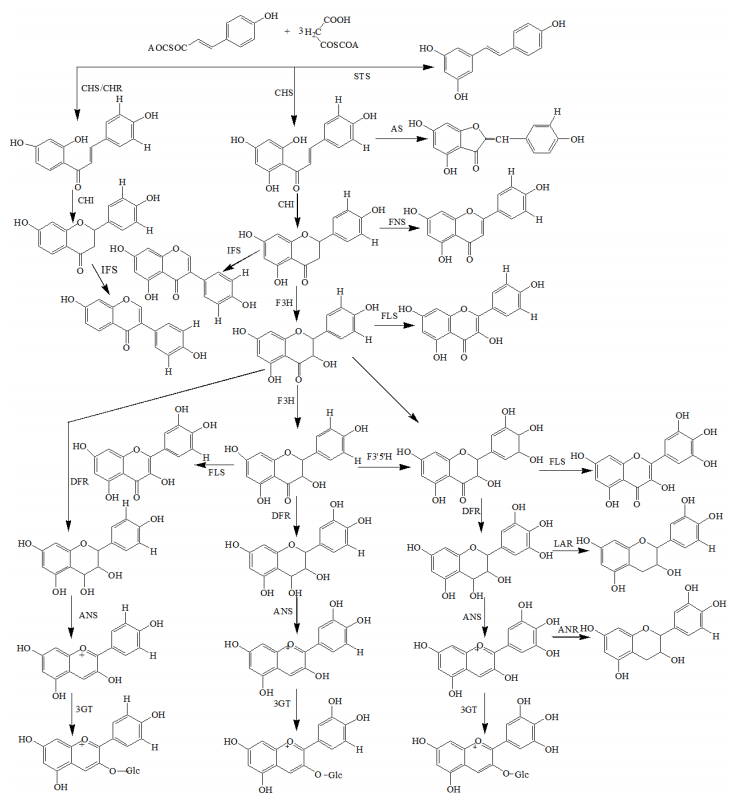
黄酮类化合物均由基本的多酚类化合物的生物合成途径而形成的,即从苯丙氨酸-酪氨酸为起始物质在不同酶作用下生成一系列黄酮类化合物(图 1)[22]。
 | 图 1 以苯丙氨酸-酪氨酸为起始物质的多酚类化合物的生物合成途径 Fig. 1 Biosynthetic pathways of polyphenols from phenylalanine-tyrosine as a starting materials |
由图 1可见,查耳酮合成酶(chalcone synthase,CHS)催化该途径的第1步。查耳酮异构酶(chalcone isomerase,CHI)催化分子内的环化反应。异黄酮合成酶(isoflavone synthase,IFS)催化CHI催化合成的 (2S)-黄烷酮(5,7,4′-三羟基查耳酮)或 (2S)-5-脱氧黄烷酮(7,4′-二羟基查耳酮)的B环从C-2位转移到C-3位,进而通过异黄酮脱水酶使杂环C-2,3位形成双键。黄烷酮-3β-羟化酶(flavanone-3β-hydroxyalse,F3H)将CHI催化合成的 (2S)-黄烷酮或(2S)-5-脱氧黄烷酮的C-3位羟基化,生成二氢黄酮醇。黄酮醇合成酶(flavonol synthase,FLS)催化黄酮结构中的C-3位羟基化,从而形成各种黄酮醇类物质。二氢黄酮醇还原酶(dihydroflavonol-4-reductase,DFR)是花青素(anthocyanidins)和鞣质(phlobaphenes)合成途径中的关键酶,是一个重要的分支点[23]。
黄酮类化合物广泛存在于药用植物中,如银杏、红花、黄芩、陈皮等[24]。黄酮类化合物的结构多样性使之具有广泛的药理活性和治疗价值,如调血脂、扩张冠脉、止血、镇咳、祛痰、降低血管脆性、抗菌、保肝、解毒、治疗急慢性肝炎和肝硬化等作用。通过生物合成途径的研究,推动药用植物次生代谢工程的发展,可为提高中药材的品质、良种选育、规范化种植、质量控制提供技术支撑作用。
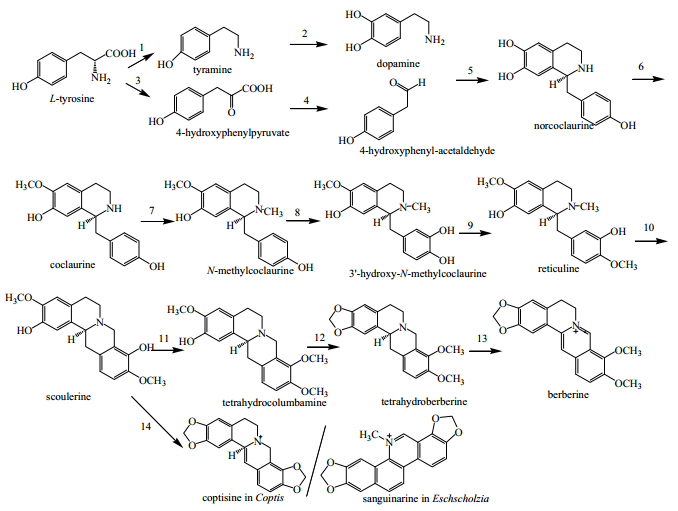
以小檗碱(berberine)的生物合成为例,从存在植物中的酪氨酸(L-tyrosine)开始,经酪胺(tyramine)生成多巴胺(dopamine)。然后再经过2个阶段生成小檗碱(图 2)[25]。在小檗碱合成的第一阶段发生在细胞质中,在去甲乌药碱合成酶的作用下,使多巴胺和4-羟苯乙醛缩合形成苄基异喹啉生物碱去甲乌药碱(norcoclaurine)。去甲乌药碱接受来自腺苷甲硫氨酸的甲基,经几次甲基化作用转化为番荔枝碱(reticuline)。在第2阶段,番荔枝碱经特殊的载体转运进入内质网的囊泡内,在成环作用下形成小檗碱桥,进一步形成原小檗碱的基本骨架——金黄紫堇碱(scoulerine)。金黄紫堇碱从腺苷甲硫氨酸处获取甲基形成四氢防己碱(tetrahydrocolumbamine),在氢化小檗碱合成酶的催化下,形成亚甲基双氧环结构,转化为氢化小檗碱(canadine)。小檗碱合成的最后步骤由四氢小檗碱氧化酶催化,利用氢化小檗碱为底物氧化脱氢,最终形成小檗碱。
 | 图 2 以酪氨酸起始的生物碱生物合成和调控途径 Fig. 2 Biosynthesis and regulation pathway of alkaloids starting with tyrosine |
以酪氨酸起始的生物碱的生物合成过程中,形成的几个中间产物去甲乌药碱存在于日本乌头Aconitum japonicum Thunb.、莲子Nelumbo unciferaGaertn、小叶买麻藤Gnetum parvifolium (Warb.) C. Y. Cheng ex Chun中;番荔枝碱存在于番荔枝科植物香荔枝Annona reticulata L.、番荔枝Annona squamosaL.、莲子、荷叶Folium Nelumbinis、厚朴Magnolia officinalis Rehd. et Wils中;金黄紫堇碱存在于罂粟科植物地丁紫Gueldenstaedtia multiflora Bunge等多种植物中;四氢防己碱存在于掌叶防己和黄连根中;氢化小檗碱存在于黄连Coptis chinensis Franch.、黄柏Phellodendron amurense Rupr.、三颗针Berberis pruinosa Franch. 等中药中。小檗碱和黄连碱(coptisine)是来源于黄连的生物碱,血根碱(sanguinarine)是主要存在于白屈菜Chelidonium majus L.、紫堇Corydalis mucronifera Maxim.、博落回Macleaya cordata (Willd.) R. Br.、血水草Eomecon chionantha Hance中的生物碱。虽然在黄柏和黄连中均含有小檗碱、药根碱(jatrorrhizine)、巴马汀(palmatine),而黄连碱是黄连特有的生物,黄柏碱(phellodendrine)是黄柏的特有生物碱。因此从这些差异可以区分其生物碱的来源。
4 中药Q-marker的基本概念及其在质量评价中的意义 4.1 中药Q-marker提出的背景中药质量研究和质量标准的建立是一项复杂的系统工程,如何研究和制定标准存在不同方法和不同意见。目前被业界认同的系统的质量标准都在研究或争议之中。在《中国药典》中以一种或几种指标成分的量高低去评价中药的优劣的颇多,但是中药的临床疗效并不一定就是某一种或几种成分的作用。目前建立中药的评价标准是建立中药真假、优劣的质量标准的基本出发点。这就与基原的鉴别和确定直接有关。建立定性、定量检测方法获得具有多个特征成分分析方法、指纹图谱,使之具有特异性和可控性,是质量标准的基础。本文考虑中药传统理论、遣药组方、成药制备、剂型和用法等复杂性,提出中药Q-marker的概念为规范中药质量研究和标准建立奠定基础。以克服现现有质量标准多种不足,提高质量一致性、可控性和朔源性,有利于中药产品生产过程控制和质量监管。
4.2 中药Q-marker的定义中药Q-marker是存在于中药材和中药产品(如中药饮片、中药煎剂、中药提取物、中成药制剂)中固有的或加工制备过程中形成的、与中药的功能属性密切相关的化学物质,作为反映中药安全性和有效性的标示性物质进行质量控制。而不是它们经过生物体内过程被吸收的化学物质和所产生的化学物质(如人体内代谢物、消化道酶或微生物转化的化学物质),需要经过结构分析确定其化学结构,并可进行定性定量的特有的化学成分。
Q-marker的基本条件:(1)中药材和中药产品中固有存在的或加工制备过程中形成的化学物质;(2)与中药的功能属性密切相关,有明确的化学结构;(3)可以进行定性鉴别和定量测定的物质;(4)按中医配伍组成的方剂君药首选原则,兼顾臣、佐使药的代表性物质。
4.3 影响中药Q-marker的因素 4.3.1 生物合成的细胞和组织特异性在植物的细胞和组织中存在大量的次生代谢物合成的相关代谢酶和底物,这类酶和底物在不同细胞和器官完成次生代谢物的合成[26]。如千里光茎皮中的吡咯烷类生物碱的量较高,是与外表皮细胞的高分布有关;又如莨菪中的莨菪生物碱是经天仙子胺的环氧化在根部的中柱稍完成后转运到地上部分而存在的[20]。这些作为Q-marker的特异化学物质与植物所用部分有关。
4.3.2 生物合成的器官特异性植物器官是由细胞组织构成的,在特定器官中的细胞组织内合成并积累特异的次生代谢物,也因其酶的差异表现出合成的物质类别和量的差异。如青蒿素在青蒿的腺毛中生成和积累[20];又如长春花的长春碱和长春新碱特异性地分布在叶和茎中[27]。
4.3.3 生物合成的发育特异性在植物发育过程中,通过次生代谢物合成的积累而引起细胞分化和植物器官的形成,并随之在其器官积累次生代谢物[20]。在此过程中,植物器官中的合成酶调控基因、蛋白水平和限制次生代谢物生成[28]。
4.3.4 中药材生长过程的外在因素从遗传学角度看,道地药材的遗传本质在居群水平通常是量变的过程,它与种内其他非道地药材区别主要表现为居群内基因型频率的改变。在个体水平上表现多基因控制遗传因素与环境的交互作用很重要,它影响次生代谢产物的生成[29]。植物的生理调节、自身保护、生存竞争、协调与环境关系等生命活动的许多方面均对次生代谢产物的合成起着重要作用。而且各种生态环境等外在因素,如光照、温度、土壤、水分、空气以及生物和微生物的因素均影响药用植物的次生代谢过程[20]。
侯娅等[30]分析了生态环境因子对药用植物次生代谢物合成积累的影响,并阐述了植物生态学、功能基因组学、蛋白质组学、代谢组学及系统生物学方法在药用植物次生代谢物研究中的应用。指出因多生态因子综合作用的系统研究,系统整合多种组学技术,深入研究药用植物次生代谢物的生物合成途径、代谢规律及关键调控机制、代谢产生药用植物活性成分,有利于优质药材生产基地建设。谭友莉等[31]认为气候是决定植物赖以生存的水、热立地条件的主要生态因子。随着全球气候变暖对药用植物的生长、代谢、繁衍的影响表现在药用植物次生代谢产物的变化,认为CO2等温室气体增加引起气候变暖,高温对药用植物生长及有效成分积累均有影响。焦晓林等[32]通过研究环境对植物体内三萜皂苷的生物合成的影响,以及三萜皂苷类化合物的生物合成途径及其关键酶,证实三萜皂苷类化合物是一类具有多种生物及药理活性的植物次生代谢产物,除去遗传因素外,环境中光照、温度、水分、盐、土壤状况等因子影响药用植物三萜皂苷合成。
4.3.5 中药标准汤剂或中成药制剂因素随着中药产业和中医临床用药的发展,多种形式如饮片、精制饮片、颗粒饮片、破壁饮片和配方颗粒等均已出现。中药饮片标准汤剂是以中医理论为指导、临床应用为基础,参考现代提取方法,饮片经水煎煮后,经适当浓缩而得的液体制剂,能够适应当前临床用药特点,标化临床不同用药形式,满足临床用药需求。由于中药饮片标准汤剂是临床直接的服用形式。标准汤剂应体现提取工艺的影响、没有辅料的干扰、能够调配成所需剂量。中药饮片标准汤剂遵循传统汤剂的煎煮原则,其制备流程具有标准化、规范化、个体化特点,能够保证工艺的统一和质量的稳定。
对于中成药产业来说,由于其工艺过程增加了不少现代产业元素和技术,很多产品不是以汤剂为基础制备中成药产品,如采用全方药材粉粹成药粉制成某一固体剂型或多种剂型(如片剂或胶囊),或采用部分药材提前浓缩与部分药材的药粉混合制成某一固体剂型或多种剂型,或采用水提醇沉浓缩制成某一固体剂型或多种剂型,或采用提取部位入药制成某一固体剂型或多种剂型。还有炮制方法的规范性因素等的影响。因此,由于制药原料来源不同、工艺不同、剂型不同,使制剂中的活性物质数目和量波动较大,而增大了质量标准建立的复杂性和控制质量的复杂性,更为临床使用同名中成药不同剂型的可替代性判断带来困难。因此,必须针对不同制剂的实际状况开展质量可控性研究,才能准确建立样品的指纹图谱、判别Q-marker及确定其定量的上下限。
4.4 中药Q-marker的确定和研究方法中药Q-marker是中药质量的标示性物质,必须与中药的有效性密切相关,而中药饮片标准汤剂是中药临床应用的基础标准形式,是中药有效性溯源的核心环节。根据中药Q-marker的定义,提出以中药饮片标准汤剂为核心样本进行质量研究,确定中药Q-marker,并向药材和饮片(及炮制品)溯源,并向复方制剂和中成药延伸。本文提出如下中药饮片标准汤剂中药Q-marker研究过程。
4.4.1 样品应具有充分的代表性参照《中国药典》药材及饮片研究的相关要求,样品的鉴定应确定到种,推荐采用传统鉴别和DNA条形码鉴别相结合。
4.4.2 饮片炮制依据《中国药典》2015年版相关规定进行炮制,或依据道地产区或主产区地方炮制方法。
4.4.3 煎制前饮片质量检测应依据《中国药典》中相关规定,对其含量、外观、检测、水分等进行饮片的检测。
4.4.4 样品用量推荐饮片用量为100 g用于标准汤剂制备,样品应不少于10批次,以避免因样品过少引起系统误差。
4.4.5 溶剂及溶剂用量依据临床煎煮常用纯化水。选用传统方剂的方式煎煮。但是加水量随意性和差异较大,需要进一步细化。煎煮加水量及煎取药液量可采用加水量为饮片量的6~8倍计算。
4.4.6 浸泡和煎煮时间与次数煎煮前浸泡药材有利于成分溶出,建议浸泡时间推荐采用30 min。各饮片均推荐煎煮2次,对于一般药物,头煎时间为30 min,二煎时间为20 min。也可以根据特定要求延长或缩短煎煮时间。
4.4.7 浓缩方法推荐使用减压浓缩,浓缩温度推荐不超过50 ℃,考虑到质量控制的需要,建议体积浓缩至药材质量的5倍。浓缩液冷冻避光保存。
4.4.8 中药饮片标准汤剂的指纹图谱建立建议采用液(气)相或液(气)质联用方法建立中药饮片标准汤剂的指纹图谱,分辨出指纹图谱中存在的化学物质的数目和化学结构,选择该汤剂特有的与活性(疗效和安全性)有关物质为Q-marker,并以标准对照药材或对照品比对,进行质量控制。
4.4.9 标准物质的定量方法一般建议采用HPLC、GC、LC-MS、GC-MS用于Q-marker的定量,王智民课题组[33, 34, 35]建立并发表了有关“一测多评法”(QAMS)的文章,完成过药材和制剂的有效成分测定,这些已被《中国药典》认可的定量分析方法,可以作为Q-marker定量的方法。
为了鉴别不同厂家和不同剂型的差异,需要先制备其标准提取物,获得标准指纹图谱;鉴别确定可能存在的化学物质的结构,明确是否与生物活性相关,遴选Q-marker;根据需要确定存在的化学物质中进行定量测定的Q-marker;比较本企业同剂型产品批间的Q-marker的量差异,确定上下限;比较不同企业间不同剂型产品的Q-marker的量差异,根据分析结果得出是否等效的结论。其研究过程的关键步骤见图 3。
 | 图 3 中药Q-marker研究关键步骤 Fig. 3 Key steps of research on Q-marker in Chinese materia medica |
(1)由于中药Q-marker是存在于中药材、饮片、提取物、单方制剂或复方制剂中的,与功效有关质量的标志性物质,经研究分析后确定这类物质具有生物学特异性。因此其Q-marker是体现中药材、饮片、单方制剂或复方制剂质量的化学物质。
(2)在Q-marker研究中,必须使用标准方法制备样品(符合中医临床应用标准汤剂或标准工艺制备单方或复方中药制剂的标准提取物或全药材入药的标准提取物来确证用于定性和定量的Q-marker。
(3)为保证Q-marker具有溯源性,应在药材或饮片或提取物的Q-marker基础上确定制剂的质量标志物。
(4)为体现中药制剂在中医理论指导下的组方配伍的原理,所确定的制剂Q-marker应注意遵循具有组方配伍特点的,以君药为主,臣、佐、使兼顾的原则。
通过以上规范研究形成以Q-marker为基础的中药质量管理体系(图 4)。
 | 图 4 以Q-marker为基础的中药质量管理体系 Fig. 4 Quality management system on basis of Q-marker in Chinese materia medica |
复方丹参制剂是由丹参、三七和冰片3味药组成的复方制剂,《中国药典》收载了该品种的7种剂型,是国内销量大、生产厂家多的大品种。
经鉴定丹参药材中主要存在丹酚酸和丹参酮2类活性成分[36, 37, 38, 39]。丹酚酸类包括丹酚酸A、B、D(salvianolic acid A、B、D),丹参素(danshensu,DSU),咖啡酸(caffeic acid),肉桂酸(cinnamic acid),阿魏酸(ferulic acid),原儿茶醛(protocatechuicaldehyde),迷迭香酸(rosemarinic acid,RA),紫草酸B(lithospermic acid B,LB)。丹参酮类包括丹参酮(tanshinone)、二氢丹参酮Ⅰ(dihydrotanshinone Ⅰ,DT-Ⅰ)、丹参酮Ⅰ(tanshinone Ⅰ,T-Ⅰ)、丹参酮ⅡA(tanshinone ⅡA,T-ⅡA)、丹参酮ⅡB(tanshinone ⅡB,T-ⅡB)和隐丹参酮(cryptotanshinone,CT)。丹参的化学指纹图谱见图 5,用HPLC和LC-MS方法检测均能获得同样的丹参化学指纹特征[39]。
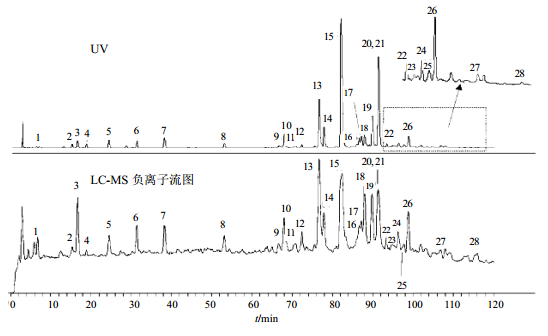 | 图 5 丹参的化学指纹图谱 Fig. 5 Fingerprints of Salvia miltiorrhiza |
三七中含有大量化学物质,主要有皂苷类、黄酮类、挥发油、氨基酸、多糖、淀粉、蛋白质以及部分无机元素如氮、磷、钾、钴、钼、铯等。迄今为止,已从三七的不同部位分离得到54种单体皂苷类成分,如人参皂苷Ra3、Rb1、Rd、Re、Rg1及三七皂苷R1、G。这些单体皂苷成分大多数为达玛烷型的20(S)-原人参二醇型和20(S)-原人参三醇型。三七的地下部分既有20 (S)-原人参二醇型皂苷,也含20 (S)-原人参三醇型皂苷。三七的地上部分以20(S)-原人参二醇型皂苷为主。黄酮类化合物有三七黄酮A和三七黄酮B。
在复方丹参片中,对于丹参一般确定丹参水溶性成分丹酚酸B、丹参素、原儿茶醛和原儿茶酸和脂溶性成分丹参酮ⅡA、隐丹参酮和丹参酮Ⅰ。根据文献已报道的指纹图谱,对于三七主要成分为三七皂苷R1和人参皂苷Rg1、Rb1。因此,认定复方丹参片用于定性鉴别的Q-marker为丹参素、丹酚酸B、丹参酮ⅡA、隐丹参酮、丹参酮Ⅰ、三七皂苷R1、三七皂苷G、人参皂苷Rg1和人参皂苷Rb1 9个化学成分。建议采用HPLC或LC-MS方法测定丹参素、丹酚酸B和丹参酮ⅡA和三七皂苷R1的量,从而对复方丹参片的有效成分进行质量控制。
5.2 炮制中药的Q-marker以有毒中药马钱子为例分析标志物的确定过程。马钱子一般经炮制后入药使用。未炮制的马钱子中含多达14种以上的生物碱,可分为3种类型:(1)“正”系列(normal series)生物碱:士的宁(番木鳖碱,strychnine)、马钱子碱(brucine)、异番木鳖碱(isostrychnine)、异马钱子碱(isobrucine)、番木鳖碱N-氧化物(strychnine N-oxide)、马钱子碱N-氧化物(brucine N-oxide)、β-可鲁勃林(β- colubrine)、16-羟基-β-可鲁勃林(16-hydroxy-β- colubrine)、16-羟基-α-可鲁勃林;(2)“伪”系列(pseudo-series)生物碱:伪番木鳖碱(pseudo- strychnine)、伪马钱子碱(pseudo-brucine);(3)“N-甲基伪”系列(N-methylpseudo-series)生物碱:N-甲基-断-伪番木鳖碱(icajine)、番木鳖次碱(vomicine)、N-甲基-断-伪马钱子碱(novacine)。
痹祺胶囊处方来源于汉代名医华佗传世验方“一粒仙丹”,是治疗风湿类常见病和关节炎等慢性病的代表药方,其临床疗效确切[40, 41, 42]。该复方是君、臣、佐、使各味药在方中明确体现的一个名方,此方中君药马钱子为炮制后的调制粉,党参、白术、茯苓和丹参为臣药,三七、川芎、牛膝和地龙为佐药,加之使药甘草调和诸药,充分体现了中药复方的“君、臣、佐、使”配伍原则。药效研究揭示了痹祺胶囊复方配伍的增效减毒机制,为临床合理应用提供可靠的科学依据。
对痹祺胶囊进行拆方配伍的药动学研究表明,臣药组和佐药组均能显著延长士的宁和马钱子碱的达峰时间,延缓吸收,避免过快吸收产生毒副作用,继续将臣、佐药拆方的单味药组与君药配伍,未见明显的药动学差异(图 6、7)[21]。该研究揭示了臣、佐、使药相互作用对君药药动学的影响,体现痹祺胶囊复方配伍的科学性。
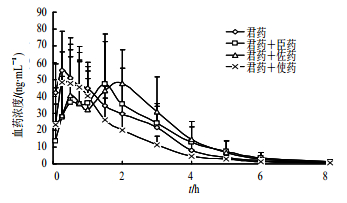 | 图 6 臣、佐、使药对君药中士的宁血药浓度的影响 Fig. 6 Effect of minister, adjuvant, and guide medicines on blood concentration of strychnine in king medicine |
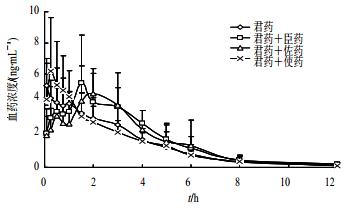 | 图 7 臣、佐、使药对君药中马钱子碱血药浓度的影响 Fig. 7 Effect of minister, adjuvant, and guide medicines on blood concentration of brucine in king medicine |
在痹祺胶囊中,马钱子是经过炮制调制后用药的,炮制后主要生物碱为马钱子碱和士的宁(图 8),其他生物碱的量已经显著降低。而且用辅料调制后,可使马钱子碱和士的宁的量控制到所需水平。因此,在制定该产品的质量标准时,将君药这2种生物碱的量确定为定量测定指标。在此研究中,痹祺胶囊君药的这2种生物碱的量为定量测定指标,不但是Q-marker,也是药代标志物(PK-marker),更是药效的重要有效成分。
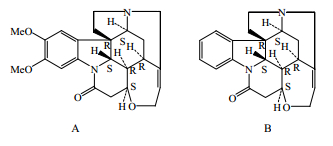 | 图 8 马钱子碱 (A) 和士的宁 (B) 的化学结构 Fig. 8 Structures of brucine (A) and strychnine(B) |
建设以《中国药典》为核心的质量标准体系是中药质量研究和制定国家质量标准的基础,是从国家层面应该重视的大问题。根据食品药品监督管理部门统计的今年前3个月因质量问题不合格产品90%以上是中药,中药质量问题应引起重视。更有甚者,从发表的论文中发现,在中成药中添加多种化学合成药物。如在治疗糖尿病的中药胶囊中非法加入二甲双胍(metformin)、苯乙双胍(phenformin)、格列吡嗪(glipizide)、格列本脲(glibenclamide、glyburide)、匹格列酮(pioglitazone)或罗格列酮(rosiglitazone)[43, 44, 45, 46, 47]。其中发现某降糖中药胶囊,每粒胶囊加入2.6 mg苯乙双胍和2.0 mg格列本脲[47]。正如韩启德院士近日表示“当前中药质量很令人担忧,已经成为中医药发展的瓶颈之一”[48]。他还指出“解决这个问题,不能一蹴而就,需要全面研究,但可以从加强监管做起。不管是天然植物药材还是中成药,其质量都应由第3方来检测,加强第3方监督,这是改革的方向”[48]。
从《中国药典》2015年版一部的内容来看,在内容、标准、科学性等方面比前几版有很大提高。但是,《中国药典》是药品质量管理的法典,是公开的执法标准。因此必须在命名、处方组成和剂量、检测项目和含量测定、君臣佐药的成分选择、同名复方产品的不同制剂的质量可比性和可替代性以及方剂中药的质量标准中从原料到成品的朔源性等问题进行规范处理。
中药是传统中医药一部分,其品种发展与中医药理论指导下的处方和制法密切相关,但作为药物,其质量标准必须符合相关法规和规范,才能成为安全、有效、质量可控的产品。2016年3月4日国务院发布的促进医药产业健康发展的文件中,提出“完善质量标准体系,健全以《中国药典》为核心的国家药品标准体系,实施药品、医疗器械标准提高行动计划,推动基本药物、高风险药品、药用辅料、包装材料及基础性、通用性和高风险医疗器械的质量标准升级,完善中药、民族药的药材及药品生产技术规范和质量控制标准,提高标准的科学性、合理性及可操作性,强化标准的权威性和严肃性”。从中更认识到《中国药典》在质量标准体系建设中的核心地位,明确了《中国药典》放在食品药品监督管理总局、药审、药检三者关系中核心地位的重要性。食品药品监督管理总局是领导3方的上层建筑,药审和药检的审评和质量检验必须符合《中国药典》的法定要求(图 9),才能有利于建设以《中国药典》为核心的国家药品标准体系。
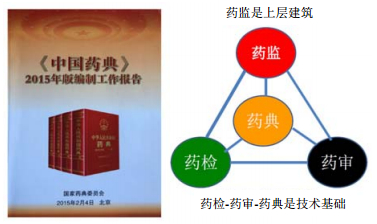 | 图 9 以《中国药典》为核心的国家药品标准体系 Fig. 9 National drug standards system of Chinese Pharmacopoeia as core |
标志物(marker)是一个“热词”。与药物和治疗有关的“生物标志物”(Bio-marker)是标记系统、器官、组织、细胞及亚细胞结构或功能的改变或可能发生的改变的生物学或生物化学指标,它具有非常广泛的用途。生物标志物可用于疾病诊断、判断疾病分期或者用来评价新药或新疗法在目标人群中的安全性及有效性。遗传标志物本身是没有生物学功能的,其变异(DNA序列或结构改变)无致病作用。而基因是有功能的,其序列或结构的改变常引起功能改变并导致疾病。遗传标志物常用于分子诊断,用来标记某重要癌基因附近的基因组区,追踪家族中是否遗传该癌基因或肿瘤细胞,是否丢失该基因。植物标志物(plant marker)也称植物生物标志物(plant bio-marker),是植物在其生命期中形成的次生代谢物,其研究是发现植物发育分化生长过程中有代表物种特征的物质。由此衍生出中药Q-marker,因其研究是从次生代谢物的化学本质出发的,所以也可称之为质量化学标志物(Q-Chem- marker),用于发现代表某一中药的特有次生代谢物与其种属关系,确定代表某种中药的特征的标志物以及其与相关物质的功效和医学用途。
为提高中药质量,国内研究者提出过多种研究中药Q-marker的概念。如中药质量生物标志物(Q-Bio-marker)是能够直接或间接反映中药产品临床功效或药理作用的生物活性指标,包括生物活性值或效价(biopotency)、生物活性标志物(biomarker)、生物效应表达谱(biological fingerprint)等。生物效价可以较好地反映中药产品的整体活性或功效,特别适用于化学物质基础不清楚,常规理化方法难以评价其质量的中药产品[49]。生物效应表达谱不仅可以评价中药质量优劣,由于其指纹性或特征性,也可以用于中药质量真伪鉴别或质量波动监测[50]。中药质量综合标志物(Q-Holistic marker)是将与中药内在质量关联的多种指标综合并量化加权形成的质量评价指标,如道地品质指数[51]、效应成分指数[52]、效应当量[53]等。基于代谢组学的生物标志物对评价中药质量具有较强的质量区分力[54]。由于中药的多成分、多功效的质量特点,单一某种类型的指标有时很难从整体上评价中药质量,中药质量综合标志物具有整体性、系统性和可量化的优势,在中药质量综合评价方面具有优势[55]。
6.3 中药Q-marker与中药有效成分的区别中药药效物质(有效成分)既可以原型形式发挥药效,也可以一种至数种(或众多种)代谢产物的形式发挥药效,还可以二者均发挥药效。为此,将所有可能在体内直接发挥药效的物质形式称为“显效形式”,进而提出显效形式在一个靶点上的“叠加作用”的假说,以期可以通过系统研究来证明中药药效物质的“显效形式”及其“叠加作用”的作用机制[56]。多成分或/和多代谢产物在各个靶点上的叠加作用,再加上各个靶点之间多成分的协同作用,共同构成了中药发挥药效的药理学作用机制的重要内涵。中药药效物质的“显效形式”及其作用机制(叠加作用及协同作用)的阐明,必将为中药的有效性提供科学依据。而中药Q-marker是药物制剂中固有存在的化学物质,并不分析这些物质的体内复杂过程,不考虑多种成分和多种代谢产物对质量控制的贡献。
6.4 中药Q-marker与PK-marker的区别根据PK-marker概念,认为在中药制剂中的化学成分或其代谢产物在体内以原型或代谢物形式存在于体液或组织或排泄物中,并能在体内转运和测定到它们随时间变化的规律,将这类物质称之为PK-markers[21]。中国学者在开展复方制剂多成分药动学研究中提出中药PK-markers主要用来反映给药后中药体内物质暴露及影响因素[57, 58, 59, 60, 61]。重视中药物质基础研究,提出新的研究思路,更有利于中药新药研究开发[62, 63, 64, 65]。中药是一个复杂体系,用不同类别的标志物(markers)反映其体内物质暴露、质量、药效、安全性等具有积极的科学意义。这类具有适当的药动学(pharmacokinetics,PK)性质的物质与发挥药效有关,或与在作用靶点并维持一定浓度发挥药效有关。对复方丹参制剂而言,其Q-marker应该是客观存在于制剂中与生物活性有关的固有物质,并不考虑体内代谢产物存在和与活性及作用机制的关系。
6.5 中药Q-marker的提出对中药标准化建设的意义 6.5.1 中药Q-marker的提出密切中药有效性-物质基础-质量控制标志性成分的关联度长期以来,中药质量控制手段、质量评价指标及质量标准与中药的有效性关联性不强,缺少能反映中药有效性的核心质量概念的统领,在药材、饮片、中成药质量研究中存在碎片化的倾向。中药Q-marker概念的提出,针对中药生物属性、制造过程及配伍理论等自身医药体系的特点,整合多学科知识,提出核心质量概念,以此统领中药质量研究,进一步密切中药有效性-物质基础-质量控制标志性成分的关联度。
6.5.2 中药Q-marker的提出有利于建立中药全程质量控制及质量溯源体系中药Q-marker源自中药基原生物体内的生物合成,经历采收加工、炮制及制药工艺过程的物质传递及化学变化,最终以复方制剂的形式通过药物传输过程发挥临床疗效,其以物质-功能为核心贯穿中药形成及生产全过程[53]。并以中药饮片标准汤剂为研究的核心范本进行质量研究,确定Q-marker,并向药材和饮片(及炮制品)溯源,向复方制剂和中成药延伸。所建立的思维模式和研究方法着眼于全过程的物质基础特有、差异、动态变化和质量的传递性、溯源性,有利于建立中药全程质量控制及质量溯源体系。
| [1] | 马双成, 戴忠, 丁丽霞. 中药质量标准的研究进展(上)[J]. 中国药师, 2006, 8(1):29-33. |
| [2] | 马双成, 戴忠, 丁丽霞. 中药质量标准的研究进展(下)[J]. 中国药师, 2006, 8(2):132-135. |
| [3] | 董荣富. 中药质量标准目前存在的某些问题[J]. 中国民族民间医药, 2010, 19(20):21-22. |
| [4] | 石上梅, 钱忠直. 逐步建立和完善提高符合中医药特点的中药质量标准——解读《中国药典》2010年版(一部)[J]. 中国现代中药, 2010, 12(9):3-6. |
| [5] | 刘晶晶, 王晶娟, 张贵君. 现行中药质量标准研究的误区及其解决方案[J]. 现代药物与临床, 2013, 28(2):258-260. |
| [6] | 解思友, 张贵君. 中药的质量标准与中药安全性[J]. 药物评价研究, 2013, 36(4):245-248. |
| [7] | Han J P. An authenticity survey of herbal medicines from markets in China using DNA barcoding[J]. Sci Rep, 2016, 6:18723. |
| [8] | Xin T Y, Li X J, Yao H. Survey of commercial Rhodiola products revealed species diversity and potential safety issues[J]. Sci Rep, 2015, 5:8337. |
| [9] | 李振皓, 钱忠直, 程翼宇. 基于大数据科技的中药质量控制技术创新战略[J]. 中国中药杂志, 2015, 40(17):3374-3378. |
| [10] | 贺兰英. 再谈中药现代化——中药质量标准是中药现代化的前提[J]. 中医药学刊, 2004, 22(1):148-171. |
| [11] | 安卓玲. 中药质量标准与现代分析技术在中药指纹图谱中的应用[J]. 黑龙江医药, 2007, 20(1):45-48. |
| [12] | 郭炜, 张兰桐. 现代分析技术在中药质量控制中的应用[J]. 中国药业, 2004(11):78-80. |
| [13] | 孙琴, 肖小河, 金城, 等. 中药质量控制和评价模式应多元化[J]. 中药材, 2008, 31(1):1-4. |
| [14] | 戚进, 余伯阳. 中药质量评价新模式——""谱效整合指纹谱""研究进展[J]. 中国天然药物, 2010, 8(3):171-176. |
| [15] | 蒋庆峰, 金松子, 蔡振华, 等. 现代分析技术在中药质量控制中的应用[J]. 现代仪器, 2007(3):1-8. |
| [16] | 倪力军, 郭佳, 曾晓虹, 等. 指纹图谱评价中药质量的方法学考证[J]. 中药新药与临床药理, 2006, 17(2):116-119. |
| [17] | 杨华, 齐炼文, 李会军, 等. 以""等效成分群""为标示量的中药质量控制体系的构建[J]. 世界科学技术-中医药现代化, 2014, 16(3):510-513. |
| [18] | 刘凯, 魏颖, 刘洋洋, 等. ""一测多评""法在中药质量评价中的研究进展[J]. 现代中药研究与实践, 2013, 27(6):81-84. |
| [19] | 范成杰. ""一测多评""法在中药质量评价和控制中的应用概况[J]. 中药与临床, 2013, 4(2):18-20. |
| [20] | 杨蕾, 郭娟, 高伟, 等. 药用植物次生代谢物的生物合成和代谢调控[A]//黄璐琦,刘昌孝. 分子生药学[M]. 第3版. 北京:科学出版社, 2015. |
| [21] | 刘昌孝. 中药药物代谢动力学研究思路与实践[M]. 北京:科学出版社, 2013. |
| [22] | 康亚兰, 裴瑾, 蔡文龙, 等. 药用植物黄酮类化合物代谢合成途径及相关功能基因的研究进展[J]. 中草药, 2014, 45(9):1336-1341. |
| [23] | Schijlen E G W M, de Vos C H R, van Tunenet A J, et al. Modification of flavonoid biosynthesis in crop plants[J]. Phytochemistry, 2004, 65:2631-2648. |
| [24] | 王青云. 中草药的有效成份探讨[J]. 内蒙古中医药, 2010, 28(13):105-106. |
| [25] | Sato F, Hashimoto T, Hachiya A, et al. Metabolic engineering of plant alkaloid biosynthesis[J]. Proc Natl Acad Sci, 2001, 98(1):367-372. |
| [26] | St-Pierre B, Vazquez-Flota F A, De Luca V. Multicellular compartmentation of catharanthus roseus alkaloid biosynthesis predicts intercellular translocation of a pathway intermediate[J]. Plant Cell, 999, 11(5):887-900. |
| [27] | Schilmiller A L, Last R L, Pichersky E. Harnessing plant trichome biochemistry for the production of useful compounds[J]. Plant J, 2008, 54(4):702-711. |
| [28] | Bouwmeester H J, Gershenzon J, Konings M C, et al. Biosynthesis of the monoterpenes limonene and carvone in the fruit of caraway. Ⅰ. Demonstration of enzyme activities and their changes with development[J]. Plant Physiol, 1998, 117(3):901-912. |
| [29] | 黄璐琦, 郭兰萍, 胡娟, 等. 道地药材形成的分子机制及其遗传基础[J]. 中国中药杂志, 2008, 33(20):2303-2308. |
| [30] | 侯娅, 马阳, 邹立思, 等. 生态因子对药用植物次生代谢物的影响及其研究方法[J]. 时珍国医国药, 2015, 26(1):187-190. |
| [31] | 谭友莉, 马云桐, 文静, 等. 气候变暖对药用植物次生代谢产物的影响[J]. 中药与临床, 2014, 5(5):1-4. |
| [32] | 焦晓林, 高微微. 环境因子对药用植物三萜皂苷合成影响的研究进展[J]. 中草药, 2011, 42(2):398-402. |
| [33] | 杨菲, 王智民, 张启伟, 等. ""一测多评""法测定丹参酚酸类成分的含量[J]. 中国中药杂志, 2011, 46(17):2372-2379. |
| [34] | 朱晶晶, 王智民, 匡艳辉, 等. 一测多评法同步测定人参和三七药材中多种人参皂苷的含量[J]. 药学学报, 2008, 43(12):1211-1216. |
| [35] | 孔晶晶, 朱晶晶, 王智民, 等. 一测多评法测定连翘中多种不同类型成分的含量[J]. 中国药学杂志, 2010, 45(17):1301-1304,. |
| [36] | Cheng H T, Li X L, Li X, et al. Simultaneous quantification of selected compounds from Salvia herbs by HPLC method and their application[J]. Food Chem, 2012, 130:1031-1035. |
| [37] | Liu A H, Li L, Xu M, et al. Simultaneous quantification of six major phenolic acids in the roots of Salvia miltiorrhiza and four related traditional Chinese medicinal preparations by HPLC-DAD method[J]. J Pharm Biomed Anal, 2006, 41:48-56. |
| [38] | Shi Z H, He J T, Yao T T, et al. Simultaneous determination of cryptotanshinone, tanshinone Ⅰ and tanshinone ⅡA in traditional chinese medicinal preparations containing Radix Salvia miltiorrhiza by HPLC[J]. J Pharm Biomed Anal, 2005, 37:481-486. |
| [39] | Zhang J L, Cui M, He Y, et al. Chemical fingerprint and metabolic fingerprint analysis of Danshen injection by HPLC-UV and HPLC-MS methods[J]. J Pharm Biomed Anal, 2005, 36(5):1029-1035. |
| [40] | 刘维, 周艳丽, 张磊, 等. 痹祺胶囊抗炎镇痛作用的实验研究[J]. 中国中医药科技, 2006, 13(5):315-316. |
| [41] | 边新群, 刘维. 痹祺胶囊治疗类风湿性关节炎的药效学实验研究[J]. 中华中医药杂志, 2006, 21(12):773-774. |
| [42] | 王景文, 袁雪海, 赵连根. 痹祺胶囊对足跖肿胀及肢体血流作用的研究[J]. 中草药, 1999, 30(9):686-688. |
| [43] | 董宇, 孔璋, 钟大放. 液相色谱-质谱联用法检测中药降糖制剂中非法掺入的苯乙双胍和格列本脲[J]. 沈阳药科大学学报, 2005, 22(1):19-22. |
| [44] | 刘福艳, 谢元超, 刘福强, 等. 液相色谱-质谱联用法检测2种中药降糖制剂中非法掺入的二甲双胍、苯乙双胍、格列吡嗪、格列本脲[J]. 中国药物分析杂志2009, 29(3):440-444. |
| [45] | 邱颖姮, 梁智渊, 刘中博, 等. 串联四极杆质谱法测定中药降糖制剂中掺入吡格列酮的研究[J]. 中国现代应用药学杂志, 2008, 25(3):247-248. |
| [46] | 邱颖姮, 王铁杰, 李玉兰, 等. 液相色谱-串联四极杆质谱联用法测定中药降糖制剂中掺入罗格列酮的研究[J]. 中国药物分析杂志, 2008, 28(2):323-325. |
| [47] | Lin Y P, Si D Y, Liu C X. Detection of synthetical compounds illegally mixed into traditional Chinese medicine antidiabetic preparations by liquid chromatography-mass spectrometry[J]. J Tianjin Univ Sci Technol, 2008, 41(6):720-724. |
| [48] | 韩启德. 对当前发展中医药的几点建议[J]. 紫光阁, 2016(3):29. |
| [49] | 肖小河, 王伽伯, 鄢丹. 生物评价在中药质量标准化中的研究与应用[J]. 世界科学技术-中医药现代化, 2014, 16(3):514-518. |
| [50] | 戚进, 余伯阳. 中药质量评价新模式——""谱效整合指纹谱""研究进展[J]. 中国天然药物, 2010, 8(3):171-176. |
| [51] | 肖小河, 王伽伯, 鄢丹, 等. ""道地综合指数""的构建及其应用价值[J]. 中国中药杂志, 2012, 47(11):1513-1516. |
| [52] | 熊吟, 肖小河, 鄢丹, 等. 综合量化集成的中药品质评控策略:中药效应成分指数[J]. 中草药, 2014, 45(1):1-7. |
| [53] | 静云, 王一涛. 中药质量追溯体系发展现状研究[J]. 中国中药杂志, 2013, 48(22):3829-3833. |
| [54] | 张海珠, 肖小河, 王伽伯, 等. 中药质量评控的第一要义:效应当量一致性[J]. 中草药, 2015, 46(11):1571-1575. |
| [55] | 范玛莉, 邢婕, 李震宇, 等. 基于NMR代谢组学技术的白芍与赤芍化学成分比较研究[J]. 中草药, 2014, 45(22):3230-3237. |
| [56] | 徐风, 杨东辉, 尚明英, 等. 中药药效物质的""显效形式""、""叠加作用""和""毒性分散效应""——由中药体内代谢研究引发的思考[J]. 世界科学技术-中医药现代化, 2014, 16(4):688-703. |
| [57] | Xiao X F, Qiao X L, Hou W B, et al. Studies on pharmacokinetics of pharmacokinetic-markers in Huanglianjiedu Decoction to cerebral ischemia reperfusion model mice[J]. Asian J Pharmacod Pharmacokinet, 2008, 8(4):287-298. |
| [58] | Lu T, Yang J L, Gao X M, et al. Plasma and urinary tanshinol from Salvia miltiorrhiza (Danshen), can be used as pharmacokinetic markers for cardiotonic pills, a cardiovascular herbal medicine[J]. Drug Metab Dispos, 2008, 36:1578-1586. |
| [59] | Liu H, Yang J, Du F, et al. Absorption and disposition of ginsenosides after oral administration of Panax notoginseng extract to rats[J]. Drug Metab Dispos, 2009, 37(12):2290-2298. |
| [60] | Hu Z, Yang J, Cheng C, et al. Combinatorial metabolism notably affects human systemic exposure to ginsenosides from orally administered extract of Panax notoginseng roots (Sanqi)[J]. Drug Metab Dispos, 2013, 41(7):1457-1469. |
| [61] | Li M, Wang F, Huang Y, et al. Systemic exposure to and disposition of catechols derived from Salvia miltiorrhiza roots (Danshen) after intravenous dosing DanHong Injection in human subjects, rats, and dogs[J]. Drug Metab Dispos, 2015, 43(5):679-690. |
| [62] | 张铁军. 中药质量认识与质量评价[J]. 中草药, 2011, 42(1):1-9. |
| [63] | 潘雪梅, 韦辉, 刘毅, 等. 不同产地丹参药材质量研究[J]. 中草药, 2011, 42(9):1833-1836. |
| [64] | 韦辉, 刘素香, 刘毅, 等. 丹参药材的综合质量评价研究[J]. 药物评价研究, 2011, 42(5):343-347. |
| [65] | 刘昌孝, 张铁军, 何新, 等. 活血化瘀中药五味药性功效的化学及生物学基础研究的思考[J]. 中草药, 2015, 46(5):615-624. |
 2016, Vol. 47
2016, Vol. 47


