黄芪为《中国药典》2010年版[1]收载品种,为豆科(Leguminosae)植物蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. monghoicus (Bge.) Hisao或膜荚黄芪Astragalus membranaceus (Fisch.) Bge. 的干燥根。其主要含皂苷、黄酮、多糖、氨基酸等成分。《中国药典》2010年版、《中药成方制剂》[2]、《新药转正标准》[3]共收载含黄芪制剂140个,涉及黄芪中皂苷、黄酮类成分的测定及薄层鉴别项。分析140个药材及成药标准发现,黄芪皂苷均以黄芪皂苷IV为指标成分,方法均采取碱化处理,促使黄芪中黄芪皂苷Ⅰ、Ⅱ转化为黄芪皂苷IV,而后进行测定;黄酮类成分除黄芪药材测定毛蕊异黄酮葡萄糖苷量外,成药多采用薄层方法进行鉴别。上述2类方法很难全面真实反映黄芪药材质量。经实验发现[4],不同来源的黄芪药材不经碱化处理时黄芪皂苷Ⅰ、Ⅱ、Ⅲ、Ⅳ量相差悬殊。各成药处方组成中,黄芪药材君、臣、佐、使作用各不相同,复杂的化学成分体系发挥了不同的药理作用,仅以单一指标成分作为评价手段很难真实地反映药材或产品质量,为此,本实验收集不同产地、不同品种(野生、栽培)的膜荚黄芪、蒙古黄芪共20批,建立皂苷、黄酮类成分的特征图谱,并采用化学计量学分析方法进行深入研究,揭示影响黄芪药材质量的活性成分,从而为质量评价工作以及物质基础研究提供实验依据。
1 仪器与材料Waters 2695-2996高效液相色谱仪,DAD-ELSD检测器;对照品黄芪甲苷即黄芪皂苷IV(批号110781-200613)、芒柄花素(批号 111703-200602)、毛蕊异黄酮-7-O-葡萄糖苷(批号111920-201001)均购自中国食品药品检定研究院;黄芪皂苷Ⅰ(E-0129)、Ⅱ(E-0130)、Ⅲ(E-0131)质量分数均大于98%,毛蕊异黄酮(E-0156)、芒柄花素-7-O-葡萄糖苷(E-0573)质量分数均大于98%,均购自上海同田生物科技有限公司;试剂均为分析纯、色谱纯,药材由中国食品药品检定研究院中药所张继鉴定为膜荚黄芪Astragalus membranaceus (Fisch.) Bge.、野生和日本、甘肃栽培蒙古黄芪 Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao、市售黄芪(未鉴定种),具体样品信息见表 1。
| 表 1 黄芪药材来源信息表 Table 1Sample information |
色谱柱:Agilent SB C18柱(250 mm×4.5 mm,5 μm);流动相为乙腈(A)-水(B),梯度洗脱:0~30 min,32%~45% A;30~35 min,45% A;35~40 min,45%~80% A;40~45 min,80% A;ELSD检测,柱温30 ℃;进样量10 μL。
2.1.2 黄酮测定条件[6]色谱柱:Agilent SB C18柱(250 mm×4.5 mm,5 μm);流动相乙腈(A)-0.2%甲酸(B),梯度洗脱,0~30 min,16%~40% A;30~35 min,40% A;35~45 min,40%~80% A;检测波长260 nm;柱温30 ℃;进样量10 μL。
2.2 对照品溶液的制备 取黄芪皂苷Ⅰ 10.85 mg、Ⅱ 13.35 mg、Ⅲ 10.60 mg、Ⅳ 12.15 mg至50 mL量瓶;另取毛蕊异黄酮-7-O-葡萄糖苷(13.15 mg)、芒柄花素(12.6 mg)、芒柄花素-7-O-葡萄糖苷13.20 mg、毛蕊异黄酮15.10 mg至25 mL量瓶中,分别加甲醇定容至刻度,配得皂苷、黄酮混合对照品溶液。 2.3 供试品溶液的制备 2.3.1 皂苷类成分供试品溶液的制备[5]取药材粉末约4 g,加甲醇40 mL,加热回流1 h,滤过,滤液蒸干,残渣加水10 mL,微热使溶解,用水饱和的正丁醇振摇萃取4次,每次40 mL,合并正丁醇液,蒸干,残渣加水5 mL使溶解,放冷,通过大孔吸附树脂,以水50 mL洗脱,弃去水液,再用40%乙醇30 mL洗脱,弃去洗脱液,继用70%乙醇80 mL洗脱,收集洗脱液,蒸干,残渣加甲醇定容于5 mL量瓶,即得供试品。
2.3.2 黄酮类成分供试品溶液的制备[6]取药材粉末(过四号筛)约1 g,置圆底烧瓶中,加入甲醇50 mL,加热回流4 h,滤过,滤液蒸干,残渣加甲醇10 mL,即得供试品。
2.4 方法学考察 2.4.1 指纹图谱的精密度试验 精密吸取“2.3.1”中的皂苷类成分供试品溶液和“2.3.2”项中的黄酮类成分供试品溶液各10 μL,连续进样6次,测得黄芪皂苷Ⅰ、Ⅱ、Ⅲ、Ⅳ,毛蕊异黄酮-7-O-β-D-葡萄糖苷,芒柄花素-7-O-β-D-葡萄糖苷,芒柄花素,毛蕊异黄酮峰面积的RSD分别为1.5%、2.1%、0.9%、1.1%、0.8%、1.1%、1.0%、1.1%。 2.4.2 指纹图谱的稳定性试验取“2.3.1”中的皂苷类成分供试品溶液和“2.3.2”中的黄酮类成分供试品溶液,在室温下放置,分别在0、2、4、6、12、24 h进样10 μL,测得黄芪皂苷Ⅰ、Ⅱ、Ⅲ、Ⅳ,毛蕊异黄酮-7-O-β-D-葡萄糖苷,芒柄花素-7-O-β-D-葡萄糖苷,芒柄花素,毛蕊异黄酮峰面积的RSD分别为1.9%、2.2%、1.3%、1.7%、1.0%、1.2%、1.5%、1.2%。
2.4.3 指纹图谱的重复性试验取同一份黄芪样品,按“2.3.1”及“2.3.2”项下方法各制备3份供试品溶液,测得指纹图谱,结果各主要共有峰相对峰面积的RSD在0.10%~0.42%,相对保留时间的RSD在0.08%~0.21%。表明方法重复性较好。
2.5 特征图谱共有模式识别采用ChemPattern软件,对20批黄芪药材样品色谱图进行比较,20批样品色谱图见图 1。以图 1为基础,对数据进行标准化处理,共有峰筛选选取所有变量,最终形成黄酮、皂苷的共有模式图,并标记相应色谱峰,见图 2、图 3。略去峰面积小于5%的色谱峰,黄酮色谱图选取4、7、8、13、17、19号峰;皂苷色谱图选取3、5、6、7、8、9、11、13、15、16、19号峰,并将黄酮类成分的峰和皂苷类成分的峰号前加“h”和“z”,分别代表黄酮色谱图和皂苷色谱图中峰号对应的化合物,形成黄酮-皂苷的共有模式柱状图,结果见图 4。
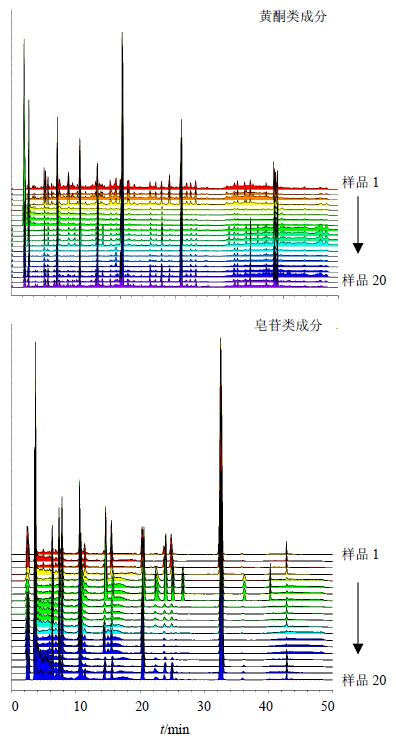 |
4-毛蕊异黄酮-7-O-β-D-葡萄糖苷 8-芒柄花素-7-O-β-D-葡萄糖苷 13-芒柄花素 19-毛蕊异黄酮 4-calycosin-7-O-β-D-glucoside 8-formononetin-7-O-β-D-glucoside 13-formononetin 19-calycosin 图 1 黄芪药材的HPLC图Fig.1 HPLC of Astragali Radix |
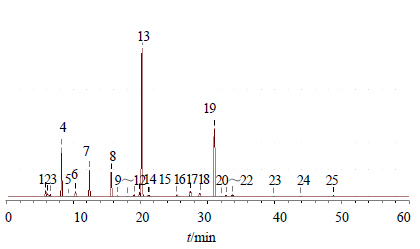 |
9-黄芪皂苷Ⅳ 11-黄芪皂苷Ⅲ 13-黄芪皂苷Ⅱ 19-黄芪皂苷I 9-astragaloside Ⅳ 11-astragaloside Ⅲ 13-astragaloside II 19-astragaloside I 图 2 黄酮类成分共有模式图Fig.2 Common pattern of flavonoids |
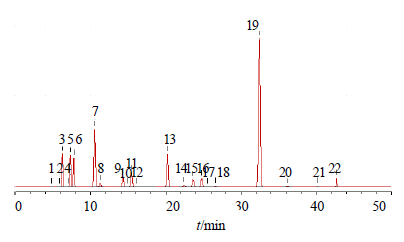 | 图 3 皂苷类成分共有模式图Fig.3 Common pattern of saponins |
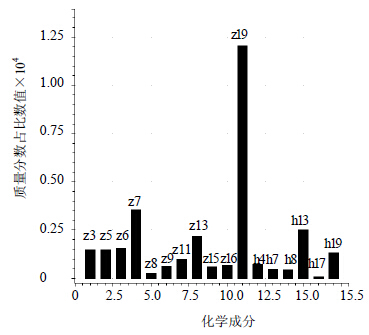 | 图 4 黄芪药材中黄酮和皂苷类成分共有模式Fig.4 Common pattern of flavonoids and saponins in Astragali Radix |
采用科迈恩科技有限公司ChemPattern软件对黄芪皂苷、黄酮数据进行化学计量学分析。
2.6.1 主成分分析主成分分析是一种无监督多变量数据分析法,将原始变量(黄芪皂苷、黄酮各峰峰面积)转换成不相关变量(主成分)。PC1代表最显著数据差异,PC2代表剩余变量中最大数据差异,以此类推。将黄芪皂苷、黄酮共17个特征峰峰面积作为输入变量(20×17)用于主成分分析,结果见图 5。由图 5-A可知,PC1和PC2的总方差贡献率为91.83%(其中,PC1=70.6%,PC3=21.23%)。PC1图显示,野生蒙古黄芪和日本栽培蒙古黄芪为 正值,其他品种为负,且载荷得分较高的峰为h13和z19,因此仅根据芒柄花素和黄芪皂苷I量的差异可先将5组样品分为2类。PC2图显示野生蒙古黄芪为正值,日本栽培蒙古黄芪为负,载荷得分高的峰除h13外还有z9、z6。因此,通过h8、z9以及z6的量差异可以再对二者进行区分;膜荚黄芪、甘肃栽培蒙古黄芪、樟树药市购买黄芪在PC1-PC2图中相对集中,不能进行有效区分,需通过PC1-PC3图进行分类识别。由图 5-B显示,PC3上,甘肃栽培蒙古黄芪为正值,膜荚黄芪为负,樟树药市收集黄芪分别接近这2个品种,由载荷得分较高的成分z7、z19、h13可以对样品进行有效识别。综上所述可以发现,z19、h8、z9、z6、z7即黄芪皂苷Ⅰ、芒柄花素、黄芪皂苷IV和2个未知皂苷成分(z7和z6)为影响黄芪药材质量评价的主要成分,其他成分方差贡献总和小于10%,不具代表性。
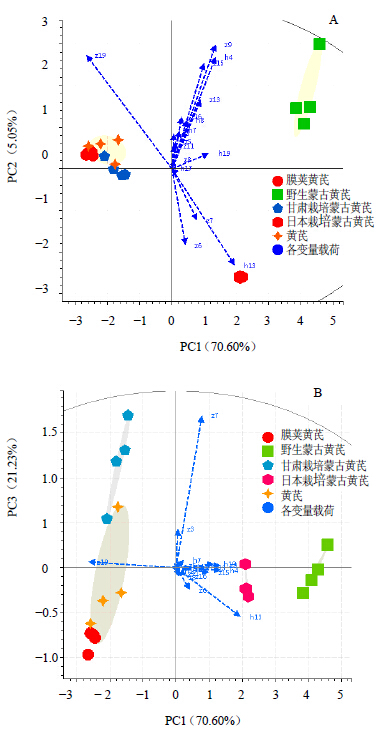 | 图 5 PC1-PC2 (A) 和PC1-PC3 (B) 主成分分析图Fig.5 Principal component analysis score of PC1-PC2 (A) and PC1-PC3 (B) |
采用多元统计分析中的聚类分析法,分析参数选取欧氏距离,对20批黄芪药材中皂苷、黄酮类成分进行比较,同时验证主成分分析结果。结果见图 6。由图 6-A可以看出野生蒙古黄芪和日本栽培蒙古黄芪相似度较高可聚为一类,而膜荚黄芪与蒙古黄芪(甘肃栽培品种)可聚为一类,未见明显差别,樟树药市购买黄芪可分别与膜荚黄芪、甘肃栽培蒙古黄芪聚为一类。图 6-B为二维系统聚类图,颜色越接近红色,化学成分聚类程度越高。由图 6-B可知,影响最大的变量参数的峰依次为z19、z7、h13、z6、z9,与主成分分析结果基本一致。上述分析表明,不同品种的黄芪(蒙古黄芪、膜荚黄芪)在化学成分构成上可能相似,不同地域反而导致了化学成分的差异,因此只有制定合理的标准,控制关键性变量才能有效控制药材质量
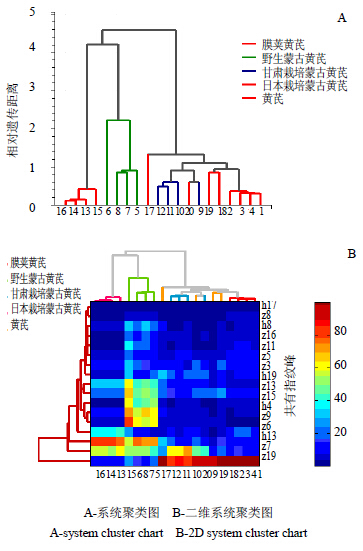 |
A-系统聚类图 B-二维系统聚类图 A-system cluster chart B-2D system cluster chart 图 6 黄芪药材聚类分析Fig.6 Cluster analysis of Astragali Radix |
中药区别于化学合成药,其依靠所含多种成分协同发挥综合药效,仅以1种或2种化学指标很难评价中药的真伪优劣。《中国药典》2010年版规定,黄芪为蒙古黄芪或膜荚黄芪的干燥根,2个品种可等同入药。统计涉及黄芪药材的相关标准发现,各标准中,多采用碱化处理样品,仅以转化后的黄芪甲苷为指标进行测定。在实际应用中,植物药来源的种属不同,其自身代谢需要从土壤摄取和形成的化学物质也不同,许多随机因素影响了化学成分的组成。本实验同时建立了黄芪中皂苷、黄酮2类成分的特征图谱,并采用化学计量分析法对2类成分的数据进行综合统计分析。结果表明,不同产地、不同品种的黄芪,化学成分存在差异,17个特征成分中,黄芪皂苷Ⅰ、芒柄花素、黄芪皂苷IV、z6(未知皂苷成分)、z7(未知皂苷成分)5个成分的量差异较大,直接影响黄芪药材的质量评价。目前,由于前期收集样品总量有限,制备出的2个未知皂苷类成分不能同时满足核磁、质谱、红外光谱等结构鉴定用量,对于结构的准确确认还需进一步样品收集。同时本研究确定的5种成分是否在药效、毒理方面有明显区别,还需进一步研究,如有明显差异建议有目的地针对这5种成分建立测定标准,从而有效规范黄芪药材及成药的产品质量。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 中华人民共和国卫生部药品标准中药成方制剂 [S]. 2010. |
| [3] | 国家药品标准-新药转正标准 [S]. 2010. |
| [4] | 刘孜, 周晶, 张庆伟, 等. 氨液水解法用于提高黄芪中黄芪甲苷含量的工艺研究 [J]. 中国中药杂志, 2008, 33(6): 635-638. |
| [5] | 汪祺, 张聿梅, 戴忠, 等. 黄芪药材HPLC特征图谱研究 (1) 皂苷类成分 [J]. 药物分析杂志, 2012, 32(7): 1101-1104. |
| [6] | 汪祺, 张聿梅, 戴忠, 等. 黄芪药材HPLC特征图谱研究 (2) 黄酮类成分 [J]. 药物分析杂志, 2012, 32(7): 1272-1276. |
| [7] | 聂磊, 罗国安, 曹进, 等. 中药二维信息指纹图谱模式识别 [J]. 药学学报, 2004, 39(2): 136-1391. |
| [8] | 黎阳, 刘素香, 张铁军, 等. 枳实的高效液相色谱指纹图谱研究 [J]. 中草药, 2009, 40(9): 1469-1474. |
| [9] | 王文燕, 赵强, 张铁军, 等. 白芍的HPLC指纹图谱及模式识别研究 [J]. 中草药, 2009, 40(11): 1810-1814. |
| [10] | 崔红花, 郭娇, 高幼衡, 等. 佛手和属间药用植物的主成分聚类分析及HPLC指纹图谱研究 [J]. 中草药, 2010, 41(6): 978-984. |
| [11] | 赵洪芝, 孟宪生, 叶挺祥, 等. 六味地黄丸的HPLC指纹图谱和模式识别研究 [J]. 中草药, 2010, 41(1): 48-51. |
 2015, Vol. 46
2015, Vol. 46


