浙贝母为道地药材“浙八味”之一,具有润肺止咳的功效,用药历史悠久。贝母品种较多,除了浙贝母外,贝母主要品种还包括川贝母、湖北贝母、平贝母和伊贝母,另外流通领域还存在较多贝母伪品。不同品种的贝母药效差异显著,而且价格相差较大,需要建立一种准确、高效的鉴定方法[1,2]。目前,较多学者利用RAPD技术对浙贝母及其他药材进行分子鉴定,但是由于RAPD实验应用的是随机引物,导致实验结果重复性差,无法推广应用[3,4,5,6,7,8,9]。
本实验室在贝母RAPD实验[10]的基础上筛选到一条浙贝母分子标记,命名为ZB1基因。ZB1基因作为浙贝母分子标记,只存在于浙贝母中,在其他品种中不存在,具有很高的特异性。本实验研究ZB1基因的克隆和测序,以及利用测序结果设计的特异性引物,实现浙贝母特异性PCR鉴定。这种方法由于使用了特异性引物,具有准确、高效的优点,兼具灵敏度和适用性,可以制备成试剂盒推广应用,具有极佳的应用前景。
1 材料与方法 1.1 材料贝母品种包括浙贝母Fritillaria thunbergii Miq.、川贝母F. cirrhosa D. Don、湖北贝母F. hupehensis Hsiao et K.C.Hsia、平贝母F. ussuriensis Maxim和伊贝母F. pallidiflora Schrenk,分别采自于浙江、四川、湖北、吉林和伊犁贝母主产地。其中浙贝母来自鄞州、磐安和象山3个不同产地。样品经浙江工业大学华云芬副教授鉴定为正品。
快速植物基因组提取试剂盒、UNIQ-10柱式DNA回收试剂盒、EZ-10 Spin Column Plasmid DNA Minipreps Kit及PCR相关试剂购自生工®生物工程(上海)有限公司。RAPD引物P1和特异性引物P2/P3由生工®生物工程(上海)有限公司合成。pMD®18-T Vector载体试剂盒由宝生物工程(大连)有限公司生产。E. coli DH5α为实验室保存菌种。琼脂糖、溴化乙锭、X-gal、IPTG、Amp、LB液体培养基、琼脂粉购自生工®生物工程(上海)有限公司。实验使用的PCR扩增仪MyCycleTM Thermal Cycler,电泳仪Power PacTM Basic,凝胶成像系统Molecular Imager® Gel DocTM XR+Imaging System,均为Bio-Rad公司产品。
1.2 方法 1.2.1 RAPD扩增用快速植物基因组提取试剂盒提取贝母基因组DNA。以贝母基因组DNA为模板,进行RAPD扩增,RAPD引物P1的序列为5’-CGACGAAGAA-3’。RAPD扩增体系为:2 μL 10×PCR 缓冲液,1.2 μL MgCl2(25 mmol/L),0.5 μL dNTPs(10 mmol/L),0.3 μL Taq DNA polymerase,0.5 μL RAPD引物P1(20 μmol/L),1.2 μL贝母基因组DNA模板,补加ddH2O至总体积为20 μL。RAPD扩增条件:95 ℃预变性5 min,94 ℃变性30 s,42 ℃复性30 s,72 ℃延伸2 min,30个循环,最后72 ℃延伸5 min。RAPD扩增产物在1.2%琼脂糖凝胶中进行电泳,胶板经溴化乙锭染色后在凝胶成像系统中进行观察,并照相保存。
1.2.2 浙贝母分子鉴定标记的回收、克隆和测序分析RAPD扩增结果,将浙贝母分子标记用刀片小心切下,用UNIQ-10柱式DNA回收试剂盒回收纯化。将纯化产物与pMD®18-T Vector载体进行连接,导入大肠杆菌E. coli DH5α感受态细胞中进行增殖。用灭菌牙签随机挑取数个在含有X-gal、IPTG、Amp的LB琼脂平板培养基上长出的白色单菌落,分别接种于含AMP 0.1 mg/mL的50 mL LB液体培养基中,37 ℃、300 r/min振荡培养10~12 h。用EZ-10 Spin Column Plasmid DNA Minipreps Kit从菌体培养液中提取质粒。经过凝胶电泳鉴定后的重组质粒由南京金斯瑞生物科技有限公司用M13-47(5’-CGCCAGGGTTTTCCCAGTCACGAC-3’)通用引物进行序列测定。
1.2.3 浙贝母特异性PCR鉴定方法根据测序结果,设计并合成一对特异性引物P2/P3,以贝母基因组DNA为模板进行PCR扩增。PCR 扩增体系:2 μL 10×PCR 缓冲液,1.2 μL MgCl2(25 mmol/L),0.5 μL dNTPs(10 mmol/L),0.3 μL Taq DNA polymerase,0.5 μL上游引物P2(20 mmol/L),0.5 μL下游引物P3(20 μmol/L),1.2 μL贝母基因组DNA模板(50 ng/μL),补加ddH2O至反应液总体积20 μL。PCR扩增条件:95 ℃预变性5 min,94 ℃变性30 s,60 ℃复性30 s,72 ℃延伸2 min,30个循环,最后72 ℃延伸5 min。PCR扩增产物在1.2%琼脂糖凝胶中进行电泳,胶板经溴化乙锭染色后在凝胶成像系统中进行观察,并照相保存。为了检测浙贝母特异性PCR鉴定方法的灵敏度和适用范围,将贝母基因组DNA模板分别进行梯度稀释和等量混合后按照上述方法进行PCR。
2 结果与分析 2.1 RAPD扩增结果RAPD 扩增图谱如图 1所示,该图谱条带清晰,呈多态性分布,在750 bp处出现了只有浙贝母有,而其他贝母均无的条带,表明其所含的基因片段为浙贝母品种所特有,可以作为浙贝母分子标记,命名为ZB1基因。
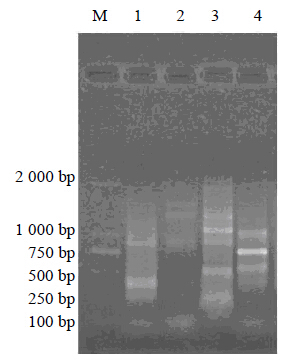 | M-Marker 1-平贝母 2-湖北贝母 3-川贝母 4-浙贝母 M-Marker 1-F. cirrhosa 2-F. hupehensis 3-F. cirrhosa 4-F. thunbergii图 1 RAPD 扩增图谱 Fig. 1 RAPD amplification |
用刀片将750 bp处的条带小心切下后用胶回收试剂盒进行回收,电泳检测结果见图 2。回收片段大小约为750 bp,条带清晰完整,没有降解弥散现象,表明回收质量佳。将回收的ZB1基因与T载体相连形成重组质粒后转化入大肠杆菌进行克隆。挑选克隆子,提取重组质粒进行测序。测序结果(图 3)显示浙贝母分子标记的序列总长度为745 bp,5’端和3’端出现了跟RAPD引物P1序列一致的回文序列,表明此序列确为ZB1基因序列。
 | M-Marker 1-浙贝母分子标记ZB1基因 M-Marker 1-Molecular marker ZB1 from F. thunbergii图 2 浙贝母分子标记ZB1基因电泳图 Fig. 2 Electrophoresis results of ZB1 gene from F. thunbergii |
 | 图 3 浙贝母分子标记ZB1基因的测序结果 Fig. 3 Sequence of ZB1 gene from F. thunbergii |
根据测序结果设计并合成一对特异性引物P2/P3。引物序列为P2:5’-ACAGTACTGGGGGA-GAAGTC-3’,P3:5’-CAAATGGAGGGTATGTGTCG-3’,其分别对应于ZB1基因上的14~33位点和713~732位点。以贝母基因组DNA为模板,特异性引物P2/P3为引物进行特异性PCR扩增,实验结果见图 4。来自3个不同产地的浙贝母基因组DNA均在约750 bp处扩增出单一明亮的条带,其他贝母品种在此位点上均无条带出现。实验重复5次,实验结果均保持稳定,证明应用浙贝母特异性PCR鉴定方法,可以鉴定浙贝母,并且重复性好,明显改善了RAPD反应重复性差的缺点。
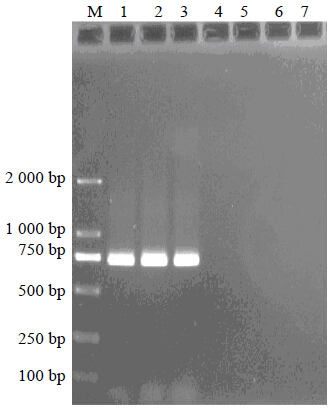 | M-Marker 1-鄞州产浙贝母 2-磐安产浙贝母 3-象山产浙贝母 4-川贝母 5-湖北贝母 6-平贝母 7-伊贝母 M-Marker 1-F. thunbergii from Yinzhou 2-F. thunbergii from Panan 3-F. thunbergii from Xiangshan 4-F. cirrhosa 5-F. hupehensis 6-F. ussuriensis 7-F. pallidiflora图 4 浙贝母特异性PCR扩增图谱 Fig. 4 Specific PCR amplification of F. thunbergii |
浙贝母基因组DNA模板的浓度被梯度稀释后进行PCR。PCR结果见图 5,当模板浓度稀释1 000倍后,即用量为0.06 ng时,在约750 bp处依然出现浙贝母的特异性条带,经过多次重复验证,结果保持稳定,证明浙贝母特异性PCR鉴定方法的灵敏度很高,含量极微弱的浙贝母也能够被鉴定出来。将贝母基因组DNA等量混合后进行PCR。PCR结果见图 6,泳道2中为川贝母、湖北贝母、平贝母和伊贝母基因组DNA的等量混合物,没有加入浙贝母基因组DNA,结果显示无扩增条带出现。泳道1中加入的为浙贝母、川贝母、湖北贝母、平贝母和伊贝母基因组DNA的等量混合物,结果显示,750 bp处出现了明亮的条带,浙贝母在5种贝母的混合材料中被很好地鉴定了出来。经过重复验证,结果保持稳定,表明浙贝母特异性PCR鉴定方法不仅可以检测单个浙贝母样品,还可以在混合物中检测出浙贝母,适用范围较广。
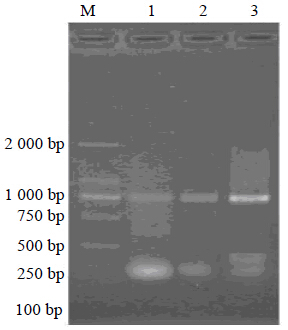 | M-Marker 1-0.1%浙贝母基因组DNA 2-1%浙贝母基DNA 3-10%浙贝母基因组DNA M-Marker 1-0.1% DNA of F. thunbergii 2-1% DNA of F. thunbergii 3-10% DNA of F. thunbergii 图 5 浙贝母特异性PCR鉴定方法对不同浓度样品的鉴定图谱 Fig. 5 Specific PCR amplification of F. thunbergii with different concentration |
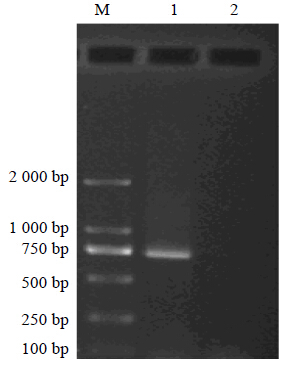 | M-Marker 1-浙贝母、川贝母、湖北贝母、平贝母和伊贝母混合基因组DNA 2-川贝母、湖北贝母、平贝母和伊贝母混合基因组DNA M-Marker 1-mixed DNA samples of F. thunbergii,F. cirrhosa,F. hupehensis,F. ussuriensis,and F. pallidiflora 2-mixed DNA sample of F. cirrhosa,F. hupehensis,F. ussuriensis,and F. pallidiflora图 6 浙贝母特异性PCR鉴定方法对混合样品的鉴定图谱 Fig. 6 Specific PCR amplification of mixed samples |
利用RAPD引物P1进行RAPD扩增后得到的浙贝母分子标记ZB1基因是本实验室在大量工作(近千条RAPD引物)基础上筛选出来的。该分子标记在RAPD多态性分布良好的情况下,显示出特异性条带清晰、明亮,是一条十分理想的分子标记。ZB1基因进行测序后,对其序列编码的蛋白质信息进行了分析,发现该片段为非编码区。目前GenBank中尚未存储浙贝母基因序列,ZB1基因序列是首个被测定的浙贝母基因组DNA序列。在建立浙贝母PCR鉴定方法时,对退火温度进行了研究,当退火温度低于60 ℃时,图谱中会出现一些非特异性扩增条带,所以浙贝母特异性PCR鉴定方法中的关键条件为退火温度。本实验建立的浙贝母特异性PCR鉴定方法可以直接对单一样品进行鉴定,不需要通过多种样品间的相互比较图谱来做出鉴定,这是该法与RAPD的最大不同之处,因此该法具有操作简单、准确、应用范围广等优点。浙贝母特异性PCR鉴定方法使用的是特异性引物,与RAPD相比,结果重复性好、灵敏度高,适合开发成检测试剂盒,具有很好的应用前景。
在检验特异性PCR鉴定方法时使用了5种贝母主要品种,浙贝母选用了3个产地。今后打算将研究内容扩展到其他贝母药用品种、贝母伪品以及百合科非中药植物,以它们的基因组DNA为模板来进一步验证该方法的准确性。还将在ZB1基因内部设计一条套嵌引物,与特异性引物P2/P3联合使用,利用套嵌引物进行浙贝母PCR鉴定,其准确性将会进一步得到提高。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 王 蕊, 周红超. 浅议贝母药材的生药学鉴定 [J]. 中国实用医药, 2011, 6(15): 244-245. |
| [3] | 刘春林, 官春云, 李 栒. 植物RAPD标记的可靠性研究 [J]. 生物技术通报, 1999(2): 31-34. |
| [4] | 卞云云, 李 萍, 高志秋, 等. RAPD技术在中药贝母类研究中的应用 [J]. 中草药, 2000, 31(1): 13-15. |
| [5] | 陆 含, 朱世华, 周书军, 等. 浙贝母4品种及5种贝母遗传多样性的RAPD分析 [J]. 宁波大学学报: 理工版, 2009, 22(1): 44-47. |
| [6] | 李玉峰, 唐 琳, 陈 放. 8种贝母的RAPD分析 [J]. 中成药, 2006, 28(10): 1528-1529. |
| [7] | 田俊生, 史碧云, 张福生, 等. 驴皮药材RAPD分析方法建立及其与伪品马皮的鉴别 [J]. 中草药, 2013, 44(3): 354-358. |
| [8] | 尹春萍, 刘文涛, 徐顺清, 等. 湖北贝母与川贝母随机扩增引物DNA的鉴别 [J]. 医药导报, 2007, 26(4): 359-361. |
| [9] | 李隆云, 陈大霞, 钟国跃, 等. 我国仙茅属植物遗传关系的RAPD分析 [J]. 中草药, 2011, 42(5): 980-984. |
| [10] | 李 敏, 赵 欣. 三种南方贝母的RAPD分析 [J]. 浙江工业大学学报, 2012, 40(6): 634-638. |
 2014, Vol. 45
2014, Vol. 45


