随着近年人平均生育年龄的不断增加[1],加上国家二胎政策的全面实施,使得有生育需求的中老年男性不断增多[2]。但研究发现,老年男性睾丸功能逐渐衰退,精子数量与质量均显著下降,并伴有生殖细胞DNA损伤增加及精子DNA完整性的改变,从而导致精子染色体异常与畸形精子数显著增多[3-4];而精子DNA损伤与染色体异常可导致子女基因缺陷与遗传性疾病的发生[5],如阿佩尔氏综合征等遗传性疾病均与父亲精子DNA突变直接相关[6]。因此,延缓睾丸衰老,防治因衰老而导致的生殖细胞DNA损伤已成为生殖衰老研究的热点。
三七Panax notoginseng (Burk) F. H. Chen为五加科人参属植物,具有延缓衰老和保护生精功能等药理作用[7-8]。三七总皂苷(Panax notoginsengsaponins,PNS)是三七的主要活性成分,具有延缓衰老、抗氧化等多方面的药理作用[9-11]。研究表明PNS能够有效清除羟自由基和超氧自由基,保护DNA免受自由基氧化损伤[12]。研究发现,三七皂苷Rg1对环磷酰胺诱发的小鼠骨髓细胞微核发生和丝裂霉素诱发的小鼠睾丸细胞染色体畸变均有明显的抑制效果,表明三七皂苷Rg1对体细胞和生殖细胞的DNA损伤均有保护作用[13]。但是,PNS是否对自然衰老大鼠睾丸组织DNA损伤具有保护作用鲜有报道。因此,本研究以自然衰老大鼠为模型,研究PNS对自然衰老大鼠睾丸组织DNA损伤的保护作用及其可能机制,以期为临床开发PNS用于防治男性生殖功能衰退提供理论依据和实验思路。
1 材料 1.1 实验动物SPF级雄性SD大鼠50只,3月龄体质量(250±30)g,18月龄体质量(550±50)g,购于北京维通利华实验动物技术有限公司,许可证号SCXK(京)2012-0001,批号11400700003309。动物分笼饲养于室温(23±3)℃、湿度(60±5)%的12 h阴暗交替的三峡大学实验动物中心的SPF级动物房中,自由饮水摄食。
1.2 实验药物PNS购于成都植标化纯生物技术有限公司,质量分数>95%,批号PCS0841。
1.3 实验试剂β-actin(Proteintech公司,货号66009-1-lg);ATR(Santa Cruz公司,货号sc-1887);Chk1(Santa Cruz公司,货号sc-8408);p-P53(Cell signaling公司,货号#12571);γ-H2AX(Abcam公司,货号ab26350);P21(Abcam公司,货号ab109199);羊抗鼠、羊抗兔、兔抗羊二抗(武汉科瑞有限公司);二氨基联苯胺(3, 3′-diaminobenzidine,DAB)试剂盒(武汉博士德生物工程有限公司);BeyoECL Plus超敏ECL化学发光剂盒(碧云天生物技术研究所)。
1.4 实验仪器LEICA EG1150C超薄切片机(德国Leica公司);BX53显微镜(日本Olympus公司);CT15RT高速冷冻离心机(上海天美生化仪器设备工程有限公司);PowerPacTM Basic电泳仪、Mini PROTEAN3 Cell电泳槽及蛋白电泳技术平台(美国Bio-Rad公司);BioshineChemiQ4800化学发光凝胶成像自动显影仪(上海欧翔科学仪器有限公司);PK-600S水浴锅(上海精宏实验设备有限公司)。
2 方法 2.1 动物分组及给药方法购买18月龄大鼠40只,并将其随机分为衰老模型组,PNS低、中、高剂量(10、30、60 mg/kg)组,每组10只。另购买3月龄大鼠10只作为青年对照组。青年对照组、衰老模型组每天ig生理盐水,每周给药6 d,周日停药1 d,连续6个月;PNS低、中、高剂量组分别ig给予PNS 10、30、60 mg/kg至24月龄,每周给药6 d,周日停药1 d。实验前12 h禁食不禁水。
2.2 睾丸质量和指数的测定称取大鼠体质量后,处死大鼠,迅速取出睾丸组织,称取睾丸质量,计算睾丸指数(睾丸指数=睾丸质量/体质量)。
2.3 睾丸HE染色大鼠处死后,迅速取出睾丸组织,称质量后切取部分组织置于4%多聚甲醛中固定,常规脱水包埋、切片,按标准操作进行HE染色,光镜下观察睾丸组织的形态学变化。
2.4 免疫组化法检测睾丸组织γ-H2AX、ATR蛋白的表达和定位取睾丸切片置于60 ℃烘箱烘烤4 h,二甲苯与梯度乙醇脱蜡,柠檬酸修复液进行抗原修复,3%过氧化氢消除内源性过氧化酶,5% BSA封闭后一抗4 ℃孵育过夜,二抗常温孵育1 h,经显色、封片后在Olympus BX53型光学显微镜下随机观察5个视野,并在相同设置下拍照取图。
2.5 Western blotting检测γ-H2AX、Chk1、p-P53、P21蛋白的表达取50~100 mg睾丸组织于EP管中,加入1 mL PBS于冰上快速剪碎,离心弃上清后,加入适量蛋白裂解液-苯甲基磺酰氟(PMSF)-蛋白磷酸酶抑制剂(100:1:1),匀浆、离心后取上清,加入上样缓冲液,95 ℃煮沸灭活后,凝胶电泳并恒流转PVDF膜,脱脂牛奶封闭后,4 ℃孵育一抗过夜,室温孵育二抗1 h,ECL化学发光法显影。Image-Pro Plus 6.0灰度扫描、GraphPad Prism 5软件进行分析处理。
2.6 统计学分析采GraphPad Prism 5软件进行统计学分析,数据以x±s表示,各组均数之间比较采用单因素方差分析。
3 结果 3.1 PNS对自然衰老大鼠睾丸质量和睾丸指数的影响结果显示,与青年对照组相比,衰老模型组大鼠睾丸质量、睾丸指数显著降低(P<0.01),PNS能剂量依赖性增加睾丸质量及睾丸指数(P<0.05),见图 1。
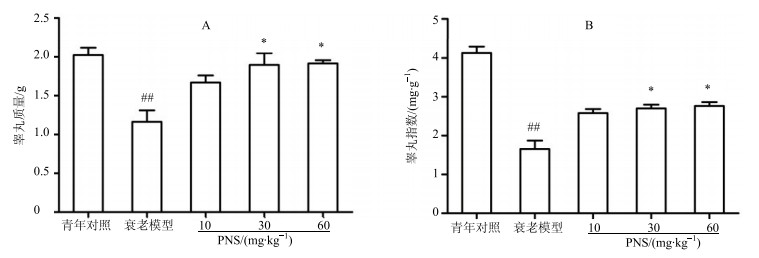
|
与青年对照组比较:##P<0.01;与衰老模型组比较:*P<0.05 ##P < 0.01 vs young control group; *P < 0.05 vs aging model group 图 1 PNS对自然衰老大鼠睾丸质量 (A) 和睾丸指数 (B) 的影响 (x±s, n=10) Fig.1 Effect of PNS on testicular weight and testis index of natural aging rats (x±s, n=10) |
3.2 PNS对自然衰老大鼠睾丸组织细胞形态学的影响
结果显示,与青年对照组比较,衰老模型组大鼠睾丸组织生精小管形态结构发生明显变化,生精细胞层数减少,排列紊乱,细胞疏松,各级生精细胞有不同程度脱落,生精小管基膜部分变得不完整。与衰老模型组比较,PNS低、中、高剂量组睾丸组织生精小管形态结构明显改善,生精细胞数目显著增加,排列整齐紧密,见图 2。
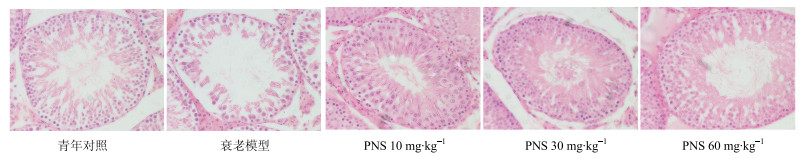
|
图 2 PNS对自然衰老大鼠睾丸组织细胞形态学的影响 Fig.2 Effect of PNS on testicular tissue morphology of natural aging rats |
3.3 PNS对自然衰老大鼠睾丸组织γ-H2AX蛋白表达的影响
γ-H2AX目前被认为是DNA损伤的生物标记物[13]。免疫组化结果表明,与青年对照组相比,衰老模型组大鼠睾丸细胞核内γ-H2AX阳性灶点数显著升高;PNS可降低衰老大鼠睾丸组织γ-H2AX阳性灶点数,见图 3。Western blotting结果显示,与青年对照组比较,衰老模型组大鼠睾丸组织γ-H2AX蛋白表达显著增加(P<0.01),表明衰老大鼠DNA损伤明显增加,PNS可显著降低γ-H2AX蛋白的表达,且具有剂量依赖性,见图 4。
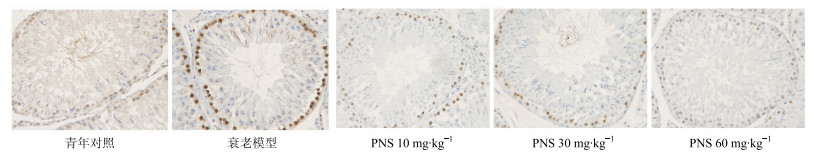
|
图 3 PNS对自然衰老大鼠睾丸组织γ-H2AX蛋白表达的影响 (免疫组化染色) Fig.3 Effect of PNS on protein expression of γ-H2AX in testicular tissue of natural aging rats (immunohistochemical staining) |
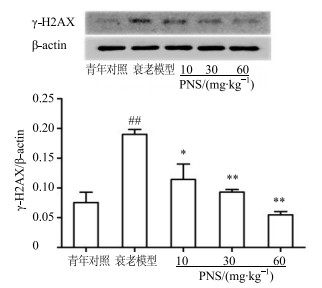
|
与青年对照组比较:##P<0.01;与衰老模型组比较:*P<0.05 **P<0.01 ##P < 0.01 vs young control group; *P < 0.05 **P < 0.01 vs aging model group 图 4 PNS对自然衰老大鼠睾丸组织γ-H2AX蛋白表达的影响 (Western blotting, x±s, n=6) Fig.4 Effect of PNS on protein expression of γ-H2AX intesticular tissue of natural aging rats (Western blotting, x±s, n=6) |
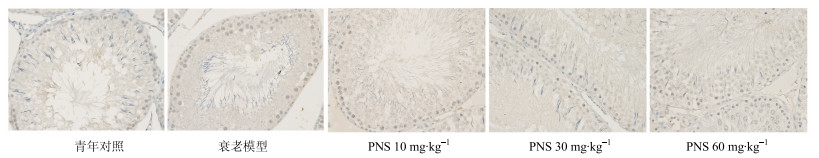
3.4 PNS对自然衰老大鼠睾丸组织ATR蛋白表达的影响
ATR是DNA损伤反应的重要感应器,免疫组化法检测PNS对自然衰老大鼠睾丸组织ATR蛋白表达的变化,结果见图 5。与青年对照组相比,衰老模型组大鼠睾丸组织ATR阳性灶点数明显升高;PNS低、中、高各剂量组均能不同程度降低衰老大鼠睾丸组织ATR阳性灶点数。
|
图 5 PNS对自然衰老大鼠睾丸组织ATR蛋白表达的影响 (免疫组化染色) Fig.5 Effect of PNS on protein expression of ATR in testicular tissue of natural aging rats (immunohistochemical staining) |
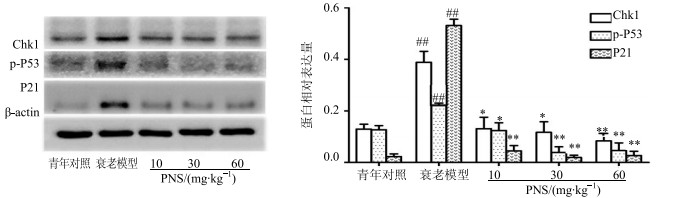
3.5 PNS对自然衰老大鼠睾丸组织Chk1、p-P53、P21蛋白表达的影响
Western blotting结果显示,与青年对照组比较,衰老模型组大鼠睾丸组织Chk1、p-P53、P21蛋白表达显著增加(P<0.01);PNS可明显降低Chk1、p-P53、P21蛋白表达量(P<0.05、0.01),见图 6。
|
与青年对照组比较:##P<0.01;与衰老模型组比较:*P<0.05 **P<0.01 ##P < 0.01 vs young control group; *P < 0.05 **P < 0.01 vs aging model group 图 6 PNS对自然衰老大鼠睾丸组织Chk1、p-P53、P21蛋白表达的影响 (x±s, n=6) Fig.6 Effect of PNS on protein expression of Chk1, p-P53, and P21 in testicular tissue of natural aging rats (x±s, n=6) |
4 讨论
衰老是机体各组织、器官功能随年龄增长而发生退行性变化的过程。本实验发现衰老模型组大鼠睾丸质量、睾丸指数明显降低,生精小管形态结构发生明显改变,生精细胞层数减少,给予PNS后,睾丸质量、睾丸指数有不同程度地增加,生精细胞数目明显增多,生精小管形态结构明显改善。提示PNS能够改善衰老所致大鼠睾丸功能减退。
DNA作为生命活动中最重要的遗传物质,在衰老、氧化应激以及多种外界因素刺激下,会不可避免地发生多种类型的DNA损伤,例如DNA链断裂等。γ-H2AX是DNA双链损伤的起始感应蛋白,也是定量检测DNA双链断裂损伤程度的重要标志蛋白[14]。Western blotting显示,衰老模型组大鼠睾丸组织γ-H2AX蛋白表达水平明显增加。免疫组化结果进一步显示,γ-H2AX主要表达于初级精母细胞核。主要原因是初级精母细胞处于减数分裂活跃期,由于染色质重组,容易受到内源性和外源性因素的影响,从而导致DNA损伤。PNS各剂量组均能不同程度降低γ-H2AX的蛋白表达以及核内阳性灶点数,提示PNS可通过减轻睾丸DNA损伤程度,从而改善衰老所致生殖功能减退。
为应对DNA损伤,机体形成了一系列的细胞应激反应,包括ATR-Chk1途径的激活等[15-17]。H2AX是组蛋白家族中的一员,DNA损伤发生后迅速被DNA损伤信号的重要感应器ATR等磷酸化,形成γ-H2AX,随后γ-H2AX可招募ATR聚集于损伤部位,进而直接激活下游P53[18]。此外,ATR也可通过激活Chk1激活下游P53信号通路[19-20]。激活后的P53介导下游靶基因或通过蛋白之间的相互作用,从而促进细胞衰老、凋亡或DNA损伤修复等一系列细胞应激反应[21]。P21是位于P53下游的关键靶基因,活化的P53在转录水平活化P21,从而使细胞滞留在S和G2/M期,导致细胞衰老或DNA损伤的修复[22]。因此,本实验采用免疫组织化学法检测了大鼠睾丸组织ATR的表达情况,发现衰老模型组大鼠睾丸组织ATR阳性灶点数显著升高,PNS可明显降低ATR的阳性灶点数。此外,Western blotting结果显示,衰老模型组Chk1、p-P53、P21蛋白表达均显著升高,PNS各剂量组均能不同程度降低Chk1、p-P53、P21蛋白的表达。以上结果表明,PNS可减轻衰老所致睾丸生殖细胞DNA损伤反应。
综上所述,PNS可减轻衰老所致大鼠睾丸生殖细胞DNA损伤,机制可能与通过调控ATR信号通路的传导及下游因子的激活有关。但是PNS延缓衰老,保护生殖功能的具体分子机制仍不够完善,有待进一步探讨。
| [1] | Zitzmann M. Effects of age on male fertility[J]. Best Pract Res Clin Endocrinol Metabol, 2013, 27(4): 617–628. DOI:10.1016/j.beem.2013.07.004 |
| [2] | 徐谊朝, 朱伟杰, 李菁, 等. 有生育需求中老年男性精子参数的评价[J]. 生殖与避孕, 2014, 34(7):599–602. |
| [3] | Jiang H, Zhu W J, Li J, et al. Quantitative histological analysis and ultrastructure of the aging human testis[J]. Int Urol Nephrol, 2014, 46(5): 879–885. DOI:10.1007/s11255-013-0610-0 |
| [4] | Paul C, Robaire B. Ageing of the male germ line[J]. Nat Rev Urol, 2013, 10(4): 227–234. DOI:10.1038/nrurol.2013.18 |
| [5] | Grégoire M C, Massonneau J, Simard O, et al. Male-driven de novo mutations in haploid germ cells[J]. Mol Human Reprod, 2013, 19(8): 495–499. DOI:10.1093/molehr/gat022 |
| [6] | Goriely A, Wilkie A M. Paternal age effect mutations and selfish spermatogonial selection:Causes and consequences for human disease[J]. Amer J Human Genet, 2012, 90(2): 175–200. DOI:10.1016/j.ajhg.2011.12.017 |
| [7] | 钟晓凤. 三七的药理作用及其临床应用研究[J]. 中医临床研究, 2015, 9(6):116–117. |
| [8] | 崔红晶, 安长新, 陈东, 等. 三七总苷对大鼠自身免疫性睾丸炎的拮抗作用[J]. 解剖学杂志, 2008, 31(1):19–21. |
| [9] | 李欢, 苟欣. 三七总皂苷的抗凋亡作用对糖尿病性勃起功能障碍大鼠勃起功能的影响[J]. 重庆医科大学学报, 2013, 38(11):1325–1330. |
| [10] | 江刘平, 焦林如. 三七总皂苷的药用生物学活性研究进展[J]. 氨基酸和生物资源, 2013, 35(3):17–21. |
| [11] | 王莹, 禇扬, 李伟, 等. 三七中皂苷成分及其药理作用的研究进展[J]. 中草药, 2015, 46(9):1381–1392. |
| [12] | 高云涛, 张文斌, 杨利荣, 等. 三七皂苷清除活性氧自由基及对DNA氧化损伤保护作用研究[J]. 中药材, 2008, 31(9):1399–1402. |
| [13] | 黄清松, 李红枝, 张咏莉, 等. 三七皂苷Rg1抗突变和抗肿瘤研究[J]. 临床和实验医学杂志, 2006, 5(8):1124–1125. |
| [14] | Sharma A, Singh K, Almasan A. Histone H2AX phosphorylation:A marker for DNA damage[J]. Methods Mol Biol, 2012, 920: 613–626. DOI:10.1007/978-1-61779-998-3 |
| [15] | Gutierrezmartinez P, Rossi D J, Beerman I. DNA damage and aging around the clock[J]. Trends Mol Med, 2016, 22(8): 635–637. DOI:10.1016/j.molmed.2016.06.006 |
| [16] | Panda S, Isbatan A, Adami G R. Modification of the ATM/ATR directed DNA damage response state with aging and long after hepatocyte senescence induction in vivo[J]. Mech Ageing Devel, 2008, 129(6): 332–340. DOI:10.1016/j.mad.2008.02.014 |
| [17] | Manic G, Obrist F, Sistigu A, et al. Trial Watch:Targeting ATM-CHK2 and ATR-CHK1 pathways for anticancer therapy[J]. Mol Cell Oncol, 2015, 2(4): e10129761–17. |
| [18] | Di-Siena S, Campolo F, Rossi P, et al. UV and genotoxic stress induce ATR relocalization in mouse spermatocytes[J]. Int J Devel Biol, 2013, 57(2/4): 281–287. |
| [19] | Shieh S Y, Ahn J, Tamai K, et al. The human homologs of checkpoint kinases Chk1 and Cds1(Chk2) phosphorylate p53 at multiple DNA damage-inducible sites[J]. Genes Devel, 2000, 14(3): 289–300. |
| [20] | Zhao T, Tang X, Umeshappa C S, et al. Simulated microgravity promotes cell apoptosis through suppressing Uev1A/TICAM/TRAF/NF-κB-regulated anti-apoptosis and p53/PCNA-and ATM/ATR-Chk1/2-controlled DNA-damage response pathways[J]. J Cell Biochem, 2016, 117(9): 2138–2148. DOI:10.1002/jcb.v117.9 |
| [21] | Zilfou J T, Lowe S W. Tumor suppressive functions of p53[J]. Cold Spring Harb Perspect Biol, 2009, 1(5): ab001883. |
| [22] | 李小曼, 徐红德, 蔺美娜, 等. DNA损伤修复反应的双刃剑效应在肿瘤与衰老发生发展中的作用[J]. 中国细胞生物学学报, 2013, 35(2):134–140. |
 2017, Vol. 48
2017, Vol. 48


