2. 甘肃步云农牧科技有限公司, 甘肃 陇南 742500
2. Gansu Buyun Farming Technology Co., Ltd., Longnan 742500, China
蓼科植物掌叶大黄Rheum palmatum L.是中药大黄的基原植物之一,主产于甘肃、青海、西藏和四川等省区,以栽培为主。其根和根茎具有泻下攻积、清热泻火、凉血解毒、逐瘀通经、利湿退黄的功效,是重要的清热泻火药,目前,国家药品标准中有800多个品种使用了大黄,是在中药组方中应用范围较大、使用频率较高的中药品种之一[1]。大黄主要含有蒽醌及其苷类成分,具有泻下、保肝、利胆、调血脂、抗肿瘤、抗病毒、抗炎等功效[2-4]。掌叶大黄除根及根茎为传统药用部位外,叶片、叶柄等非药用部位也有入药习惯。藏医典《四部医典》和《妙音本草》中记载,我国四川、西藏、甘肃、青海地区的农民,在以大黄的根部作药材的同时,也使用大黄属植物地上部分的叶柄和幼嫩的叶片解渴、除翳等[5-6]。
而在传统产地加工过程中,会产生大量大黄叶柄、叶片、根皮、支根等废弃物,造成大量的药用资源的浪费。因此,对掌叶大黄非药用部位的研究,对节约资源、增加收入和综合利用资源有着重要的意义。本实验对掌叶大黄不同部位(主根、根头、支根、根皮、叶柄、叶片)中蒽醌类、可溶性多糖类、总纤维素和无机元素成分进行分析评价,以期为掌叶大黄新资源的开发利用提供参考。
1 仪器与材料 1.1 仪器Waters-2695型液相色谱仪(四元泵、在线脱气及自动进样系统、2996型二极管阵列检测器);UV-2000紫外-可见分光光度计(北京莱伯泰科仪器有限公司);Sartorius BT125D电子分析天平(德国塞利多斯公司);EPED超纯水系统(南京易普达易科技发展有限公司);KQ-250E型超声波清洗器(昆山禾创超声仪器有限公司);FIWE 3/6纤维素测定仪(北京盈盛恒泰科技有限公司);Anke GL-16GⅡ型离心机(上海安亭科学仪器厂),马福炉(上海洪纪仪器设备公司);Milestone Ethos T微波消解系统(意大利Milestone公司);Optima 2100DV型电感耦合等离子发射光谱仪(美国Perkin Elmer公司)。
1.2 试剂芦荟大黄素对照品(批号LDHS20140914)、大黄酸对照品(批号DHSA20141023)、大黄素对照品(批号DHS20140815)、大黄酚对照品(批号DHF20140721)、大黄素甲醚对照品(批号DHJM20140926),购自南京春秋生物制品公司,质量分数均大于98%。葡萄糖对照品(批号SZBD1680V)购自Sigma公司,葡萄糖醛酸对照品(批号648-200001),购自中国食品药品检定研究院。甲醇(色谱纯),购自江苏汉邦科技发展有限公司,其他试剂均为分析纯。
1.3 材料新鲜掌叶大黄全株6批采自甘肃步云农牧科技有限责任公司大黄种植基地(批号DH20140901~DH20140906),经南京中医药大学段金廒教授鉴定为掌叶大黄Rheum palmatum L.栽培品。采收时间为2014年9月。每批次分别分取主根、根头、支根、根皮、叶柄、叶片6个不同部位,40 ℃鼓风干燥后,粉碎成粗粉,置干燥器中备用。
2 方法 2.1 蒽醌类成分分析方法 2.1.1 供试品溶液制备精密称取掌叶大黄主根、根头、支根、根皮、叶柄、叶片粗粉各1 g,置于具塞锥形瓶中,精密加入70%甲醇40 mL,静置30 min,称定质量,室温超声提取1 h,放冷,称质量,用70%甲醇补充损失质量,摇匀,滤过,取续滤液,用0.22 μm微孔滤膜滤过,即得供试品溶液。
2.1.2 对照品溶液制备分别精密称取大黄酸、大黄素甲醚、大黄酚、大黄素、芦荟大黄素对照品适量,加甲醇溶解定容,配成质量浓度分别为82.0、85.0、72.0、73.0、106.0 μg/mL的混合对照品溶液。
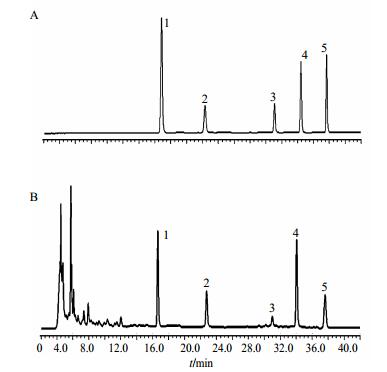
2.1.3 色谱条件汉邦Phecda C18色谱柱(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.05%磷酸水(B),梯度洗脱:0~10 min,10%~30% A;10~20 min,30%~50% A;20~30 min,50%~70% A;30~40 min,70%~90% A;40~50 min,90%~100% A。体积流量1 mL/min,检测波长254 nm,柱温40 ℃,进样量10 μL。典型样品色谱图见图 1。
|
1-芦荟大黄素2-大黄酸3-大黄素4-大黄酚5-大黄素甲醚 1-aloe emodin 2-rhein 3-emodin 4-chrysophanol 5-physcion 图 1 混合对照品(A)和掌叶大黄主根(B)的HPLC-PDA Fig.1 HPLC-PDA of the mixed reference (A) and taproot (B) |
2.1.4 标准曲线的建立
分别精密吸取“2.1.2”项下制备的对照品溶液1、2、5、8、10、15 μL,注入液相色谱仪中,以对照品质量浓度为横坐标(X),峰面积的积分值为纵坐标(Y),绘制标准曲线,得回归方程(表 1)。最低检测限(LOD)与最低定量限(LOQ)分别在信噪比(S/N)为3和10时测定(表 1)。
|
|
表 1 回归方程及LOD和LOQ结果 Table 1 Regression equations and results of LOD and LOQ |
2.1.5 精密度试验
取混合对照品溶液,按上述色谱条件重复进样6次,测定峰面积的积分值,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积的RSD依次为0.2%、0.3%、0.5%、0.2%和1.2%。
2.1.6 重复性试验精密称取掌叶大黄(DH20140901)主根粗粉6份,按照前述方法制备供试品溶液,依法进样,分别记录芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的峰面积积分值,计算其质量分数RSD依次为0.8%、0.9%、1.2%、1.3%和1.9%。
2.1.7 稳定性试验精密称取掌叶大黄(DH20140901)主根粗粉1份,按照前述方法制备供试品溶液,12 h内每隔2 h进样1次,记录峰面积,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积的RSD依次为0. 8%、0.8%、0.9%、1.0%和1.4%,结果证明供试品溶液在12 h之内稳定。
2.1.8 加样回收率试验精密称取掌叶大黄(DH20140901)主根粗粉6份,分别加入与样品中各成分量等量的对照品,依法制备供试品溶液并进样分析,计算回收率。结果芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚平均回收率分别为104.3%、98.1%、98.3%、101.5%和103.1%,RSD为2.3%、2. 6%、1.9%、1.6%和2.0%。
2.1.9 样品测定结果掌叶大黄主根、根头、支根、根皮、叶柄、叶片中蒽醌类成分量分析结果见表 2。掌叶大黄主根中含有的芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚依次为3.22~4.33、0.77~1.36、0.27~0.39、2.85~3.70、1.88~2.44 mg/g;根头中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚依次为1.33~2.32、2.46~2.52、0.28~0.34、2.78~3.01、1.82~2.01 mg/g;支根中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚依次为3.21~3.68、1.16~1.46、0.30~0.42、4.02~4.81、2.48~3.02 mg/g;根皮中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚依次为3.22~3.76、1.02~1.21、0.31~0.67、4.05~4.72、3.61~4.46 mg/g;叶片中芦荟大黄素、大黄酸、大黄素量依次为0.56~1.07、0.45~0.69、1.41~1.91 mg/g。叶柄中检测出大黄素,但远低于定量限。
|
|
表 2 掌叶大黄不同部位中的蒽醌类成分量 Table 2 Chemical composition of anthraquinones compounds in different parts of R. palmatum |
2.2 可溶性多糖类成分分析方法 2.2.1 供试品溶液的制备
精密称定掌叶大黄主根、叶柄、叶片样品粗粉各1 g,置于100 mL具塞锥形瓶中,加入50 mL的80%无水乙醇,室温静置1 h后超声提取30 min,在75 ℃水浴2 h后,趁热抽滤,洗涤残渣,烘干,加入40 mL蒸馏水,称恒定质量,100 ℃沸水浴1 h,取出放冷,加蒸馏水补足失质量,摇匀,离心,取上清液,微孔滤膜滤过,取续滤液,即得。用于中性和酸性多糖的测定。
2.2.2 对照品溶液的制备精密称取经105 ℃干燥至恒定质量的无水葡萄糖对照品9.91 mg,置100 mL量瓶中,加蒸馏水定容至刻度,摇匀,即得99.1 μg/mL的葡萄糖对照品储备液。
精密称取经105 ℃干燥至恒定质量的葡萄糖醛酸对照品9.67 mg,置100 mL量瓶中,加蒸馏水定容至刻度,摇匀,即得96.7 μg/mL的葡萄糖醛酸对照品储备液。
2.2.3 标准曲线的绘制参考文献方法[7],分别绘制葡萄糖和葡萄糖醛酸标准曲线,以吸光度为纵坐标(Y),以对照品溶液浓度为横坐标(X)进行线性回归。葡萄糖对照品回归方程为Y=2.96×10-3 X+3.14×10-3,r2=0.995 3,线性范围为12.6~126 μg/mL;葡萄糖醛酸对照品回归方程为Y=7.94×10-3 X-0.019 2,r2=0.993 4,线性范围为11.2~112.0 μg/mL。
2.2.4 可溶性多糖类成分分析结果掌叶大黄主根、叶柄、叶片中可溶性多糖类成分分析结果见表 3。主根中含可溶性多糖量范围9.76%~10.42%,叶柄中量范围5.76%~7.63%,叶片中质量分数3.50%~5.72%。
|
|
表 3 掌叶大黄不同部位中的可溶性多糖类化学成分量 Table 3 Chemical constituents of soluble polysaccharide in different parts of R. palmatum |
2.3 总纤维素类成分分析方法 2.3.1 供试品的制备
精密称取干燥至恒定质量的掌叶大黄叶柄、叶片粗粉各2 g,用乙醚将试样在冷却器中脱脂,脱脂后挥去乙醚,干燥,即得供试品。
2.3.2 试剂配制1.25%的硫酸-水溶液,1.25%的氢氧化钾-水溶液,正辛醇作为消泡剂,无水丙酮作为清洗剂。
2.3.3 样品测定采用weende法测定,根据公式计算总粗纤维量。
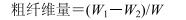
|
其中W1是粗纤维含灰分的质量,W2是灰分的质量,W是样品质量
2.3.4 总纤维素量分析结果掌叶大黄叶柄、叶片中总纤维素量分析结果见表 4。叶柄、叶片中总纤维素平均量分别为15.54%和10.20%。
|
|
表 4 掌叶大黄叶柄、叶片中的总纤维素量 Table 4 Total cellulose contents in petioles and leaves of R. palmatum |
2.4 无机元素测定方法 2.4.1 供试品的制备
取掌叶大黄(DH20140901)主根、叶柄和叶片3个部位干燥粉末样品各0.5 g,采用高压消解法消解样品:样品置于聚四氟乙烯消解罐中加硝酸5 mL过夜,加3 mL双氧水,拧紧密封盖,置于恒温烘箱120 ℃加热3~4 h,直至消解液澄清透明或略带黄色,冷却后定容至50 mL,滤过待测。其中测K、Mg和Ca元素时均稀释50倍后测定。
2.4.2 测定方法参照文献方法[8],使用ICP-AES测定样品中Cu、Zn、Ni、Cd、Na、Fe、Mn、K、Mg、Ca、B、Al、Ti、Cr、Co、As、Se、Sr、Ba、Pb、Bi、Hg 22种元素。将硝化液进样,每份样品平行测定3次,取平均值。
2.5 元素分析通过ICP-AES测定掌叶大黄各部位中22种元素的量,从表 5可以得出,掌叶大黄各部位中含有较丰富的元素,种类较多。掌叶大黄叶片中Ca的量高达88.53 mg/g,K、Mg量也较高,依次为32.42、12.93 mg/g;叶片中Al、Fe量分别为1.22、1.17 mg/g,高于主根(0.91、0.64 mg/g)和叶柄(0.47、0.52 mg/g)。叶柄中Ca、K量略低于叶片,分别为80.60、28.73 mg/g,高于主根(21.08、14.09 mg/g);Na量为2.66 mg/g,远高于主根(0.26 mg/g)和叶片(0.57 mg/g)。
|
|
表 5 元素种类及其质量分数 Table 5 Element types and mass fraction |
3 讨论
资源的利用价值在于其可利用物质的多用性和多宜性特点[9-10]。实验结果表明,掌叶大黄中各部位中蒽醌类、纤维素和多糖类成分分布差异较大,蒽醌类成分在根中的种类和量总体高于叶柄和叶片,符合传统入药部位的认识。在产地加工过程中,会产生大量的大黄叶柄、叶片,根皮、支根等废弃物,一方面是对药用资源的浪费,另一方面也增加了环境负担。
该类资源性成分在掌叶大黄叶柄、叶片中也有分布,且叶片中大黄素量为根中的5倍。此外,叶片还含有芦荟大黄素和大黄酸,量约为根中的1/5和1/2。大黄素、芦荟大黄素、大黄酸是中药大黄的主要有效单体成分,根据文献报道[11],大黄素具有抗炎活性、保护肝肾等作用,而芦荟大黄素中蒽醌环和2个酚羟基决定其具有清除氧自由基和抗肿瘤等多种生物活性[12],大黄酸和大黄素具有广泛而相似的药理活性,如抗肿瘤、抗炎以及调节肾功能[13-14]等作用。掌叶大黄的叶片生物量约占总资源量的1/2,可作为提取大黄素、芦荟大黄素、大黄酸的资源部位开发利用。
本研究中,掌叶大黄叶柄、叶片中还含有一定量的纤维素和可溶性多糖类成分,有报道[15-19],大黄多糖具有降血糖、抗衰老、抗氧化、抗肿瘤和增强免疫的功能。国外18世纪就有食用大黄叶柄的记载。我国华北地区的波叶大黄、华北大黄属于可食用大黄,叶柄粗壮,撕去外皮可生吃,或作蔬菜食用,或作食品加工的原料。掌叶大黄各部位中含有种类丰富的元素,Ca、K、Mg、Al、Fe在叶片中有较多分布,叶柄中Ca、K、Na量较高,因此在开发掌叶大黄叶柄、叶片保健产品时,应注意限定每日服用量,保证人体的安全。
掌叶大黄产地初加工废弃物和非药用部位资源丰富,目前尚未得到充分利用,本研究结果为该类生物资源的有效利用提供了一定的参考,对提升掌叶大黄利用价值、节约循环使用有限的生物资源具有重要的经济效益和生态效益。
| [1] | 王勤, 邸多隆, 蒋生祥. 大黄类药物分析方法研究概况[J]. 中成药, 2007, 39(8):1199–1202. |
| [2] | 南海江, 许旭东, 陈士林, 等. 大黄属植物研究进展[J]. 天然产物研究与开发, 2009, 21(4):690–701. |
| [3] | 毛春芳, 施忠, 罗琳, 等. HPLC法同时测定大黄中芦荟大黄素等11种成分的量[J]. 中草药, 2014, 45(16):2400–2403. |
| [4] | Zheng Q X, Wu H F, Guo J, et al. Review of rhubarbs:chemistry and pharmacology[J]. Chin Herb Med, 2013, 5(1): 9–32. |
| [5] | 黄剑, 邓良基, 范巧佳, 等. 掌叶大黄叶资源的开发与利用[J]. 中国资源综合利用, 2004, 23(7):15–17. |
| [6] | 熊辉岩, 张晓峰, 谭大风, 等. 大黄属三种植物不同部分提取物清除羟基自由基的体外实验研究[J]. 食品科学, 2003, 24(1):128–130. |
| [7] | 吕洁丽, 陈红丽, 段金廒, 等. 不同加工方法对当归多糖的影响[J]. 中国中药杂志, 2011, 36(7):846–849. |
| [8] | 任浩, 宿树兰, 管汉亮, 等. 银杏花粉中核苷、氨基酸及无机元素的成分分析[J]. 中草药, 2014, 45(19):2839–2843. |
| [9] | 段金廒, 宿树兰, 钱大玮, 等. 中药资源化学研究思路方法与进展[J]. 中国天然药物, 2009, 7(5):333–340. |
| [10] | 段金廒. 中药资源化学研究技术体系的建立及其应用[J]. 中国药科大学学报, 2012, 43(4):289–292. |
| [11] | Chang C H, Lin C C, Yang J J, et al. Anti-inflammatory effects of emodin from Ventilago leiocarpa[J]. Am J Chin Med, 1996, 24(2): 139–142. DOI:10.1142/S0192415X96000189 |
| [12] | Chen R, Zhang J M, Hu Y Y, et al. Potential antineoplastic effects of aloe-emodin:A comprehensive review[J]. Am J Chin Med, 2014, 42: 275–288. DOI:10.1142/S0192415X14500189 |
| [13] | 林文琴, 杨潇, 荆河, 等. 大黄素对肝移植排斥反应相关细胞因子的影响[J]. 中草药, 2008, 39(12):1853–1855. |
| [14] | 笪红远, 曾文, 江振洲, 等. 大黄酸对小鼠淋巴瘤L5178Y细胞TK基因的致突变作用[J]. 中草药, 2008, 39(12):1858–1860. |
| [15] | 蒋滢, 马建民, 徐颖, 等. 大黄多糖分离纯化及其功能的研究(Ⅰ)[J]. 药物生物技术, 2002, 9(6):330–333. |
| [16] | 苗明三, 苗艳艳. 大黄多糖对衰老模型小鼠胸腺、脾脏影响的病理观察[J]. 中华实用中西医杂志, 2004, 4(17):146–147. |
| [17] | 姚广涛, 张冰冰, 何丽君, 等. 掌叶大黄多糖抗氧化作用的实验研究[J]. 中医药学刊, 2004, 22(7):1295–1311. |
| [18] | 李会会, 胡娜平, 刘美佑, 等. 大黄酸和羟基红花黄色素A单用及配伍对慢性肾病的保护作用研究[J]. 药物评价研究, 2015, 38(6):607–611. |
| [19] | 李道中. 掌叶大黄多糖对高血糖小鼠及正常小鼠的降糖作用[J]. 中国医院药学杂志, 2007, 27(3):309–310. |
 2017, Vol. 48
2017, Vol. 48


