2. 山东中医药大学第一临床学院, 山东 济南 250011
2. Shandong University of Traditional Chinese Medicine, Jinan 250011, China
肥胖性高血压,即肥胖相关性高血压(obesity-related hypertension)是指由肥胖的各种因素导致的高血压。现代研究显示:身体脂肪含量与血压呈正相关,体质量指数(BMI)每增加3 kg/m2,4年内发生高血压的风险增加50%~57%[1]。肥胖的本质是摄食/能耗失衡,脂肪组织分泌的瘦素(leptin)在肥胖性高血压中发挥重要的作用。生理情况下,瘦素具有抑制摄食、增加能量消耗、抑制脂肪合成、促进脂肪分解的作用;肥胖时,血清瘦素水平升高,机体对瘦素的摄食等代谢作用产生了抵抗,而对瘦素引起交感活性增强等作用仍然保留,即选择性瘦素抵抗(leptin resistance),这是瘦素升高血压的重要机制之一[2-3]。因此,消除选择性瘦素抵抗,是治疗肥胖性高血压的重要治疗靶点之一。目前现代医药治疗作用有限,中医药治疗有广泛的开发前景。刺蒺藜Tribul sterrestris L.为蒺藜科蒺藜属植物,其果实为传统中药,具有散风、明目、下气行血、补肾益精之功效[4],现代药理研究表明刺蒺藜具有降压作用[5-6]。因此,本研究以肾脏为靶器官,JAK2/STAT3为靶点通路,研究刺蒺藜治疗肥胖性高血压的作用及其机制,为肥胖性高血压的中医药治疗及对刺蒺藜这味“古药”的应用,提供新的思路和坚实的实验数据支撑。
1 材料 1.1 药品与试剂刺蒺藜超微粉(由山东中医药大学附属医院中药实验室制备);替米沙坦(德国勃林格殷格药业有限公司生产,批号H20090416);SYBR Green I Master PCR试剂盒(10559520),购于美国罗氏公司;PCR扩增试剂盒、反转录试剂盒,购于大连Takara生物工程有限公司;一抗稀释液、过硫酸胺(AP)、蛋白上样缓冲液、蛋白裂解液(RIPA)、ECL化学发光试剂盒(P0018),购于上海碧云天生物技术有限公司;PVDF膜,购于美国Millipore公司;血管紧张素Ⅱ(Ang Ⅱ)ELISA检测试剂盒(A25364-09)、瘦素(Lep)ELISA检测试剂盒(L36247-09)、β2微球蛋白(β2-MG)检测试剂盒(B52136-09),上海博蕴生物科技有限公司;免疫组化染色试剂盒(SP-0023),购于北京博奥森公司。
1.2 动物与饲料SPF级8周龄雄性Wistar大鼠70只,体质量(180±15)g,济宁鲁抗集团提供,动物合格证scxk(鲁)2013-0001;动物房光照时间12 h,温度在20~24 ℃,湿度60%。
基础饲料配方:玉米30%、小麦31%、豆粕20.8%、麦麸10%、鱼粉6%、酵母粉1%、骨粉1%、盐0.02%、多维素0.02%、鱼肝油0.01%。高脂高营养饲料配方:普通饲料60%、猪油12%、蔗糖5%、奶粉5%、花生粉5%、鸡蛋10%、麻油1%、食盐2%,自购原材料,由济宁鲁抗集团加工制作[7]。
1.3 仪器自动脱水机(TP1020)、石蜡包埋机(EG1150H)、轮旋式切片机(LEICA RM2016),德国LEICA公司;全自动病理组织烘片仪(PHY-Ⅲ),常州中威电子仪器有限公司;电热恒温干燥箱(GZX-DH, 400-S-Ⅱ),上海跃进医疗仪器厂;ST8型低速自动平衡离心机,美国Thermo Scientific公司;5424R型高速冷冻离心机,德国Eppendorf公司;微量移液器,美国Thermo Scientific公司;BFM-YT 6B贝利微粉机,济南贝利粉技术工程有限公司。
2 方法 2.1 动物模型的制备、分组与给药Wistar大鼠适应性喂养1周后,完全随机单因子设计法分为对照组(n=10)和高脂饲料组(n=60)。对照组喂以常规基础饲料,高脂饲料组给予高脂饮食25周,从中选取体质量、血压均超过对照组平均值25%的大鼠作为肥胖性高血压大鼠模型,高脂饲料组大鼠共24只纳入实验。其余淘汰大鼠过量麻醉处死。成模大鼠随机分为3组:模型组、刺蒺藜组和替米沙坦组,每组8只大鼠。自26周开始各组大鼠ig给予相应药物干预12周。干预方法:根据课题组前期预试验[8],刺蒺藜超微粉的最佳剂量为生药17.2 g/kg,每日给药1次,因本研究重在观察刺蒺藜治疗肥胖性高血压的机制,故本研究仅设置最佳剂量组,以替米沙坦作为阳性对照药物。替米沙坦组大鼠,给予溶解于生理盐水中的替米沙坦。对照组与模型组给予等剂量生理盐水,每日1次。3组成模大鼠,给药期间继续给予高脂饮食;对照组大鼠给予普通饲料。
药物剂量选择参考文献报道[9],按体质量折算给药等效剂量。大鼠的替米沙坦临床等效剂量为3.4 mg/kg。2种药物均溶于适量的生理盐水。对照组给以相同容积的生理盐水,为每天2 mL/只。
2.2 标本收集与指标测定观察各组大鼠一般状况,监测血压、体质量。实验末,3%戊巴比妥钠(30 mg/kg)ip麻醉大鼠,下腔静脉取血,分离血清,进行血脂测定(血脂测定委托山东中医药大学附属医院检验科检测),应用酶联免疫法(ELISA)检测大鼠血清中Lep、Ang Ⅱ及β2-MG水平。取左肾组织、脂肪组织,保存于4%多聚甲醛液中,用于常规病理观察,右肾放入-70 ℃冰箱保存进行实时荧光定量PCR(qRT-PCR)和Western blotting检测。
2.3 肾组织主动脉病理检查实验末,将肾组织及脂肪组织,于4%多聚甲醛固定,石蜡包埋切片,切片厚度4 μm,苏木素-伊红(HE)染色,脱水,透明,中性树胶封片,普通光学显微镜下观察肾脏组织的形态学改变。
2.4 免疫组织化学法观察Lep受体(LepR)的表达左肾石蜡包埋,切片厚度4 μm,常规脱蜡,3%的H2O2室温10 min消除内源性过氧化物酶,5% BSA室温封闭30 min,滴加兔抗大鼠AT1R和一抗(1:200倍稀释),湿盒内4 ℃孵育过夜,PBS洗5 min×5次,滴加羊抗兔IgG二抗,室温孵育60 min,PBS洗5 min×5次,滴加SABC,室温30 min,PBS漂洗,DAB显色,镜下控制显色时间,苏木素复染,脱水透明中性树胶封片。PBS代替一抗作为阴性对照,以棕黄色颗粒沉积者判定为阳性。
2.5 qRT-PCR检测建立20 μL PCR反应体系:2×Master Mix 10.0 μL、水6.0 μL、引物2.0 μL、cDNA 2.0 μL。qRT-PCR反应条件:95 ℃预变性5 s;95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸10 s,扩增45个循环;95 ℃变性5 s,65 ℃延伸60 s,97 ℃酶瞬间灭活;40 ℃冷却10 s。数据采用2-ΔΔCt法分析,通过2-ΔΔCt直接计算出模型组与对照组间对应基因的表达差异。引物序列见表 1。
|
|
表 1 引物序列 Table 1 Sequences of primer |
2.6 Western blotting检测
右肾以PIPA裂解液提取组织蛋白。12% SDS-PAGE电泳,样品上样量50 μg,电转印至PVDF膜,5%脱脂奶的PBS-T室温封闭1 h。弃封闭液,不洗,加入适当稀释度的相应一抗(兔抗大鼠AT1、兔抗大鼠TGF-β1,均1:300稀释),以β-actin为内参,4 ℃孵育过夜。次日1×PBS-T洗涤5 min×5次,加入山羊抗兔IgG二抗(1:20 000)室温孵育1 h,1×PBS-T洗涤5 min×5次。ECL显色,Fluor Chem Q下曝光,条带进行半定量分析。
2.7 统计学方法釆用SPSS 19.0软件进行统计分析,计量结果以x±s表示。两组比较采用t检验;多组比较釆用单因素方差分析(One-way ANOVA)以及LSD或S-N-K法,如果方差不齐,则用Games-Howell分析。
3 结果 3.1 刺蒺藜干预后大鼠血压及体质量变化 3.1.1 各组大鼠体质量的变化每2周记录体质量及血压数据,对照组大鼠体质量在达到650~700 g后维持稳定、不再增长。与模型组比较,替米沙坦组及刺蒺藜组大鼠,体质量均有所下降,尤其在用药前2周时下降显著(P < 0.05);第12周末,与替米沙坦组比较,刺蒺藜组大鼠体质量下降更为显著(P < 0.05)。结果见表 2。
|
|
表 2 各组大鼠体质量变化(x±s) Table 2 Changes of body weight of rats in each group (x±s) |
3.1.2 各组大鼠血压变化
给药干预后各组大鼠血压比较见表 3。与对照组相比,模型组收缩压与舒张压一直维持在较高的水平(P < 0.05);替米沙坦组0~4周血压轻度下降,4~6周时血压显著下降,6~8周平稳下降,第10周时血压逐渐稳定,从第4周开始,收缩压与舒张压较模型组相比有统计学意义(P < 0.05);用药后,刺蒺藜组大鼠血压下降幅度较小,呈现持续缓慢降低态势,第6周开始,与模型组大鼠比较,收缩压、舒张压下降有统计学意义(P < 0.05);刺蒺藜组与替米沙坦组大鼠比较血压下降幅度小,实验结束时,2组血压有差异(P < 0.05)。替米沙坦组与对照组比较,大鼠收缩压、舒张压均无统计学差异(P > 0.05)。
|
|
表 3 各组大鼠收缩压和舒张压变化(x±s) Table 3 Changes of blood pressure of rats in each group (x±s) |
3.2 刺蒺藜干预后血脂水平变化
实验末,模型组大鼠血清TC、TG、LDL等水平明显升高,HDL水平无明显差异;药物干预后,与模型组大鼠比较,刺蒺藜组与替米沙坦组大鼠血清TC、TG、LDL均有不同程度降低(P < 0.05),且刺蒺藜组比替米沙坦组大鼠血脂降低更明显(P < 0.05)。见表 4。
|
|
表 4 各组大鼠血脂变化(x±s) Table 4 Changes of blood pressure of rats in each group (x±s) |
3.3 干预后大鼠血清学指标变化
实验末,与对照组比较,模型组大鼠血清Ang Ⅱ、Lep及β2-MG均升高(P < 0.05);与模型组比较,刺蒺藜组与替米沙坦组大鼠血清Ang Ⅱ、Lep及β2-MG均降低(P < 0.05);替米沙坦组大鼠AngⅡ降低更显著(P < 0.05)。见表 5。
|
|
表 5 各组大鼠血清Ang Ⅱ、Lep及β2-MG变化(x±s) Table 5 Changes of Ang Ⅱ, Lep, and β2-MG in serum of rats in each group (x±s) |
3.4 干预后大鼠肾脏及血管形态学变化 3.4.1 大鼠肾脏病理变化
模型组大鼠肾脏部分肾小球高度扩张,肾小球毛细血管扩张,球囊间隙增宽,个别肾小球变性坏死萎缩,部分肾小管扩张,动脉血管内皮增生、玻璃样变和空泡变性,管壁内蛋白分泌(蛋白管型)。与模型组大鼠比较,替米沙坦组与刺蒺藜组大鼠肾脏肾小球变性明显减轻,血管内皮增生减轻。见图 1。
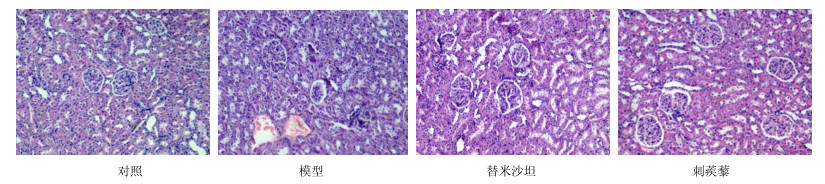
|
图 1 各组大鼠肾脏HE染色结果 Fig.1 HE staining results of kidney of rats in each group |
3.4.2 大鼠脂肪病理变化
与对照组相比,模型组大鼠脂肪细胞明显变大,脂肪组织间隙可见有炎性细胞浸润,刺蒺藜组与替米沙坦组大鼠脂肪细胞与模型组比较脂肪细胞变小,且刺蒺藜组大鼠更为显著。见图 2。
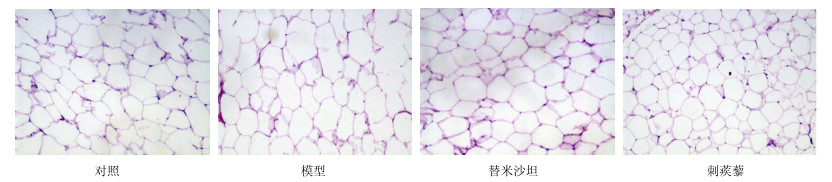
|
图 2 各组大鼠脂肪HE染色结果 Fig.2 HE staining results of lipid of rats in each group |
3.5 免疫组织化学法测定肾脏AT1、LepR蛋白分布
对照组大鼠肾脏AT1蛋白分布集中在血管周围,与对照组大鼠相比,模型组大鼠AT1蛋白表达显著增加(P < 0.05);刺蒺藜组与替米沙坦组大鼠肾脏AT1蛋白表达较模型组下降(P < 0.05)。大鼠LepR蛋白分布在肾组织细胞中;与对照组大鼠相比,模型组大鼠LepR蛋白表达增加显著(P < 0.05);刺蒺藜组与替米沙坦组大鼠肾脏LepR蛋白表达较模型组下降(P < 0.05)。见表 6。
|
|
表 6 各组大鼠肾脏AT1、LepR蛋白定量(x±s) Table 6 AT1 and LepR protein in kidney of rats in each group (x±s) |
3.6 大鼠肾脏AT1、JAK2、STAT3和LepR的mRNA的表达
与对照组比较,模型组大鼠肾脏AT1、JAK2、STAT3、LepR的mRNA表达增加(P < 0.05),与模型组比较,刺蒺藜组AT1、JAK2、STAT3及LepR的mRNA表达减少(P < 0.05)。见表 7。
|
|
表 7 各组大鼠肾脏AT1、LepR、JAK2及STAT3基因表达(x±s) Table 7 Gene expression of AT1, LepR, JAK2, and STAT3 in kidney of rats in each group (x±s) |
3.7 大鼠肾脏JAK2、SATAT3的蛋白表达
与对照组比较,模型组大鼠肾脏JAK2和蛋白表达增加,与模型组比较,刺蒺藜组大鼠肾脏JAK2和蛋白表达降低,见图 3。
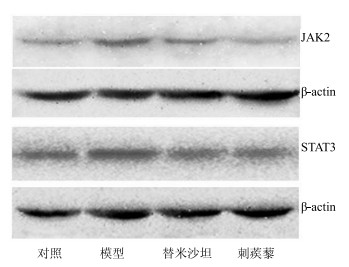
|
图 3 各组大鼠肾脏JAK2和STAT3蛋白表达 Fig.3 Protein expression of JAK2 and STAT3 in kidney of rats in each group |
4 讨论
瘦素在肥胖性高血压发病机制中起重要作用,瘦素是由肥胖基因编码的蛋白质,主要由白色脂肪细胞分泌和产生[10],瘦素有调节能量代谢,糖代谢,促进生长发育,参与免疫/炎症反应等多种生物学效应[11]。瘦素合成的多少主要取决于脂肪细胞体积的大小,当脂肪细胞体积减小时,瘦素的合成和分泌亦减少[12]。LepR分布广泛,主要于脑、心、肾脏等组织中表达,瘦素与瘦素受体结合后引发细胞内信号转导机制非常复杂,其中JAK/STAT通路是主要途径,在瘦素调整能量代谢方面不可或缺[13]。
肥胖患者体内的瘦素水平升高,下丘脑中瘦素的代谢效应(降低食欲,减轻体质量)受到抵抗,而其对于心血管、肾脏等外周组织器官的效应得以保留,即选择性瘦素抵抗,这是肥胖引起高血压的重要机制之一[14]。研究显示,瘦素水平与AngⅡ具有显著相关性。邱宁岩等[15]检测了91名高血压患者及67名血压正常者的血清瘦素水平、肾素活性(PRA)及AngⅡ,发现高血压组患者血清瘦素与BMI、PRA、AngⅡ和收缩压呈正相关。说明瘦素可以通过激活RAAS系统升高血压。
因为肥胖性高血压复杂的病理机制及现代药物治疗的单一性,针对本病的治疗现代医学并无“指南”可循。而中医中药可以发挥多靶点多途径的治疗优势,并借鉴前人研究成果,积累了丰富的经验,如:叶伊琳等[16]用肉桂通过下调脂肪组织的Toll样受体表达来治疗肥胖性高血压大鼠。
杨传华教授根据近三十年的的临床、科研经验,针对肥胖性高血压的治疗,提出“痰湿壅盛为外在表现,肝失疏泄为加剧因素,肾虚失调为内在原因”的病机本质[17],选取刺蒺藜作为治疗本病的要药,临床上取得良好效果。刺蒺藜是一味传统中药,可以平肝补肾,祛风明目。《本草纲目》曰:蒺藜味苦性温,其性宣通,利肝肾。深入挖掘本草学文献,还可以发现刺蒺藜具有轻身减肥、化湿祛痰、活血化瘀等作用。现代药理研究也表明,刺蒺藜具有降压、利尿,抗氧化强身健体等功效。
实验末,与对照组比较,模型组大鼠体态肥胖,血脂水平升高,血压升高,大鼠腹部脂肪细胞增大,血清Lep、AngⅡ水平明显升高(P < 0.05);肾脏LepR、AT1、JAK2和STAT3的mRNA和蛋白表达明显上调;说明高脂饲料饮食诱导的肥胖模型大鼠存在选择性瘦素抵抗及RAAS过度激活,符合肥胖性高血压的基本病理机制。本研究显示,肥胖性高血压大鼠血清升高的Lep与肾脏升高的LepR结合,通过JAK2/STAT3通路,引起瘦素外周的作用增强。同时说明肥胖性高血压大鼠RAAS系统的过度激活与肾脏局部RAS激活有关。
大鼠血清中β2-MG升高,β2-MG是体内有核细胞产生的一种小分子球蛋白,是反应早期高血压肾功能损伤的良好指标[18],肾脏病理亦显示肥胖性高血压大鼠出现肾脏损伤。
刺蒺藜干预后,大鼠体质量减轻,血压降低,血脂水平降低,血清中Lep、AngⅡ及β2-MG降低(P < 0.05);大鼠肾脏的LepR、AT1、JAK2和STAT3的mRNA及蛋白表达降低(P < 0.05),说明刺蒺藜可以减少肾脏LepR的表达,抑制JAK2/STAT3通路反应,降低肾脏对循环瘦素的敏感性,减轻选择性瘦素抵抗,降低血压,保护肾脏。同时,本研究结果为刺蒺藜的这一味“古老”的中药理论研究及临床应用提供了“新的”方法与思路。
| [1] | Yach D, Stuckler D, Brownell K D. Epidemiologic and economic consequences of the global epidemics of obesity and diabetes[J]. Nat Med, 2006, 12(1): 62–66. DOI:10.1038/nm0106-62 |
| [2] | Zhang Y, Proenca R, Maffei M, et al. Positional cloning of the mouse obese gene and its human homologue[J]. Nature, 1994, 372(6505): 425–432. DOI:10.1038/372425a0 |
| [3] | Hallas J L, Gajiwala K S, Maffei M, et al. Weight-reducing effects of the plasma protein encoded by the obese gene[J]. Science, 1995, 269(5233): 543–546. |
| [4] | 金京玲, 金哲洙, 任东鲜, 等. 刺蒺藜果实中两种甾体皂苷的分离与鉴定[J]. 中草药, 2000, 31(2):90–91. |
| [5] | 陈永志, 姜月华, 孟宪卿, 等. 刺蒺藜及其有效成分治疗心血管疾病研究进展[J]. 吉林中医药, 2016, 36(3):316–319. |
| [6] | 郭金昊, 姜月华, 杨传华, 等. 刺蒺藜对老年自发性高血压大鼠胸主动脉血管重塑的影响[J]. 中医杂志, 2016, 57(11):957–961. |
| [7] | 孙志, 张中成, 刘志诚. 营养性肥胖动物模型的实验研究[J]. 中国药理学通报, 2002, 18(4):466–467. |
| [8] | Jiang Y H, Yang C H, Li W, et al. Aqueous extracts of Tribulus terrestris protects against oxidized LDL-induced endothelial dysfunction[J]. Chin J Integr Med, 2016, 22(3): 192–200. |
| [9] | 徐叔云. 药理实验方法学[M]. 北京: 人民卫生出版社, 2012. |
| [10] | He Y, Chen H, Quon M J, et al. The mouse obese gene[J]. J Biol Chem, 1995, 270(48): 28887–28891. DOI:10.1074/jbc.270.48.28887 |
| [11] | Sobhahi I, Bado A, Vissuzaine C, et al. Leptin secretin and leptin receptor in the human stomach[J]. Gastroenteroogy, 2000, 118(4): 178–183. |
| [12] | Boden G, chen X, Mozzoli M, et al. Effect of fasting on serum leptin in normal human subjects[J]. J Chin Endocrinol Metab, 1996, 81(9): 3419–3423. |
| [13] | Arias-Alvarez M, Garcla-Garcla R M, Torres-Rovira L, et al. Influence of leptin on in vitro maturation and steroidogenic secretion of cumulus-oocyte complexes through JAK2/STAT3 and MEK1/2 pathways in the rabbit model[J]. Reproduction, 2010, 139(3): 523–532. DOI:10.1530/REP-09-0309 |
| [14] | Mark A L, Corria M L G. Selective leptin resistance:a new concept in leptin physiology with cardiovascular implications[J]. J Hypert, 2002, 20: 1245–1250. DOI:10.1097/00004872-200207000-00001 |
| [15] | 邱宁岩, 包丽华, 傅煜, 等. 瘦素、RAAS与高血压的关系[J]. 标记免疫分析与临床, 2014, 21(3):225–228. |
| [16] | 叶伊琳, 李莉, 张敏敏, 等. 肉桂对高脂饮食诱导的肥胖性高血压大鼠症状的改善及Toll样受体的影响[J]. 中国老年学杂志, 2013, 33(3):606–608. |
| [17] | 杨传华, 陆峰, 谭奇纹. 从肝脾肾论治高血压[M]. 天津: 天津科学技术出版社, 2013. |
| [18] | 陈玉宏. 观察不同程度高血压患者血清β2-MG和GA-L水平变化[J]. 首都医药, 2014, 6(12):36–38. |
 2017, Vol. 48
2017, Vol. 48


