2. 广东恒健制药有限公司, 广东 江门 529040
2. Guangdong Hengjian Pharmaceutical Limited Company, Jiangmen 529040, China
香鳞毛蕨Dryopteris fragrans (L.) Schott是鳞毛蕨科(Dryopteridaceae)鳞毛蕨属Dryopteris Adanson植物,主要分布在中国东北地区,俄罗斯、日本、欧洲、韩国也有分布[1]。根据民间验方记载,其对多种皮肤病疗效显著,特别是对由真菌引起的脚气、脚癣等,因此被视为“皮肤病的克星”[2-3]。
化学成分研究表明,香鳞毛蕨的主要化学成分包括间苯三酚类、萜类、黄酮类、苯丙素类、挥发油类等[4-9]。本课题组前期研究显示香鳞毛蕨乙醇部位为抗真菌有效部位,且抗菌活性与其中的间苯三酚的量直接相关[10]。因此,本实验对香鳞毛蕨中的间苯三酚类化合物进行富集、分离及抗真菌活性研究。从中分离并鉴定出1对间苯三酚类同分异构体,分别鉴定为异黄绵马酸PB(disflavaspidic acid PB,1)、黄绵马酸PB(flavaspidic acid PB,2)。化合物1为新化合物,命名为异黄绵马酸PB。化合物2首次从该植物中分离得到。化合物1和2互为同分异构体,对红色毛癣菌和石膏样小孢子菌均有较好抑制作用。
1 仪器与材料Waters ACQUITY UPLC H-Class超高效液相色谱仪(含QSM四元溶剂管理器、SM-FTN样品管理器、PDA二极管阵列检测器及Empower 3工作站,美国Waters公司);LC-6AD型半制备液相色谱仪(SPD-20A检测器,日本岛津公司);LCQTM DECA离子阱质谱仪(美国Thermo-Finnigan公司);Varian UNITY INOVA 500型超导脉冲傅里叶变换核磁共振仪(美国Varian公司);Zf20D暗箱式紫外分析仪(上海顾村电光仪器厂);YOKO-XR显色加热器(武汉药科新技术开发公司);X-5显微熔点测定仪(巩义市科瑞仪器有限公司)。
柱色谱硅胶(青岛海洋化工有限公司);Sephadex LH-20型凝胶(Pharmacia公司);羧甲基纤维素钠(广东汕头市西陇化工厂);固兰BB盐(上海化学试剂厂);乙醇、正己烷、丙酮、甲酸、醋酸乙酯等均为分析纯。
香鳞毛蕨采自黑龙江省五大连池,经哈尔滨商业大学药学院张德连副教授鉴定为鳞毛蕨属植物香鳞毛蕨Dryopteris fragrans (L.) Schott。标本(XLMJ20130406)存放于广东药科大学中药学院标本室。
2 提取与分离将香鳞毛蕨全株干燥粗粉10 kg用10倍体积分数为50%的乙醇回流提取3次,时间分别为2、1.5、1.5 h,减压浓缩回收乙醇至无醇味得样品水溶液,用质量分数为10%的稀盐酸调节pH为2.4,静置至完全沉淀后,离心得浸膏1.2 kg。将样品用醋酸乙酯和甲醇溶解后,用硅胶(60~100目)拌样,进行硅胶柱色谱初步分离,依次采用不同比例的石油醚-丙酮(100:1、70:1、50:1、30:1、10:1、1:1)洗脱,各流分经过TLC检识,合并相似流分,得到组分A(96 g)、B(320 g)、C(60 g)、D(305 g)、E(160 g)、F(100 g)。
取组分C经反复硅胶柱色谱分离,石油醚-丙酮(80:1→30:1)梯度洗脱,TLC检识后合并相似流分,结合凝胶Sephadex LH-20柱纯化,氯仿-甲醇(1:1)洗脱,重结晶,得淡黄色结晶,再用制备HPLC分离制备得到化合物1(18 mg)和2(37 mg)。
3 结构鉴定化合物1:淡黄色针状结晶(丙酮),UV λmaxMeOH(nm): 298,GF254硅胶薄层色谱分析,喷以质量分数为0.3%的固蓝BB盐溶液,105 ℃显色为红色斑点。ESI-MS m/z: 433.187 2 [M+H]+,分子式为C23H28O8。IR νmaxKBr(cm−1): 3 743, 3 576(羟基和酚羟基);3 438(分子间氢键伸缩振动);2 979(-CH3), 2 927, 2 867(-CH2-);1 641, 1 604, 1 464, 1 424(苯环)。1H-NMR (500 MHz, CDCl3)和13C-NMR (125 MHz, CDCl3)具体数据见表 1。
|
|
表 1 化合物1的波谱数据 Table 1 1H-and 13C-NMR data of compound 1 |
该化合物与黄绵马酸PB具有相似结构[11],仅与绵马酚酸环的5′位取代基存在差异。对比文献报道[12]可知,1H-NMR谱给出的双峰甲基信号δ 3.96, 1.21 (3H, d, J=7.5 Hz)以及13C-NMR谱给出的δ 211.1, 39.0和19.3为连接在绵马酚酸环5′位的异丁酰基信号。因此,推断该化合物由异丁酰基取代黄绵马酸5′位的丁酰基所得。通过HMQC谱指认了所有与氢相连的碳信号。从HMBC谱中(图 1),观察到异丁酰基的10′位δH 1.21与8′位的δC 211.1、9′位的δC 39.0、11′位的δC 19.3具有远程相关。验证了以上推断。检索Scifinder,没有发现相关报道,确认化合物1为新化合物,命名为异黄绵马酸PB。
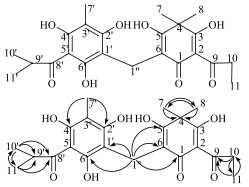
|
图 1 化合物1的结构和重要HMBC相关(H→C) Fig.1 Structure and key HMBC correlations (H→C) of compound 1 |
化合物2:淡黄色针状结晶(丙酮),UV λmaxMeOH(nm): 292,GF254硅胶薄层色谱,喷以质量分数为0.3%的固蓝BB盐溶液105 ℃显色为红色斑点。ESI-MS m/z: 433.167 8 [M+H]+,分子式为C23H28O8。1H-NMR (500 MHz, CDCl3) δ: 2.11 (3H, s, H-7′), 3.09 (2H, t, J=7.5 Hz, H-9′), 1.74 (2H, m, H-10′), 1.00 (3H, t, J=7.5 Hz, H-11′), 3.54 (2H, brs, H-1″), 1.44 (3H, brs, H-7), 1.53 (3H, brs, H-8), 3.20 (2H, q, J=7.5 Hz, H-10), 1.77 (3H, t, J=7.5 Hz, H-11), 10.1 (1H, s, 2′-OH), 16.1 (1H, s, 4′-OH), 15.6 (1H, s, 6′-OH), 10.6 (1H, s, 5-OH), 11.5 (1H, s, 3-OH);13C-NMR (125 MHz, CDCl3) δ: 111.2 (C-1′), 156.3 (C-2′), 102.2 (C-3′), 161.5 (C-4′), 106.5 (C-5′), 159.9 (C-6′), 7.7 (C-7′), 207.6 (C-8′), 45.9 (C-9′), 18.4 (C-10′), 14.2 (C-11′), 17.3 (C-1″), l87.3 (C-1), 108.4 (C-2), l98.0 (C-3), 44.3 (C-4), 171.7 (C-5), 105.5 (C-6), 24.9 (C-7), 25.1 (C-8), 207.0 (C-9), 35.0 (C-10), 8.6 (C-11)。以上波谱数据与文献报道[10]一致,故鉴定化合物2为黄绵马酸PB。
4 体外抗真菌活性评价 4.1 实验菌株红色毛癣菌[CMCC (f) T1b]、石膏样小孢子菌[CMCC (F) M2C],购于中国医学科学院皮肤研究所。质量控制(QC)株采用近平滑念珠菌(ATCC22019),购于中国医学科学院皮肤研究所。
4.2 微量稀释法[13]参照美国CLSI颁布的产孢丝状真菌抗真菌药敏试验方案(M38-A2)提供的方法进行。以盐酸特比萘芬为阳性药。用接种环轻刮SDA培养基表面菌落,使用无菌研磨器将菌丝研碎,将皮肤癣菌悬浮于无菌生理盐水中,使用血细胞计数板计算孢子数量及短菌丝数,稀释菌液浓度至1×103~3×103 CFU/mL。用RPMI 1640液体培养基稀释化合物1、2的贮备液至20 μg/mL后加200 μL于96孔板上的第1列,并用RPMI 1640液体培养基进行横向2倍稀释至第10列,第11列为生长对照孔,加入100 μL液体培养基;第12列为空白对照,加入200 μL液体培养基。然后再于第1~11列各孔中加入100 μL接种菌液。将96孔板置于35 ℃恒温孵育7 d,以肉眼观察,与生长对照比较对80%所测菌株的生长产生抑制的终浓度为MIC。各菌株按以上操作平行重复测定4次,计算MIC的几何均数。
为了明确药敏性试验操作是在可接受的标准内进行,测试结果可信,质控(QC)株采用近平滑念珠菌(ATCC22019),QC药物为氟康唑。
4.3 结果QC株的MIC在规定的范围内(1.0~4.0 μg/mL)。各受试药物及阳性药物体外抗菌活性测定结果见表 2。
|
|
表 2 化合物1和2对供试菌的MIC值 Table 2 MIC of compounds 1 and 2 against tested fungus |
5 讨论
考虑到间苯三酚类化合物因带有酚羟基而呈弱酸性,在提取液中加入稀盐酸调节pH值,使其在溶液中析出从而富集。本课题组目前正在研究这些化合物对其他浅部真菌的抑制作用及分子机制,以期为香鳞毛蕨作为民间用药提供理论依据,为开发新型抗浅部真菌感染药奠定基础。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1977. |
| [2] | 中国科学植物研究所. 秦岭植物志(第2卷)[M]. 北京: 科技出版社, 1974. |
| [3] | 殷先君. 香鳞毛蕨治疗48例难治性手足癣的疗效观察[J]. 现代药物与临床, 2013, 28(1):57–58. |
| [4] | Zhao D D, Zhao Q S, Liu L. Compounds from Dryopteris Fragrans (L.) Schott with cytotoxic activity[J]. Molecules, 2014, 19(3): 3345–3355. DOI:10.3390/molecules19033345 |
| [5] | 张彦龙, 付海燕, 张莹莹, 等. 香鳞毛蕨的化学成分及其细胞毒活性[J]. 中草药, 2008, 39(5):648–651. |
| [6] | 沈志滨, 罗文英, 严优芍, 等. 香鳞毛蕨中萜类化合物的研究[J]. 中药材, 2006, 29(4):334–335. |
| [7] | 朱俊访.香鳞毛蕨化学成分研究[D].广州:广东药学院, 2008. http://www.cqvip.com/QK/92883X/200908/31373088.html |
| [8] | 赵丹丹, 张彦龙, 陆欣媛. 香鳞毛蕨中化学成分的研究[J]. 黑龙江医药, 2006, 5(19):353–355. |
| [9] | Kuang H X, Zhang Y L, Li G Y, et al. A new phenolic glycoside from the aerial parts of Dryopteris fragrans[J]. Fitoterapia, 2008, 79(4): 319–320. DOI:10.1016/j.fitote.2008.01.003 |
| [10] | 范华倩, 沈志滨, 陈艳芬, 等. 香鳞毛蕨不同提取液体外抗真菌作用研究[J]. 中药材, 2012, 35(12):1981–1985. |
| [11] | Lee H B, Kim J C, Lee S M. Antibacterial activity of two phloroglucinols, flavaspidic acids AB and PB, from Dryopteris crassirhizoma[J]. Arch Pharm Res, 2009, 32(5): 655–659. DOI:10.1007/s12272-009-1502-9 |
| [12] | Ishiguro K, Yamaki M, Kashihara M, et al. Saroaspidin A, B, and C:additional antibiotic compounds from Hypericum japonicum[J]. Planta Med, 1987, 53(5): 415–417. DOI:10.1055/s-2006-962760 |
| [13] | Clinical and laboratory standards institute. Reference method for broth dilution antifungal susceptibility testing of filamentous fungi[S]. Approved Standard-Second ed. CLSI Document M38-A2, 2008. |
 2017, Vol. 48
2017, Vol. 48


