2. 天津大学, 天津 300191;
3. 天津药物研究院 释药技术与药代动力学国家重点实验室, 天津 300193
2. Tianjin University, Tianjin 300191, China;
3. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
甘草苷是甘草中主要的黄酮类化合物,拟作为抗心肌缺血I类新药进行开发研究。大多数黄酮类化合物主要经肠道水解生成苷元,并在葡萄糖醛酸转移酶等Ⅱ相酶的作用下生成葡萄糖醛酸结合物、硫酸化物及甲基化物[1-3]。已有文献报道[4, 5, 6]表明,甘草素是甘草苷在体内的代谢产物之一,甘草苷主要以甘草素的形式吸收进入体内。为了确定甘草苷经口给药后体内的主要暴露形式,本课题组对甘草苷在不同种属动物肝微粒体中的转化差异进行研究,结果证实甘草苷口服给药后在血浆和组织中检测不到原型甘草苷,说明通过血液循环进入肝脏进行生物转化的并非原型甘草苷,而是其苷元甘草素及甘草素的葡萄糖醛酸和硫酸结合物[7]。鉴于此,本实验选择甘草素进行体外不同种属,包括大鼠、小鼠、人、犬及猴肝微粒体中的代谢稳定性和代谢产物的比较研究,为选择临床前药效和毒理研究以及与人有相似代谢性质的实验动物种属提供可靠的实验数据,为甘草苷的进一步研究开发提供参考依据。
1 材料 1.1 药品与试剂甘草苷(批号20121211,质量分数为98.23%)、甘草素(批号20120401,质量分数为100%)由吉林省中医药科学院提供;柚皮素(批号071100023,质量分数为99.2%,河南天方药业有限公司);肝微粒体:Wistar大鼠肝微粒体(批号YBWF)、人肝微粒体(批号KQB)、Beagle犬肝微粒体(批号KWTG)、恒河猴肝微粒体(批号GHWA)、小鼠肝微粒体(批号STOM),以蛋白计质量浓度均为20 mg/mL,上海瑞德肝脏疾病研究有限公司;氧化型烟酰胺腺嘌呤二核苷酸磷酸钠盐(氧化性辅酶II,NADP,批号SLBF6292V)、葡萄糖-6-磷酸钠(批号SLBC6322V)、葡萄糖-6-磷酸钠脱氢酶(批号SLBC7565V)、尿苷二磷酸葡萄糖醛酸(UDPGA,批号SLBC9398V),Sigma公司;氯化镁(批号20070918,天津市光复精细化工研究所);磷酸盐缓冲液(批号121225,上海瑞德肝脏疾病研究有限公司)。氯化钠(天津市凯信化学工业有限公司);磷酸二氢钾(天津市风船化学试剂科技有限公司);磷酸氢二钠(天津市化学试剂三厂);甲醇、醋酸乙酯均为分析纯,水为超纯水。
1.2 仪器液相色谱系统(配备LC-20AD型输液泵、DGU-20A3型脱气机、CTO-20A型柱温箱、SI L-20A型自动进样器、CBM-20A系统控制,日本Shimadzu公司);质谱系统(配备API 4000 Q-TRAP质谱仪,SI电喷雾离子化源和Analysis 1.5.2分析数据处理系统工作站,美国Applied Biosystems公司);17R台式高速冷冻离心机(美国Thermo Scientific公司);TARGINTM VX-II型多管涡旋振荡器(北京踏锦科技有限公司);XS105型电子天平(瑞士Metter Toledo公司);Turbo Vap LV型样品浓缩仪(美国Caliper公司);BM-40型纯水制备系统(北京中盛茂源科技发展有限公司);微量移液器(上海大龙医疗设备有限公司);Eppendorf手动单道加样器(德国Eppendorf公司);ZHWY-110X50型恒温水浴震荡仪(上海智城分析仪器制造有限公司);IMS-40全自动雪花制冰机(常熟市雪科电器有限公司)。
2 方法 2.1 LC-MS/MS条件 2.1.1 代谢稳定性研究Diamonsil® C18色谱柱(150 mm×4.6 mm,5 μm);流动相为甲醇-0.5 mmol/L甲酸铵(52.5∶47.5,含0.2%甲酸,10%甲醇);柱温40 ℃;体积流量0.6 mL/min;进样体积3 μL;运行时间10 min(5~9.8 min切换进入质谱)。
电喷雾离子化源,离子喷雾电压-3 000 V;温度500 ℃;碰撞能量-40 V;喷雾气344.74 kPa(50 psi);加热气551.60 kPa(80 psi);卷帘气68.95 kPa(10 psi);碰撞气55.16 kPa(8 psi);负离子方式检测,扫描模式为多反应监测(MRM),甘草素m/z为255.0~119.0;柚皮素m/z为271.0~151.0。
2.1.2 代谢产物分析Diamonsil® C18色谱柱(200 mm×4.6 mm,5 μm);柱温30 ℃;流动相为甲醇(A)和0.5 mmol/L甲酸铵(B,含0.2%甲酸、10%甲醇);梯度洗脱程序:0.01~10 min,80%~60% B;10~15 min,60%~50% B;15~16 min,50% B;16~21 min,50%~60% B;21~34 min,60%~90% B;体积流量0.5 mL/min,进样量20 μL。
电喷雾离子化源,离子喷雾电压-3 000 V;温度500 ℃;碰撞能量-10 V;喷雾气344.74 kPa(50 psi);加热气413.69 kPa(60 psi);卷帘气68.95 kPa(10 psi);碰撞气55.16 kPa(8 psi);负离子方式检测,扫描模式为增强一级全扫描(EMS),增强子离子扫描(EPI)和MRM-IDA-EPI。
2.2 反应体系溶液配制MgCl2溶液配制:称取0.476 g MgCl2溶于50 mL超纯水中,终浓度为100 mmol/L,4 ℃冰箱保存;NADP溶液配制:称取9.65 mg NADP溶于650 μL K2HPO4-KH2PO4(pH 7.4,PBS)缓冲液中,终浓度为20 mmol/L的溶液,临用现配;葡萄糖-6-磷酸钠溶液配制:称取36.69 mg葡萄糖-6-磷酸钠溶于650 μL PBS缓冲液中,浓度为200 mmol/L,临用现配,每次取100 μL至1 000 μL温孵体系中,终浓度为5 mmol/L;葡萄糖-6-磷酸钠脱氢酶溶液配制:200 U葡萄糖 -6-磷酸钠脱氢酶中加2 mL PBS缓冲液溶解后分装,即得100 U/mL的溶液,-80 ℃分装待用,临用时用PBS稀释5倍得20 U/mL的溶液;NADPH再生体系配制:600 μL NADP溶液,600 μL葡萄糖-6-磷酸钠溶液,650 μL葡萄糖-6-磷酸钠脱氢酶溶液,用前混匀即可。
2.3 肝微粒体孵育液样品的孵育与处理过程 2.3.1 Ⅰ相代谢稳定性该孵育体系首先在690 μL PBS缓冲液中加入100 μL MgCl2(终浓度1 mmol/L)、50 μL 肝微粒体(终质量浓度1 mg/mL)和10 μL甘草素(终浓度1 μmol/L),恒温振荡水浴(37 ℃)中预温孵5 min后,加入150 μL NADPH再生体系启动反应,使形成总体积为1.0 mL的温孵系统,甲醇体积分数控制在1%,双样本分析。分别于0、5、10、15、20、30、45、60、90、120 min时,取出50 μL置于预先放于冰上并已加入预冷的50 μL柚皮素(2 μg/mL,4 ℃保存,临用现取)的玻璃管中,随即加入预冷的2.5 mL醋酸乙酯(4 ℃保存,临用现取),涡旋振荡2 min,终止反应。在整个实验过程中,应保持试管开放,以保证实验过程中氧的参与。上述终止反应后样品于3 000 r/min离心10 min(4 ℃);取上清液2 mL,40 ℃氮气吹干,100 μL 50%甲醇水溶液复溶,12 000 r/min离心5 min(4 ℃),上清液进样3 μL,进行LC-MS/MS分析。
2.3.2 Ⅱ相代谢稳定性该孵育体系首先在675 μL PBS缓冲液中加入100 μL MgCl2(终浓度1 mmol/L)、50 μL肝微粒体(终质量浓度1 mg/mL)和5 μL丙甲菌素(终质量浓度25 μg/mL),随后在冰上预孵育30 min。随后加入10 μL甘草素(终浓度1 μmol/L),恒温振荡水浴(37 ℃)中预温孵5 min,再加入150 μL NADPH再生体系和10 μL UDPGA(终浓度5 mmol/L)启动反应,使形成总体积为1.0 mL的温孵系统,甲醇体积分数控制在1%,双样本分析。终止反应及样品处理过程与Ⅰ相代谢稳定性实验相同。
2.3.3 Ⅰ相代谢产物分析该孵育体系首先在320 μL PBS缓冲液中加入50 μL MgCl2(终浓度10 mmol/L)、50 μL肝微粒体(终质量浓度2 mg/mL)和5 μL甘草素(终浓度50 μmol/L),恒温振荡水浴(37 ℃)中预温孵5 min后,加入75 μL NADPH再生体系启动反应,使形成总体积为0.5 mL的温孵系统,甲醇体积分数控制在1%。空白对照除用75 μL PBS缓冲液代替NADPH再生体系启动反应外,其余平行操作。双样本分析。在恒温振荡水浴(37 ℃)温孵60 min时,取出300 μL置于冰上预冷的塑料管,随即加入预冷的冰甲醇1 200 μL(4 ℃保存,临用现取),涡旋振荡2 min,终止反应。在整个实验过程中,应保持试管开放,以保证实验过程中氧的参与。上述终止反应后样品于12 000 r/min离心10 min(4 ℃),取上清液1 200 μL,40 ℃氮气吹干,100 μL 50%甲醇水溶液复溶,12 000 r/min离心5 min(4 ℃),上清进样3 μL,进行LC-MS分析。
2.3.4 Ⅱ相代谢产物分析甘草素在肝微粒体的Ⅱ相代谢产物分析的孵育液组成与Ⅱ相代谢稳定性基本相同,不同之处在于肝微粒体质量浓度为2 mg/mL,底物甘草素浓度为50 μmol/L,所有加入的孵育液组成体积均减半,最终孵育系统体积为0.5 mL。终止反应及反应后样品处理过程与Ⅰ相代谢产物相同。
2.4 数据处理与分析 2.4.1 数据的计算与有效数字的确定肝微粒体孵育液甘草素浓度分析时产生的浓度数值为Analyst 1.5.2处理软件计算得到的结果。为了保持必要的数据精密性,采用软件默认的四舍五入规则,对所有小于1 000的数据保留3位有效数字,对于大于1 000的数据保留至整数位数字。
2.4.2 剩余底物浓度百分比和消除半衰期的计算将甘草素的0 h浓度作为100%,其余时间点的剩余底物浓度与0 h浓度相比得到甘草素的剩余底物浓度百分比。应用GraphPad Prism 5.0软件的线性回归方法计算各时间点的剩余底物浓度百分比的自然对数与相应的孵育时间的斜率(-k),由公式 t1/2=0.693/k求得甘草素体外不同种属肝微粒体代谢的消除半衰期(t1/2)。
2.4.3 代谢产物结构解析体外肝微粒体孵育的代谢产物分析采用QTRAP质谱技术,通过EMS、EPI、MRM-IDA-EPI等扫描模式,对空白样品和加入NADPH启动反应的样品进行比对分析,寻找代谢产物,比较各种属体外肝微粒体的代谢产物谱特征。空白样品为加入甘草素,但不加入NADPH启动反应。
代谢产物的解析过程和策略如下:(1)孵育液样品经前处理后进入仪器,进行负离子EMS扫描,扫描范围m/z 50~1 000。(2)从给药后生物样品的总离子流图中手动筛选准分子离子的信息,结合常规药物代谢转化位点进行基于知识的代谢产物结构预测,通过提取可能代谢产物离子并与空白样品进行比对分析,筛选和寻找可能的代谢产物的m/z。(3)利用QTRAP的信息关联扫描(IDA)软件功能,预设的数据列表应包含上步筛选得到的所有可能代谢产物的m/z,采用MRM-IDA-EPI方法,通过IDA系统自动判断,当通道采集到的信息超过预设值时(2 000 cps),系统自动切换为线性离子阱模式,触发EPI扫描,或直接进行EPI扫描,获得对应通道母离子的MS/MS谱图。(4)应用常规Ⅰ相和Ⅱ相代谢反应规律,结合准分子离子信息并与甘草苷和甘草素的裂解特征比较,对代谢产物的结构进行推导。
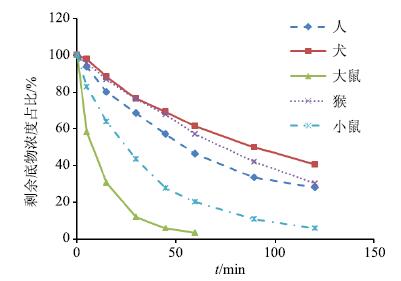
3 结果 3.1 代谢稳定性 3.1.1 Ⅰ相代谢甘草素在大鼠、小鼠、犬、人和猴肝微粒体中进行Ⅰ相孵育后,剩余底物浓度百分比-孵育时间的曲线见图 1。在犬、人、猴、小鼠肝微粒体中,底物消除满足一级消除动力学的时间段均为0~120 min,在大鼠肝微粒体中,底物消除满足一级消除动力学的时间段为0~60 min,经GraphPad Prism 5.0软件的线性回归方法得到-k,计算t1/2,结果见表 1。
|
图 1 甘草素在人、犬、大鼠、猴和小鼠不同种属肝微粒体中的Ⅰ相代谢消除曲线 (n= 2) Fig.1 Elimination curves of phase I metabolism of liquiritigenin in human,dog,rat,monkey,and mouse liver microsomes (n = 2) |
|
|
表 1 甘草素在人、犬、大鼠、猴和小鼠不同种属肝微粒体中Ⅰ相代谢的t1/2 (n = 2) Table 1 Elimination half-lives of phase I metabolism of liquiritigenin in liver microsomes of five different species including human,dog,rat,monkey,and mouse (n = 2) |
3.1.2 Ⅱ相代谢
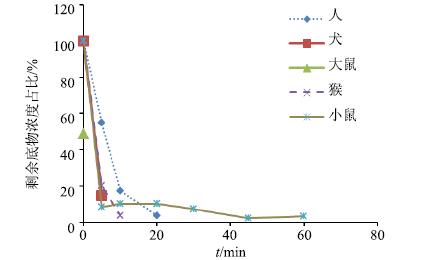
甘草素在大鼠、小鼠、犬、人和猴肝微粒体中进行Ⅱ相孵育后,剩余底物浓度百分比-孵育时间的曲线见图 2。由结果可知,甘草素在不同种属肝微粒体中Ⅱ相代谢速度非常快,大鼠肝微粒体在加入甘草素后立即取样测定的剩余底物即消除了约50%,5 min后已检测不到甘草素。其余种属肝微粒体也均在5 min后下降50%以上。通过甘草素在肝微粒体进行I、Ⅱ相代谢的比较可知,甘草素在肝微粒体的代谢主要以Ⅱ相代谢为主,且代谢速度较快。
|
图 2 甘草素在人、犬、大鼠、猴和小鼠不同种属肝微粒体中的Ⅱ相代谢消除曲线 (n= 2) Fig.2 Elimination curves of phase II metabolism of liquiritigenin in human,dog,rat,monkey,and mouse liver microsomes (n = 2) |
3.2 代谢产物分析
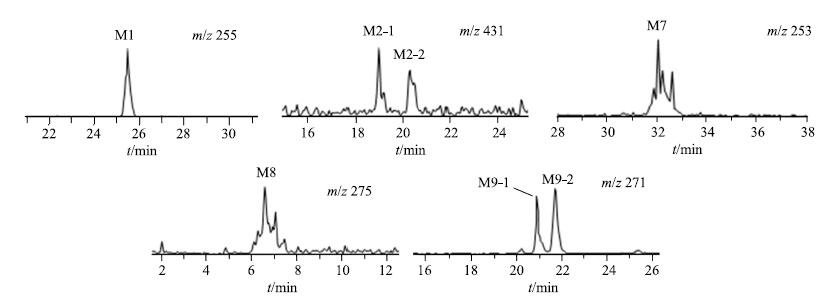
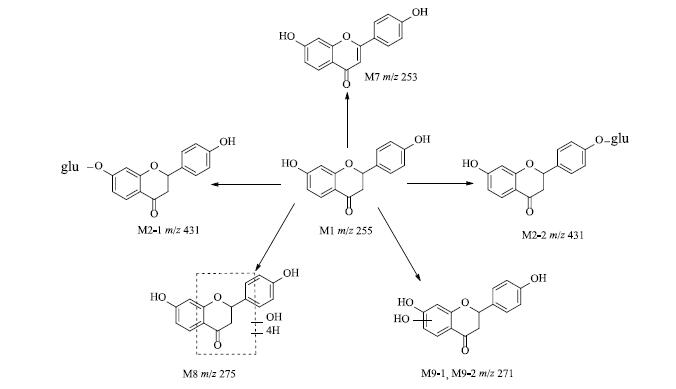
鉴于前期已对甘草苷大鼠给药的代谢产物进行分析[7],体外肝微粒体中部分代谢产物仍沿袭大鼠体内代谢产物的命名原则,即代谢产物M1、M2-1、M2-2和M7与体内的相同,其中M1为甘草素,M8、M9-1和M9-2均为体外孵育产生而在大鼠体内未观察到的代谢产物。甘草素在各种属肝微粒体代谢的提取离子色谱图见图 3,可能的代谢产物和代谢途径见图 4。
|
图 3 甘草素在不同种属肝微粒体孵育后甘草素及其代谢产物的提取离子色谱图 Fig.3 Extracted ion chromatograms for liquiritigenin and its metabolites in liver microsomes from different species |
|
图 4 甘草素在不同种属肝微粒体孵育后的可能代谢产物和代谢途径 Fig.4 Proposed metabolic pathway for liquiritigenin in liver microsomes from different species |
3.2.1 Ⅰ相代谢
甘草素在大鼠、犬、人、猴和小鼠肝微粒体中孵育60 min后,各种属肝微粒体中可能代谢产物的分子离子分别为m/z 253、275、271,可能代谢产物的色谱质谱相关信息见表 2。
|
|
表 2 甘草素在5个种属肝微粒体Ⅰ相孵育的可能代谢产物的色谱质谱信息 Table 2 Information of phase I metabolites of liquiritigenin in liver microsomes from five different species |
M1:在m/z 255的提取离子流色谱图中,5个种属肝微粒体中均可观察到1个色谱峰,保留时间为25.5 min,命名为M1,主要碎片离子为m/z 135、119。M1与甘草素对照品进行比对分析,发现其色谱保留时间、准分子离子及二级碎片离子均与甘草素相同,因此确定M1为甘草素。
M7:在m/z 253的提取离子流色谱图中,仅在人、犬和大鼠肝微粒体中可检测到1个色谱峰,保留时间为32.2 min,主要碎片离子为m/z 223、209、135、117,为甘草素C环C-2和C-3位置脱氢形成双键的代谢产物,与大鼠ig给予甘草苷后的体内代谢产物M7有相同的保留时间和碎片离子,因此可认为是同一代谢产物。
M8:在m/z 275的提取离子流色谱图中,5个种属肝微粒体中均可检测到1个色谱峰,保留时间为6.5 min,命名为M8,主要碎片离子为m/z 257、239、195、177、159、129。其中m/z 257、239为准分子离子m/z 275分别脱去1分子和2分子水后形成的脱水峰,由于未发现C环O-C2键和C3-C4键同时发生断裂产生的A环羟基化和B环的特征性碎片离子m/z 151及119,而m/z 177为甘草素脱去B环后A环或C环部分发生单羟基化的代谢产物,因此初步推测单羟基化的结合位点可能在C环的C-2或C-3位。由于现有的质谱碎片离子m/z 195、159和129不能用常规代谢反应特点和知识进行推断,根据文献报道[8],推测其可能发生分子重排后的羟基化和氢化反应,还需进一步的实验确认。
M9:在m/z 271的提取离子流色谱图中,5个种属肝微粒体中均可检测到2个色谱峰,保留时间分别为20.9、21.7 min,分别命名为M9-1和M9-2。m/z 271比甘草素的分子离子多16,因此可能发生了羟化反应,但由于二者的主要碎片离子相同,均为m/z 229、165、151和119,据此判断可能羟化反应的结合位点不同。其中主要碎片离子m/z 151比甘草素的特征碎片离子m/z 135多16,由于m/z 135为C环断裂产生的特征性碎片离子,而B环的特征碎片离子m/z 119未发生变化,因此初步推测羟基化可能发生在A环,但M9-1和M9-2的羟基化位点不同。
3.2.2 Ⅱ相代谢甘草素在大鼠、犬、人、猴和小鼠肝微粒体中孵育60 min后,各种属肝微粒体中可能代谢产物的分子离子分别为m/z 275、431,可能代谢产物的色谱质谱相关信息见表 3。
|
|
表 3 甘草素在5个种属肝微粒体Ⅱ相孵育的可能代谢产物的色谱质谱信息 Table 3 Information of phase II metabolites of liquiritigenin incubated with liver icrosomes of five different species |
M2-1和M2-2:在m/z 431的提取离子流色谱图中,可观察到2个色谱峰,保留时间分别为19.0、20.3 min,主要碎片离子m/z 369、296、255、135、119,与大鼠体内代谢产物M2-1和M2-2有相同的保留时间和碎片离子,为甘草素的葡萄糖醛酸结合物,二者的不同之处在于其结合位点。
M8:在m/z 275的提取离子流色谱图中,5个种属肝微粒体的Ⅱ相代谢孵育液中均可观察到1个色谱峰,保留时间为6.5 min,命名为M8,主要碎片离子为m/z 257、239、195、177、159、129,与Ⅰ相代谢的产物M8相同。
4 讨论新药研发的早期阶段,可通过表征其在体外肝微粒体中的代谢稳定性和代谢转化情况,对实验动物与人进行不同种属间的代谢差异比较研究,为动物实验结果外推至人体提供有益参考,也为药物在人体内可能的代谢特征提供有价值的数据。代谢稳定性描述化合物代谢的速度和程度,是影响药动学性质的主要因素之一[9, 10]。早期阶段代谢产物的对照品不易获得,因此可采用底物消除法,通过剩余底物浓度百分比和t1/2表征发生代谢的程度和速度[9]。体外的代谢转化则描述药物在肝微粒体中孵育产生的代谢产物种类和数量,即代谢途径和代谢产物谱。
Ⅰ相肝微粒体孵育体系中需要加入NADPH辅助因子,而Ⅱ相孵育体系还需加入UDPGA,原因是Ⅱ相反应还涉及到酶的延迟反应期。正常情况下UGT定位于细胞内质网膜上,而在离心状态下得到的微粒体有一部分是小囊泡,酶的活性位点因此而被封闭于其中。由于UDPGA需进入活性位点才能发挥作用,且摄取UDPGA的转运体在缺乏ATP时无法发挥作用,因此有必要“激活”或“去除”酶的延迟反应期[11]。近年来,能形成管孔的丙甲菌素由于具有较宽的优化浓度范围[12-13],对CYP酶的活性无影响[13],并能显著提高Ⅱ相结合代谢的清除率[14-15],因此本实验采用丙甲菌素去除酶的延迟反应,使UDPGA顺利进入活性位点并发挥作用。
在整个实验过程中,需要严格控制的细节还有以下几点:(1)应保持试管开放,因为酶反应过程涉及到氧化还原反应,需要氧气作为底物进行电子传递,因此整个孵育过程应保证氧气流通[16]。(2)孵育体系中加入的有机溶剂量应尽可能低,通常甲醇控制在2%以下,并且在整个实验的所有样品需保持一致[17-18]。(3)终止反应时,需加入至少1倍体积的冰甲醇或冰乙腈,这样能够灭活酶,沉淀微粒体中的蛋白质和脂类。
在Ⅰ相肝微粒体孵育体系中,甘草素在大鼠和小鼠肝微粒体中为快代谢,在人和猴肝微粒体中代谢相似且较慢,t1/2分别为63.6和69.9 min;甘草素在这5个种属肝微粒体发生Ⅰ相代谢的t1/2依次为大鼠<小鼠<人<猴<犬;在Ⅱ相肝微粒体孵育体系中,甘草素在5个种属的肝微粒体中代谢都非常快,除小鼠外,均在5 min内下降50%以上。另外,甘草素在人肝微粒体进行Ⅱ相孵育产生的代谢产物谱和猴肝微粒体相同,其余种属则与人的代谢产物谱有着明显不同。上述结果表明,甘草素在猴肝微粒体的代谢稳定性和代谢产物谱均与人相似,其余种属间则存在种属差异。
新药研发过程中,根据非临床药动学的研究技术指导原则[19],应选择2种或以上动物,其中1种为啮齿类动物,另1种为非啮齿类动物。本实验的研究结果表明,甘草素在体外猴肝微粒体的代谢特征更接近于人的,犬次之,因此除啮齿类动物大鼠外,猴或犬可作为临床前药代和毒理研究的模型动物。这一结果为选择临床前药效和毒理以及与人有相似代谢性质的实验动物种属提供可靠的实验数据,从而为甘草苷的进一步研究开发提供参考依据。
| [1] | Graf B A, Ameho C, Dolnikowski G G, et al. Rat gastrointestinal tissues metabolize quercetin[J]. J Nutr, 2006, 136(1): 39–44. |
| [2] | Van Der woude H, Boersmam G, Vervoort J, et al. Identification of 14 quercetin phase Ⅱ mono-and mixed conjugates and their formation by rat and human phase Ⅱ in vitro model systems[J]. Chem Res Toxicol, 2004, 17(11): 1520–1530. DOI:10.1021/tx049826v |
| [3] | Gradolatto A, Canyveng-lavier M C, Basly J P, et al. Metabolism of apigenin by liver phase I and phase Ⅱ enzymes and by isolated perfused rat liver[J]. Drug Metab Dispos, 2004, 32(1): 58–65. DOI:10.1124/dmd.32.1.58 |
| [4] | Kitagawa I, Chen W Z, Taniyama T, et al. Quantitative determination of constituents in various licorice roots by means of high performance liquid chromatography[J]. Yakugaku Zasshi, 1998, 118(11): 519–528. |
| [5] | Zuo F, Zhou M Z, Yan M Z, et al. Metabolism of constituents in Huangqin-Tang, a prescription in traditional Chinese medicine, by human intestinal flora[J]. Biol Pharm Bull, 2002, 25(5): 558–563. DOI:10.1248/bpb.25.558 |
| [6] | Dong S Q, Fan H R, Li Q S, et al. LC-MS/MS method for quantification of liquiritigenin in rat plasma:application to pharmacokinetic study of liquiritin[J]. Chin Herb Med, 2016, 8(1): 53–60. DOI:10.1016/S1674-6384(16)60008-4 |
| [7] | 董世奇, 樊慧蓉, 李全胜, 等. 甘草苷在大鼠体内的代谢途径研究[J]. 中草药, 2014, 45(17):2499–2505. |
| [8] | Nikolic D, van Breemen R B. New metabolic pathways for flavanones catalyzed by rat liver microsomes[J]. Drug Metab Dispos, 2004, 32(4): 387–397. DOI:10.1124/dmd.32.4.387 |
| [9] | van de Waterbeemd H, Gifford E. ADMET in silico modelling:towards prediction paradise[J]. Nat Rev Drug Discov, 2003, 2(3): 192–204. DOI:10.1038/nrd1032 |
| [10] | Thompson T N. Optimization of metabolic stability as a goal of modern drug design[J]. Med Res Rev, 2001, 21(5): 412–449. DOI:10.1002/(ISSN)1098-1128 |
| [11] | Donglu Z, Mingshe Z, Griffith H W. 药物设计与开发中药物代谢——基本原理与实践[M]. 北京: 人民军医出版社, 2011. |
| [12] | Fisher M B, Paine M F, Strelevitz T J, et al. The role of hepatic and extrahepatic UDP-glucuronosyltransferases in human drug metabolism[J]. Drug Metab Rev, 2001, 33(3/4): 273–297. |
| [13] | Fisher M B, Campanale K, Ackermann B L, et al. In vitro glucuronidation using human liver microsomes and the pore-forming peptide alamethicin[J]. Drug Metab Dispos, 2000, 28(5): 560–566. |
| [14] | Cubitt H E, Houston J B, Galetin A. Relative importance of intestinal and hepatic glucuronidation-impact on the prediction of drug clearance[J]. Pharm Res, 2009, 26(5): 1073–1083. DOI:10.1007/s11095-008-9823-9 |
| [15] | Kemp D C, Fan P W, Stevens J C. Characterization of raloxifene glucuronidation in vitro:contribution of intestinal metabolism to presystemic clearance[J]. Drug Metab Dispos, 2002, 30(6): 694–700. DOI:10.1124/dmd.30.6.694 |
| [16] | Hlavica P, Lewis D F. Allosteric phenomena in cytochrome P450-catalyzed monooxygenations[J]. Eur J Biochem, 2001, 268(18): 4817–4832. DOI:10.1046/j.1432-1327.2001.02412.x |
| [17] | Easterbrook J, Lu C, Sakai Y, et al. Effects of organic solvents on the activities of cytochrome P450 isoforms, UDP-dependent glucuronyl transferase, and phenol sulfotransferase in human hepatocytes[J]. Drug Metab Dispos, 2001, 29(2): 141–144. |
| [18] | Busby W F, Ackermann J M, Crespi C L. Effect of methanol, ethanol, dimethyl sulfoxide, and acetonitrile on in vitro activities of cDNA-expressed human cytochromes P-450[J]. Drug Metab Dispos, 1999, 27(2): 246–249. |
| [19] | 化学药物非临床药代动力学研究技术指导原则[S]. 2014. |
 2017, Vol. 48
2017, Vol. 48

