2. 湖北大学 生物资源绿色转化协同创新中心, 湖北 武汉 430062
2. Hubei Collaborative Innovation Center for Green Transformation of Bio-resources, Hubei University, Wuhan 430062, China
平卧菊三七Gynura procumbens Lour. 为菊科植物,主要分布于东南亚地区,尤其是马来西亚、印度尼西亚和泰国,在我国主要分布于广东、海南、贵州、云南等地。作为一种重要的药用植物,平卧菊三七具有治疗糖尿病[1-2]、高血压[3-5]、癌症[6]、炎症[7]、肾病[8]、脂肪肝[9]的药理活性。研究表明,平卧菊三七中含有多种有机酸如绿原酸[9]、原儿茶酸、对香豆酸、咖啡酸等[10-11]和黄酮类成分如芹菜素、槲皮素、芦丁、杨梅素、山柰酚等[10-12]以及三萜类成分[13],具有显著的抗氧化作用,可作为天然的抗氧化剂[11]。由于平卧菊三七水提物成分复杂,目前,我国尚未制定平卧菊三七水提取物统一的质量标准。本实验采用HPLC-MS/MS法[14-16]同时检测了平卧菊三七水提取物中4种有机酸类成分(绿原酸、原儿茶酸、对香豆酸、咖啡酸)和5种黄酮类成分(芹菜素、槲皮素、芦丁、杨梅素、山柰酚),方法选择性好、灵敏度高,可用于平卧菊三七水提物的质量控制。
1 仪器与材料岛津LC-MS/MS系统,包括LC-20AD二元泵、CTO-20A柱温箱、SIL-20ACHT自动进样器、DGU-20A 3R脱气装置,MS-8040质谱仪,LabSolutions工作站,日本岛津公司;5810R型高速离心机,德国Eppendorf公司;BP211D型电子天平,德国Sartorius公司;WH-2微型漩涡混合仪,上海沪西分析仪器厂;Vortex-5型漩涡震荡器,天津仪器厂;KQ-250E型超声波清洗器,昆山市超声仪器有限公司。
对照品和厚朴酚(批号110730-201614,内标)、绿原酸(批号110753-201415)、槲皮素(批号10081- 9905)、咖啡酸(批号110885-200102)、原儿茶酸(批号110809-201205)均由中国食品药品检定研究院提供,质量分数均≥98%;对照品芹菜素(批号D15122101)、芦丁(批号D16021901)、杨梅素(批号D15120601)、对香豆酸(批号D15101801)、山柰酚(批号D15110802)均由南京狄尔格医药科技有限公司提供,质量分数均≥98%。屈臣氏蒸馏水;色谱纯甲醇,德国Merck公司;色谱纯甲酸,Sigma公司;平卧菊三七水提取物,陕西锦泰生物工程有限公司,批号JT151124、JT160907、JT161115;规格1 kg/袋,相当于原药材10 kg。
2 方法与结果 2.1 色谱条件色谱柱为Shim-pack ODS C18柱(150 mm×2.0 mm,4.6 μm),配Shim-pack ODS C18保护柱(5.0 mm×2.0 mm,4.6 μm);柱温35 ℃;流动相为0.1%甲酸水溶液-甲醇,梯度洗脱程序:0~15 min,20%~85%甲醇;15~20 min,80%~20%甲醇;体积流量0.2 mL/min;进样量5 μL。
2.2 质谱条件离子源为电喷雾离子化源(ESI),在负离子模式下采用多反应检测(MRM),每种化合物的子离子依据其母离子的碰撞诱导解离优化得到,用于定量分析的离子对:和厚朴酚m/z 265.0→224.2,芹菜素m/z 269.0→117.2,槲皮素m/z 301.0→151.0,芦丁m/z 609.0→300.0,杨梅素m/z 317.0→151.0,绿原酸m/z 353.0→191.1,原儿茶酸m/z 153.0→109.0,对香豆酸m/z 163.0→119.1,咖啡酸m/z 179.0→135.05,山柰酚m/z 285.0→93.2。其他质谱条件:源喷射电压−3 500 V,温度400 ℃,雾化气体积流量3 L/min,气帘气体积流量15 L/min。
2.3 对照品溶液的制备精密称取咖啡酸、原儿茶酸、绿原酸、对香豆酸、芦丁、杨梅素、芹菜素、山柰酚、槲皮素对照品适量,芹菜素用二甲基亚砜制成质量浓度为0.1 mg/mL的对照品储备液,其他均用甲醇制成1 mg/mL的对照品储备液;精密称取和厚朴酚(内标)对照品适量,用甲醇制成质量浓度为1.48 mg/mL的对照品储备液。芹菜素对照品储备液精密取10 μL,芦丁、山柰酚、杨梅素对照品储备液各精密取24 μL,咖啡酸、绿原酸、槲皮素对照品储备液各精密取32 μL,原儿茶酸、对香豆酸对照品储备液各精密取80 μL,置于10 mL量瓶中,加入甲醇稀释至刻度,摇匀,制成质量浓度芹菜素为0.1 μg/mL,芦丁、山柰酚、杨梅素为2.4 μg/mL,咖啡酸、绿原酸、槲皮素为3.2 μg/mL,原儿茶酸、对香豆酸为8 μg/mL的混合对照品溶液。和厚朴酚对照品储备液精密取10 μL,置于10 mL量瓶中,加入甲醇稀释至刻度,摇匀,制成质量浓度为1.48 μg/mL的内标溶液。
2.4 供试品溶液的制备取平卧菊三七提取物约40 mg,置于10 mL Eppendorf离心管中,加甲醇4 mL,室温超声提取30 min后,4 000 r/min离心10 min,取上清液;沉淀重复提取1次后,合并2次上清液,放至室温,用甲醇定容至10 mL。摇匀后用0.22 μm的微孔滤膜滤过,取续滤液800 μL挥干,400 μL流动相复溶作为供试品溶液。
2.5 专属性考察分别精密吸取混合对照品溶液、供试品溶液各5 μL,进样分析,结果见图 1。各化合物所选离子对之间无干扰,方法专属性良好。
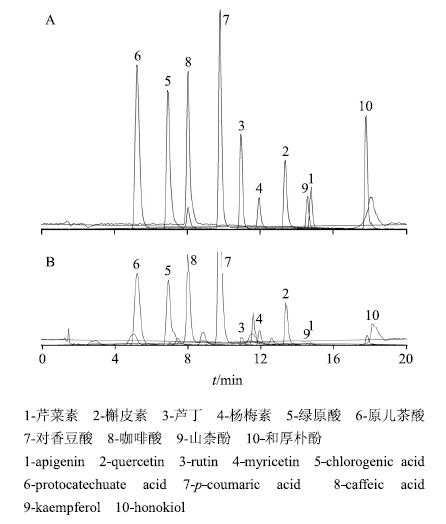
|
图 1 混合对照品溶液 (A) 与平卧菊三七水提取物 (B) 的提取离子流色谱图 (EIC) (A、B均为叠加图) Fig.1 EIC of mixed references solution (A) and G. procumbens aqueous extract (B) (A and B are superimposed figures) |
2.6 线性关系及定量限考察
在“2.1”项色谱条件和“2.2”项质谱条件下测定,以对照品进样质量浓度为横坐标(X),对照品色谱峰面积与内标色谱峰面积之比为纵坐标(Y),绘制标准曲线,得到各物质的线性回归方程。以信噪比(S/N)为10时各对照品进样质量浓度作为定量限(LOQ),结果见表 1。
|
|
表 1 9 种待测物的线性回归方程及定量限 Table 1 Linear regression equations and LOQs of nine testing constituents |
2.7 精密度试验
按照“2.3”项下方法制备9种对照品低、高质量浓度质控(QC)样本,分别为芹菜素6.25、25.00 ng/mL,槲皮素、绿原酸、咖啡酸200、800 ng/mL,芦丁、杨梅素、山柰酚150、600 ng/mL,原儿茶酸、对香豆酸500、2 000 ng/mL,连续重复进样6次,测定对照品和内标峰面积,代入回归方程求得实测质量浓度,计算其RSD值。
结果低、高质量浓度QC样品的测定精密度(RSD)分别为芹菜素0.93%、1.86%,槲皮素2.36%、1.06%,芦丁2.64%、1.39%,杨梅素2.72%、1.78%,绿原酸2.81%、2.88%,原儿茶酸0.44%、0.35%,对香豆酸2.23%、1.61%,咖啡酸2.70%、0.47%,山柰酚1.83%、1.38%。
2.8 稳定性试验精密称取平卧菊三七水提物(批号JT151124)40 mg,按照“2.4”项下方法平行制备供试品溶液6份,分别在室温下放置2、6、12 h后进样测定,记录供试品和内标峰面积,代入回归方程求得实测浓度,计算其RSD值分别为芹菜素2.55%、槲皮素0.52%、芦丁3.06%、杨梅素2.94%、绿原酸2.85%、原儿茶酸1.97%、对香豆酸1.63%、咖啡酸2.59%、山柰酚3.10%。
2.9 重复性试验精密称取平卧菊三七水提物(批号JT151124)6份,每份40 mg,按照“2.4”项下操作制备供试品溶液,测定每份供试品溶液中各指标成分与内标峰面积,代入回归方程求得实测浓度,计算其RSD值分别为芹菜素3.08%、槲皮素0.74%、芦丁3.06%、杨梅素2.55%、绿原酸1.29%、原儿茶酸1.23%、对香豆酸2.06%、咖啡酸2.74%、山柰酚3.24%。
2.10 加样回收率试验精密称取平卧菊三七水提物(批号JT151124)20 mg,加入9种对照品QC样(质量浓度分别为芹菜素12.5 ng/mL,槲皮素、绿原酸、咖啡酸400 ng/mL,芦丁、杨梅素、山柰酚300 ng/mL,原儿茶酸、对香豆酸1 000 ng/mL)适量,按“2.4”项下方法平行制备6份供试品溶液,测定每份供试品溶液中各指标成分与内标峰面积,代入回归方程求得实测质量浓度,考察分析方法的加样回收率。结果9种分析物的加样回收率分别为芹菜素96.88%(RSD为3.13%)、槲皮素93.71%(RSD为3.03%)、芦丁100.0%(RSD为3.31%)、杨梅素99.90%(RSD为2.3%)、绿原酸101.2%(RSD为1.82%)、原儿茶酸101.3%(RSD为2.38%)、对香豆酸91.03%(RSD为1.69%)、咖啡酸95.85%(RSD为2.84%)、山柰酚98.89%(RSD为2.27%)。
2.11 样品测定取3批平卧菊三七水提物各40 mg,按“2.4”项下平行制备供试品溶液,每个批号平行制备6份,测定每份供试品溶液中各指标成分与内标峰面积,代入回归方程求得实测质量浓度,并计算各待测组分在平卧菊三七水提物中的质量分数,结果见表 2。
|
|
表 2 平卧菊三七水提物中9种成分测定结果 (n = 6) Table 2 Quantitative determination of nine constituents in G.procumbens aqueous extract (n = 6) |
3 讨论 3.1 质谱与色谱条件优化
采用MRM负离子监测9种待测物时灵敏度明显优于正离子模式。不同黄酮类、酚酸类物质间结构较类似,完全色谱分离较难。考察了不同流动相组合(包括乙腈-水、甲醇-水及添加不同电解质如甲酸、乙酸铵)对分离与检测的影响,结果表明,在纯水流动相中各组分峰形差、拖尾严重,在乙腈流动相中杂质分离效果差;在水相中添加甲酸后可明显改善各物质的峰形,抑制拖尾现象。所以最终选择甲醇-0.1%甲酸水溶液作为流动相进行梯度洗脱,9种成分及内标的色谱峰分离好,响应值稳定,且无其他物质干扰。此外,柱温过高(35~40 ℃)会使原儿茶酸的峰形变宽,因此实验设定柱温为35 ℃。
3.2 样品提取方法的选择9种待测组分可分为黄酮类和酚酸类2大类,理化性质相差较大。对比研究了纯甲醇、50%甲醇及水3种溶媒提取平卧菊三七水提取物中目标化合物的情况,结果表明,纯甲醇提取效果最好,通过进一步考察提取次数与提取时间对目标化合物得率的影响,最终选用纯甲醇超声提取2次,每次提取30 min。
3.3 杂峰与内标浓度实验发现,在MRM模式下,绿原酸及咖啡酸对照品各有1个杂峰;而平卧菊三七水提物供试液中绿原酸和对香豆酸各有1个杂峰,咖啡酸和原儿茶酸各有3个杂峰。虽然这些杂峰较小,但也说明平卧菊三七水提物中存在上述测定物质的同分异构体 [17-18]。由于杂峰与测定物分离良好,不会影响待测物的定量。此外,为兼顾平卧菊三七水提物供试液中9种待测成分的响应值差距,内标质量浓度的设置使得其响应值居于9种待测物响应值的中间。
目前,平卧菊三七水提取物并没有统一的质量标准。本实验建立的LC-MS/MS法可以快速准确地测定9种待测组分的量,为平卧菊三七水提取物的质量标准的建立提供了参考,也为其药效学和药动学研究打下了基础。
| [1] | Hassan Z, Yam M F, Ahmad M, et al. Antidiabetic Properties and mechanism of action of Gynura procumbens water extract instreptozotocin-induced diabetic rats[J]. Molecules, 2010, 15(12): 9008–9023. DOI:10.3390/molecules15129008 |
| [2] | Lee H W, Hakim P, Rabu A, et al. Antidiabetic effect of Gynura procumbens leaves extracts involve modulation of hepatic carbohydrate Metabolism in streptozotocin-induced diabetic rats[J]. J Med Plants Res, 2012, 6(5): 796–812. |
| [3] | Hoe S Z, Lee C N, Mok S L, et al. Gynura procumbens Merr. decreases blood pressure in rats by vasodilatation via inhibition of calcium channels[J]. Clinics, 2011, 66(1): 143–150. DOI:10.1590/S1807-59322011000100025 |
| [4] | Abrika O S S, Yam M F, Asmawi M Z, et al. Effects of extracts and fractions of Gynura procumbens on rat atrial contraction[J]. J Acupunct Meridian Stud, 2013, 6(4): 199–207. DOI:10.1016/j.jams.2013.01.020 |
| [5] | 郑国栋, 钟树生, 张清峰, 等. 平卧菊三七对小鼠血糖及血脂的影响[J]. 现代食品科技, 2013, 29(12):2800–2804. |
| [6] | Nurulita N A, Meiyanto E, Sugiyanto S, et al. The ethyl acetate fraction of Gynura procumbens sensitizes widr colon cancer cell line against 5-fluorouracil but shows antagonism with cisplatin[J]. Int J Phytomed, 2011, 3(3): 392–405. |
| [7] | Zahra A A, Kadir F A, Mahmood A A, et al. Acute toxicity study and wound healing potential of Gynura procumbens leaf extract in rats[J]. J Med Plants Res, 2011, 5(12): 2551–2558. |
| [8] | Lee H J, Lee B C, Chung J H, et al. Inhibitory effects of an aqueous extract of Gynura procumbens on human mesangial cell proliferation[J]. Korean J Physiol Pharmacol, 2007, 11(4): 145–148. |
| [9] | Li X J, Mu Y M, Li T T, et al. Gynura procumbens reverses acute and chronic ethanol-induced liver steatosis through MAPK/SREBP-1c-dependent and -independent pathways[J]. J Agricultural Food Chem, 2015, 63(38): 8460–8471. DOI:10.1021/acs.jafc.5b03504 |
| [10] | Kaewseejan N, Sutthikhum V, Siriamornpun S. Potential of Gynura procumbens leaves as source of flavonoid-enriched fractions with enhanced antioxidant capacity[J]. J Funct Foods, 2015, 12: 120–128. DOI:10.1016/j.jff.2014.11.001 |
| [11] | Kaewseejan N, Siriamornpun S. Bioactive components and properties of ethanolic extract and its fractions from Gynura procumbens leaves[J]. Ind Crop Prod, 2015, 74: 271–278. DOI:10.1016/j.indcrop.2015.05.019 |
| [12] | 巩升帅, 刘艳丽, 李艳, 等. 平卧菊三七的化学成分研究(I)[J]. 中草药, 2016, 47(11):1856–1860. |
| [13] | 叶芝红, 赵艳, 朱艳萍, 等. 响应面法优化微波辅助提取平卧菊三七三萜的工艺研究[J]. 食品工业科技, 2016, 37(2):293–297. |
| [14] | 吴茵, 魏欣, 张黎媛, 等. HPLC-MS/MS法同时测定参麦注射液7种主要有效成分[J]. 中草药, 2014, 45(18):2625–2630. |
| [15] | Ye L H, Xiao B X, Cao F R, et al. Identification of icaritin metabolites in rats by LC-MS/MS[J]. Chin Herb Med, 2015, 7(4): 296–302. DOI:10.1016/S1674-6384(15)60055-7 |
| [16] | 姜新, 余霞霞, 赵慧, 等. 液相色谱-质谱联用技术鉴定甘草酸二铵肠溶片中有关物质[J]. 中草药, 2015, 46(3):365–368. |
| [17] | Zhu P, Miao X L, Chen Y. Degradation kinetics of chlorogenic acid, cryptochlorogenic acid, and neochlorogenic acid at neutral and alkaline pH values[J]. Acta Pharm Sin, 2016, 51(1): 122–126. |
| [18] | Oniszczuka A, Olechba M. Optimization of ultrasound-assisted extraction and LC-ESI-MS/MS analysis of phenolic acids from Brassica oleracea L. var. sabellica[J]. Ind Crop Prod, 2016, 83: 359–363. DOI:10.1016/j.indcrop.2016.01.015 |
 2017, Vol. 48
2017, Vol. 48


