黄芪和当归是中医学防病治病常用的配伍组合,其中最常用的是黄芪-当归配伍比例为5:1的当归补血汤,具有促进造血[1]、增强免疫功能[2]、保护心血管[3]、抗脏器纤维化[4-5]、类雌激素样作用[6-7]、抗糖尿病肾病[8]等多种药理效应,可用于多种疾病的治疗。大量研究表明,当归补血汤用于多种贫血和造血功能低下治疗时具有较好的疗效。当归补血汤具有类雌激素样作用和促红细胞生成作用[9],对小鼠骨髓造血功能抑制模型,当归补血汤汤剂和颗粒剂可促进外周血细胞和骨髓有核细胞数量的恢复,促进骨髓造血干细胞或祖细胞增殖,从而促进造血功能的恢复[10]。另有研究表明,在贫血模型中,当归-黄芪1:5~5:1配伍均对促进造血功能的恢复有协同作用,尤其在当归10~40 g、黄芪90~180 g及当归50~100 g、黄芪20~100 g表现出很强的协同作用[11]。但目前对于二者用于促进造血应当以何比例配伍众说纷纭,临床应用时配伍的比例也不一致。这影响了黄芪和当归配伍对造血功能低下治疗的应用。本课题组采用环磷酰胺致骨髓造血功能抑制小鼠模型,研究了黄芪和当归不同比例配伍对造血祖细胞增殖和骨髓细胞衰老的影响[12],本实验从造血功能角度继续考察黄芪和当归不同配伍的促造血作用,为临床应用提供参考。
1 材料 1.1 实验动物SPF级ICR小鼠,雌雄各半,体质量18~22 g,由湖南中医药大学实验动物中心提供,合格证号43004700005819。标准颗粒饲料饲喂,饲养于SPF动物实验室。动物实验得到湖南中医药大学医学动物实验伦理委员会批准。
1.2 药材与试剂黄芪为豆科(Leguminosae)植物蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao的干燥根,产地内蒙古;当归为伞形科(Umbelliferae)植物当归Angelica sinensis (Oliv.) Diels的干燥根,产地甘肃;药材由湖南中医药大学第一附属医院药剂科提供,由左亚杰教授鉴定,原植物保存于湖南中医药大学第一附属医院。按《中国药典》2015年版收载的方法,质量鉴定以高效液相色谱法分别测定黄芪中黄芪甲苷和当归中阿魏酸的量,结果表明,以干燥品计,黄芪中黄芪甲苷的量 > 0.040%,当归中阿魏酸的量 > 0.050%,符合《中国药典》2015年版的标准。
重组人粒细胞-巨噬细胞集落刺激因子(rhG-CSF,北京双鹭药业股份有限公司,批号13041105);注射用环磷酰胺(CTX,江苏恒瑞医药股份有限公司,批号13110725);小鼠促红细胞生成素(EPO)、血小板生成素(TPO)、粒-巨噬细胞集落刺激因子(GM-CSF)酶联免疫吸附试验(ELISA)试剂盒,武汉贝茵莱生物科技有限公司。
1.3 仪器SW-CJ-IFD型超净工作台(苏州苏洁净化设备有限公司);SHEL-LAB2300型CO2培养箱(美国);TGL16型高速冷冻离心机(湖南湘仪离心机仪器有限公司);IX51型倒置显微镜(日本Olympus公司);HH-ZK1型恒温水浴锅(巩义市予华仪器有限责任公司);MC-300型全自动血细胞分析仪(深圳市美思康公司)。
2 方法 2.1 黄芪和当归提取物的制备设立黄芪、当归、黄芪-当归不同比例(10:1、5:1、2.5:1、1:1、1:2.5、1:5、1:10)配伍。按上述比例分别称取药材,切碎,水回流法提取3次,第1次加入8倍量水,加热保持沸腾提取2 h,冷却后倾出水提取液。后2次加入6倍量水,加热保持沸腾提取1 h,冷却后倾出水提取液。合并3次水提液滤过,将药液60 ℃真空减压浓缩,质量浓度分别为黄芪提取物0.6 g/mL(生药)、当归提取物0.3 g/mL(生药)、黄芪-当归不同比例配伍提取物1.08 g/mL(生药)。在浓缩药液中加入0.1%的苯甲酸钠,然后分装并置−4 ℃保存备用。
2.2 动物模型制备参照文献方法[13]改良,采用ip CTX的方法制备骨髓造血功能抑制模型。小鼠ip给予CTX生理盐水溶液40 mg/kg,连续3 d,对照组ip等量生理盐水。于注射CTX前及注射开始后第1、3、5、7、9、11天眼底静脉丛采血50 μL,以肝素抗凝后用全自动血液细胞分析仪测定外周血白细胞(WBC)、红细胞(RBC)、血红蛋白(HGB)和血小板(PLT)数量,比较两组外周血象下降和自然恢复情况。
2.3 分组及给药ICR小鼠,按照性别、体质量分层后随机分为12组,即对照组、模型组、rhG-CSF(45 μg/kg)对照组、黄芪(6 g/kg)组、当归(3 g/kg)组、黄芪-当归(10:1,黄芪9.8 g/kg+当归0.98 g/kg)组、黄芪-当归(5:1,黄芪9 g/kg+当归1.8 g/kg)组、黄芪-当归(2.5:1,黄芪7.71 g/kg+当归3.08 g/kg)组、黄芪-当归(1:1,黄芪5.4 g/kg+当归5.4 g/kg)组、黄芪-当归(1:2.5,黄芪3.08 g/kg+当归7.71 g/kg)组、黄芪-当归(1:5,黄芪1.8 g/kg+当归9 g/kg)组、黄芪-当归(1:10,黄芪0.98 g/kg+当归9.81 g/kg)组。动物适应性饲养5 d后,对照组每天ig给予生理盐水(10 mL/kg),连续8 d。模型组同上,每天ig给予生理盐水共8 d,并在开始给予生理盐水的第4天起ip给予CTX(40 mg/kg),连续3 d。各给药组每天ig给予不同的中药提取物,共8 d,于开始给药的第4天起ip给予CTX连续3 d。rhG-CSF对照组每天ig给予生理盐水共8 d,于开始给予生理盐水的第4天起ip给予CTX(40 mg/kg),连续3 d,第6天起sc给予rhG-CSF,连续3 d。各组动物在第9天处死并检测。
2.4 检测指标 2.4.1 外周血象测定于末次给药后24 h眼底静脉丛采血50 μL,以肝素抗凝后用全自动血液细胞分析仪检测外周血中的WBC、RBC、HGB、PLT。
2.4.2 血清EPO、TPO、GM-CSF测定末次给药后24 h眼底静脉丛取血1 mL,3 000 r/min离心10 min取血清。按ELISA法测定血清EPO、TPO、GM-CSF水平,操作按说明书进行。
2.4.3 脾指数(SI)计算末次给药后24 h处死小鼠取脾脏,除去表面结缔组织并用滤纸吸干表面血液,迅速称质量,计算脾指数(SI=脾脏质量/体质量)。
2.4.4 骨髓有核细胞(BMNC)计数取右侧股骨,用1 mL PBS充分冲洗骨髓腔,制成细胞悬液,取20 μL细胞液,用2%冰醋酸溶液稀释20倍后,按白细胞计数法计算骨髓单个核细胞数。
2.4.5 骨髓形态学分析骨髓组织切片后HE染色,用Image-ProPlus图像分析软件测定骨髓造血组织面积占骨髓腔面积的百分比。
2.5 统计分析方法数据均采用x±s表示,以SPSS 17.0统计软件进行分析。多组间均数比较采用单因素方差分析,组间两两比较方差齐者用SNK检验,方差不齐者用Dunnett’s T3检验。各药物组的综合效应分析采用多指标综合指数法[14],先将各个检测指标进行单一化处理,计算标准化值,即标准化值=(给药组-模型组)/(对照组-模型组)。然后根据各检测指标反映造血功能的重要性并结合专家意见确定各指标的权重系数,本实验中确定WBC、RBC、HGB、EPO的权重系数为1.7,GM-CSF、PLT和BMNC的权重系数为1.1,TPO、SI的权重系数为0.5。各指标的权重计分=各检测指标的标准化值×权重系数,综合效应(总效应)为各指标权重计分的总和,所求得的总效应值越大表明该药物发挥促造血作用越强。黄芪-当归配伍的相互作用分析,采用多重线性回归分析方法[15]。
3 结果 3.1 CTX诱导的骨髓造血功能抑制小鼠模型外周血象变化的特点注射CTX后,外周血象呈现逐步下降趋势并经一定时间后自主恢复。其中WBC、RBC、PLT在开始注射CTX后第5天左右降到最低值,HGB在开始注射CTX后第7天左右降到最低值。外周血象各项指标在开始注射CTX后第9天,恢复至接近正常水平。结果见图 1。根据以上实验结果,采用连续注射CTX 3 d的方法制备骨髓造血功能抑制模型,以开始注射CTX后第5天即外周血象降至最低值时作为观察时间点。
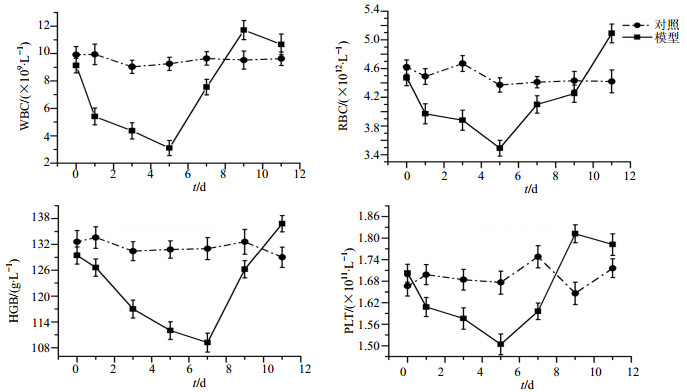
|
图 1 小鼠注射CTX后外周血象的经时变化 Fig.1 Changes of peripheral hemogram of mice along with time followed by CTX injection |
3.2 黄芪-当归不同比例配伍对外周血象的影响
与对照组比较,CTX能显著降低外周血中WBC、RBC、HGB、PLT(P < 0.05、0.01)。与模型组比较,rhG-CSF对照组外周血WBC显著升高(P < 0.01),但外周血RBC、HGB、PLT无显著变化。单用黄芪对降低的外周血象均无显著影响,黄芪-当归(10:1)仅对降低的RBC有轻度促进升高的作用(P < 0.05),而对外周血WBC、HGB、PLT无显著影响。单用当归及黄芪-当归(5:1、2.5:1、1:1、1:2.5、1:5、1:10)配伍对降低的WBC、PLT均有促进其升高的作用(P < 0.05、0.01)。其中黄芪-当归(1:2.5)组WBC显著高于两药物单用及其他配伍组(P < 0.05),黄芪-当归(2.5:1、1:10)配伍PLT升高最明显。单用当归及黄芪-当归(5:1、2.5:1、1:1、1:2.5、1:5、1:10)配伍对降低的RBC都有促进恢复的作用(P < 0.05、0.01),其中黄芪-当归(2.5:1)配伍组RBC升高最为显著。黄芪-当归(5:1、2.5:1、1:2.5、1:5、1:10)配伍对降低的HGB有显著升高作用(P < 0.05、0.01)。结果见表 1。
|
|
表 1 各组小鼠外周血象的比较(x±s, n=14) Table 1 Comparison on peripheral hemogram of mice in each group (x±s, n=14) |
3.3 黄芪-当归不同配伍对造血生长因子、BMNC数量及SI的影响
与对照组比较,CTX能显著降低血清GM-CSF、TPO的量和BMNC数量,升高SI(P < 0.05、0.01)。与模型组比较,rhG-CSF对照组可使血清GM-CSF的量和BMNC数量显著升高(P < 0.05、0.01),但对血清EPO、TPO的量和SI无显著影响(P > 0.05)。单用黄芪仅可升高血清EPO的量,而对GM-CSF、TPO、BMNC和SI无显著影响(P > 0.05)。单用当归对GM-CSF、EPO、TPO、BMNC和SI均无显著影响(P > 0.05)。黄芪和当归配伍组中,黄芪-当归(2.5:1、1:2.5、1:10)配伍对降低的TPO具有显著的升高作用(P < 0.05)。黄芪-当归(5:1、2.5:1、1:1、1:2.5、1:5、1:10)配伍可显著增加BMNC数量、降低SI(P < 0.05、0.01)。黄芪-当归(1:1、1:2.5、1:5、1:10)配伍可使降低的GM-CSF显著升高(P < 0.05、0.01)。除当归和黄芪-当归(1:10)配伍外其他各配伍组对降低的EPO均有升高作用(P < 0.05、0.01)。结果见表 2。
|
|
表 2 各组小鼠造血生长因子水平、BMNC计数及SI的比较(x±s, n=14) Table 2 Comparison on HGF, BMNC, and SI of mice in each group (x±s, n=14) |
3.4 黄芪-当归不同比例配伍对骨髓形态学的影响
与对照组比较,模型组骨髓造血组织面积显著减少(P < 0.01)。与模型组比较,rhG-CSF组骨髓造血组织面积显著增加(P < 0.01)。各药物组与模型组比较,单用当归、黄芪-当归(5:1、2.5:1、1:1、1:2.5、1:5、1:10)配伍组骨髓造血组织面积显著增加(P < 0.01),但以上各药物组间比较差显不显著。单用黄芪及黄芪-当归(10:1)配伍组骨髓造血组织面积无显著变化。结果见表 3和图 2。
|
|
表 3 各组小鼠骨髓造血组织面积的比较(x±s, n=18) Table 3 Comparison of bone marrow hematopoietic tissue area in each group (x±s, n=18) |
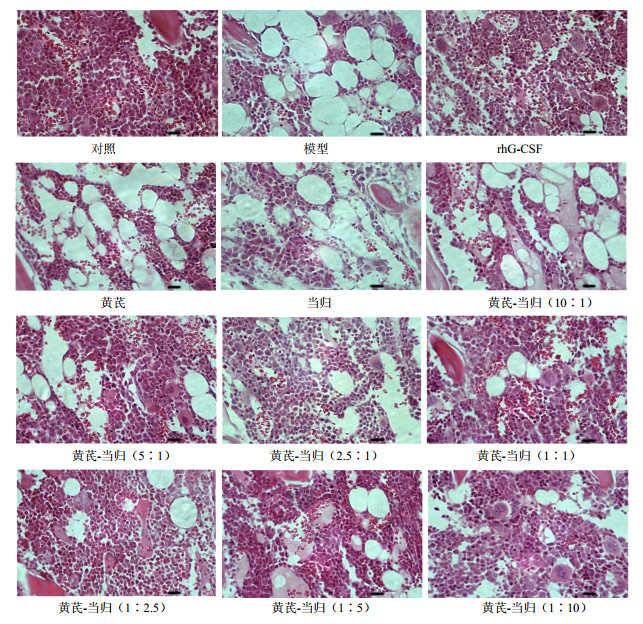
|
图 2 各组小鼠骨髓形态学变化 Fig.2 Morphology changes of bone marrow of mice in each group |
3.5 各组综合效应的比较
各组总效应比较表明黄芪-当归(1:1、1:2.5、1:5)配伍的总效应值最大,黄芪-当归(5:1、2.5:1、1:10)配伍的总效应值次之,单用黄芪及黄芪-当归(10:1)配伍的总效应值最小。说明黄芪-当归(5:1、2.5:1、1:1、1:2.5、1:5、1:10)配伍后发挥促进造血作用大于单用当归、单用黄芪及黄芪-当归(10:1)配伍,且单用当归的药效强于单用黄芪和黄芪-当归(10:1)配伍。黄芪-当归(1:1、1:2.5、1:5)配伍时发挥造血效应最强,单用黄芪、黄芪-当归(10:1)配伍无显著的促进造血作用。结果见表 4。
|
|
表 4 各组各检测指标的权重计分及总效应 Table 4 Weight score of each test index and total effect among groups |
3.6 黄芪-当归配伍促进造血效应相互作用的分析
本实验对黄芪当归配伍促进造血效应的交互作用分析采用多重线性回归分析方法。通过SPSS软件计算得出:①当不考虑黄芪当归的交互作用仅评价两药各自对于药效发挥影响力的大小时,以各组黄芪和当归的用药量为自变量,总效应为因变量进行多重线性回归分析,得到当归、黄芪的标准化偏回归系数分别为1.060和0.458,说明黄芪-当归配伍后,当归发挥补血作用的重要性大于黄芪。②考虑黄芪、当归2种药物的交互作用时,以各组中黄芪和当归的用药量以及交互作用数值三者为自变量,总效应为因变量进行多重线性回归分析,得到黄芪-当归配伍交互作用的标准化偏回归系数为0.795,标准化偏回归系数为正值说明产生了正面的影响。说明黄芪和当归配伍对促造血作用的发挥具有不可忽视的正面影响,即黄芪和当归配伍存在增效作用。
4 讨论CTX是具有显著细胞毒性的化疗药物,在杀灭肿瘤细胞的同时,也具有显著的骨髓抑制作用,可损伤骨髓的造血干细胞,使外周血细胞数量降低[16]。因此,常用CTX来造成动物骨髓造血功能抑制,研究药物对造血功能障碍的防治作用。这种模型因其易操作、造模时间短、经济实惠等特点应用普遍,但关于造模时CTX的用量及时间等还众说不一。因此,本实验对CTX诱导的小鼠骨髓造血功能抑制模型的制作方法进行了改良,发现小鼠ip给予CTX生理盐水溶液40 mg/kg,连续3 d,复制骨髓造血功能抑制模型较为稳定,动物存活率高(一般连用3 d不会引起动物死亡)。且CTX所致的骨髓造血功能抑制在停药后可自主恢复。因此,根据实验结果,建议采用连续注射CTX 3 d的方法,以开始注射CTX后的第5天左右作为观察时间点较为适宜。
中医药常用黄芪配伍当归治疗造血功能低下。但在临床上黄芪和当归用于促进造血治疗的配伍比例还众说纷纭。以往的研究表明,黄芪-当归(5:1)配伍的当归补血汤造血作用最佳。在小鼠骨髓抑制模型,当归补血汤可促进EPO、TPO、GM-CSF表达,促进骨髓造血干细胞/祖细胞增殖[10]。当归补血汤可刺激免疫介导的再生障碍性贫血小鼠造血祖细胞红系爆发型集落形成单位(BFU-E)、粒-巨噬细胞集落形成单位(CFU-GM)增殖,增加骨髓有核细胞数[17],对免疫介导再生障碍性贫血模型小鼠有良好的治疗效果。本实验结果表明,单用黄芪对骨髓造血功能抑制小鼠无显著的促造血作用。单用当归具有一定的促造血作用,可促进外周血象的恢复,使骨髓造血组织面积增加,但对造血生长因子的量和BMNC数量无显著影响。推测当归可能通过促进血细胞进入外周血液而促进了外周血象的恢复,但其确切机制有待进一步阐明。在黄芪和当归不同比例配伍中,黄芪-当归(5:1、2.5:1、1:1、1:2.5、1:5、1:10)均可升高血RBC、WBC、PLT数,增加血中造血生长因子的量、BMNC和骨髓造血组织面积,降低SI,尤其是黄芪-当归(1:1、1:2.5、1:5)配伍的促造血作用最强。表明黄芪当归配伍时,发挥促造血作用的药物主要是当归,黄芪配伍当归可促进当归的促造血作用;二者配伍对骨髓造血功能抑制的促造血效应具有增效作用,其配伍比例并不是传统的黄芪-当归5:1配伍为最佳,而是在1:1、1:2.5、1:5范围内配伍时对促造血效应具有增效作用。
研究表明,黄芪-当归5:1配伍的当归补血汤中的毛蕊异黄酮单独应用无明显的促红细胞生成和促成骨效应,但将当归补血汤中的毛蕊异黄酮去除则其促红细胞生成能力和促成骨效应均显著降低,提示毛蕊异黄酮对当归补血汤具有增效作用[18]。当归来源的阿魏酸对当归补血汤具有正性调节作用,可提高黄芪活性成分的溶出,增强当归补血汤的功效[19]。阿魏酸可促进黄芪活性成分毛蕊异黄酮和芒柄花素在体外Caco-2细胞的通透性,促进药物吸收[20]。在失血所致的大鼠贫血模型和正常大鼠中,口服黄芪-当归5:1配伍的当归补血汤后,其5个主要化学成分阿魏酸、咖啡酸、毛蕊异黄酮苷、芒柄花苷和黄芪甲苷在肝脏中的量显著高于其他组织,且贫血大鼠组织中这些有效成分的量显著高于正常大鼠,表明当归补血汤的这些成分可改善血虚动物的组织灌流[21]。因此,中药配伍后通过影响有效成分的溶出、药物吸收代谢及作用靶点,起到协同增效作用。本实验采用综合效应分析方法对黄芪当归配伍补血作用的分析也表明,黄芪-当归配伍后的补血作用大于单用的当归,以1:1、1:2.5、1:5的综合效应最强。进一步采用多重线性回归分析方法分析黄芪和当归配伍补血效应的相互作用,结果表明,黄芪当归配伍存在相互作用,二者配伍对促造血作用的发挥具有不可忽视的正面影响,即黄芪和当归配伍存在增效作用。提示在应用黄芪和当归配伍治疗骨髓造血功能抑制时,按此比例配伍将可能取得较好的效应。推测其原因可能是二者在此比例范围配伍时,通过增加药物有效成分的溶出、促进药物吸收及作用于多靶点,发挥协同增效作用。
血细胞的生成是多能造血干细胞(HSC)在造血调控网络控制下,增殖分化成各种成熟血细胞的动态平衡过程。体内主要的造血调节因子是造血生长因子(HGF),它们刺激不同分化时期、不同类型的造血干细胞,促进其增殖分化,HGF主要有GM-CSF、EPO、TPO等,造血过程即是造血细胞在多种HGF的调控下进行的[22]。研究表明,黄芪和当归配伍组成的当归补血汤可促进体外培养的Hep3B细胞表达EPO[23]。给肾成纤维细胞HEK293T转染含有缺氧反应元件(HRE)的质粒,研究发现DBT可促进缺氧诱导因子-1α(HIF-1α)的表达,并促进EPO的表达,其作用与丝裂原活化蛋白激酶(MAPK)信号途径有关[24]。本研究也表明,单用黄芪或单用当归对HGF的影响较小。黄芪和当归配伍可不同程度地使血中HGF的量增加,提示黄芪和当归配伍促进骨髓造血功能抑制小鼠外周血象恢复的作用与其促进造血生长因子的合成和分泌,继而促进骨髓造血干细胞和祖细胞向血细胞的增殖分化有关。因此,促进HGF表达是黄芪和当归合理配伍促造血作用的可能机制之一。
| [1] | Yang X, Huang C G, Du S Y, et al. Effect of Danggui Buxue Tang on immune-mediated aplastic anemia bone marrow proliferation mice[J]. Phytomedicine, 2014, 21(5): 640–646. DOI:10.1016/j.phymed.2013.10.018 |
| [2] | Liu Y, Zhang H G, Li X H. A Chinese herbal decoction, Danggui Buxue Tang, improves chronic fatigue syndrome induced by food restriction and forced swimming in rat[J]. Phytother Res, 2011, 25(12): 1825–1832. DOI:10.1002/ptr.v25.12 |
| [3] | Li Y D, Ma Y H, Zhao J X, et al. Protection of ultra-filtration extract from Danggui Buxue Decoction on oxidative damage in cardiomyocytes of neonatal rats and its mechanism[J]. Chin J Integr Med, 2011, 17(11): 854–859. DOI:10.1007/s11655-011-0897-6 |
| [4] | Ke H L, Zhang Y W, Zhou B F, et al. Effects of Danggui Buxue Tang, a traditional Chinese herbal decoction, an high glucose-induced proliferation and expression of extracellular matrix proteins in glomerular mesangial cells[J]. Nat Prod Res, 2012, 26(11): 1022–1026. DOI:10.1080/14786419.2010.546796 |
| [5] | Gao J, Feng L J, Huang Y, et al. Total glucosides of Danggui Buxue Tang attenuates bleomycin-induced pulmonary fibrosis via inhibition of extracellular matrix remodlling[J]. J Pharm Pharmacol, 2012, 64(6): 811–820. DOI:10.1111/j.2042-7158.2012.01490.x |
| [6] | Wang C C, Cheng K F, Lo W M, et al. A randomized, double-blind, multiple-dose escalation study of a Chinese herbal medicine preparation (Dang Gui Buxue Tang) for moderate to severe menopausal symptoms and quality of life in postmenopausal women[J]. Menopause, 2013, 20(2): 223–231. |
| [7] | Xie Q F, Xie J H, Dong T T, et al. Effect of a derived herbal recipe from an ancient Chinese formula, Danggui Buxue Tang, on ovariectomized rats[J]. J Ethnopharmacol, 2012, 144(3): 567–575. DOI:10.1016/j.jep.2012.09.041 |
| [8] | Tzeng T F, Liou S S, Liu I M. The selected traditional Chinese medicinal formulas for treating diabetic nephropathy:perspective of modern science[J]. J Tradit Complement Med, 2013, 3(3): 152–158. DOI:10.4103/2225-4110.114893 |
| [9] | Zhang W L, Zheng K Y, Zhu K Y, et al. Chemical and biological assessment of Angelica herbal decoction:comparison of different preparations during historical applications[J]. Phytomedicine, 2012, 19(11): 1042–1048. DOI:10.1016/j.phymed.2012.07.009 |
| [10] | Yan S, Xie Y, Zhu B, et al. Effect comparison of different formulation of Dang-Gui-Bu-Xue-Tang on myelosuppression mouse[J]. Asian Pac J Trop Med, 2011, 4(7): 556–559. DOI:10.1016/S1995-7645(11)60145-4 |
| [11] | 史旭芹, 尚尔鑫, 唐于平, 等. 基于响应曲面分析法对当归-黄芪配伍养血补血功效相互作用研究[J]. 药学学报, 2012, 47(10):1375–1383. |
| [12] | 陈凌波, 张珂胜, 黄小平, 等. 黄芪当归配伍对骨髓造血功能抑制小鼠造血祖细胞增殖的影响[J]. 中草药, 2016, 47(24):4395–4400. |
| [13] | 田杰, 于沛, 孙文宣, 等. 环磷酰胺对正常小鼠骨髓造血细胞的影响及其作用机制[J]. 中国实验血液学杂志, 2012, 20(6):1316–1321. |
| [14] | 马宏跃, 李伟霞, 尚尔鑫, 等. 基于抗氧化活性的不同制法当归-川芎药对配伍比例研究[J]. 中国临床药理学与治疗学杂志, 2010, 15(6):631–635. |
| [15] | Sun R Y, Hu L P. Multiple linear regression analysis methods for complex random sampled data and their application[J]. Mil Med Sci, 2015, 39(5): 380–385. |
| [16] | 彭仕友, 何小解, 易著文, 等. 微囊化儿茶素对环磷酰胺致免疫低下小鼠的免疫调节作用[J]. 中国组织工程研究与临床康复, 2009, 13(21):4123–4127. |
| [17] | Zhang W L, Choi R C, Zhan J Y, et al. Can Hedysari Radix replace Astragali Radix in Danggui Buxue Tang, a Chinese herbal decoction for woman aliment?[J]. Phytomedicine, 2013, 20(12): 1076–1081. DOI:10.1016/j.phymed.2013.04.016 |
| [18] | Gong A G, Li N, Lau K M, et al. Calycosin orchestrates the functions of Danggui Buxue Tang, a Chinese herbal decoction composing of Astragali Radix and Angelica Sinensis Radix:An evaluation by using calycosin-knock out herbal extract[J]. J Ethnopharmacol, 2015, 168: 150–157. DOI:10.1016/j.jep.2015.03.033 |
| [19] | Zheng K Y, Zhang Z X, Du C Y, et al. Ferulic acid enhances the chemical and biological properties of astragali radix:a stimulator for danggui buxuetang, an ancient Chinese herbal decoction[J]. Planta Med, 2014, 80(2/3): 1591–1564. |
| [20] | Zheng K Y, Choi R C, Guo A J, et al. The membrane permeability of Astragali Radix-derived formononetin and calycosin is increased by Angelicae Sinensis Radix in Caco-2 cells:a synergistic action of an ancient herbal decoction Danggui Buxue Tang[J]. J Pharm Biomed Anal, 2012, 70(11): 671–679. |
| [21] | Shi X, Tang Y, Zhu H, et al. Comparative tissue distribution profiles of five major bio-active components in normal and blood deficiency rats after oral administration of Danggui Buxue Decoction by UPLC-TQ/MS[J]. J Pharm Biomed Anal, 2014, 88(25): 207–215. |
| [22] | Dainiak N. Hematologic consequences of exposure to ionizing radiation[J]. Exp Hematol, 2002, 30(6): 513–518. DOI:10.1016/S0301-472X(02)00802-0 |
| [23] | Gao Q T, Cheung J K, Choi R C, et al. A Chinese herbal decoction prepared from Radix Astragali and Radix Angelicae Sinensis induces the expression of erythropoietin in cultured Hep3B cells[J]. Planta Med, 2008, 74(4): 392–395. DOI:10.1055/s-2008-1034322 |
| [24] | Zheng K Y, Choi R C, Xie H Q, et al. The expression of erythropoietin triggered by danggui buxue tang, a Chinese herbal decoction prepared from Radix Astragali and Radix Angelicae Sinensis, is mediated by the hypoxia-inducible factor in cultured HEK293T cells[J]. J Ethnopharmacol, 2010, 132(1): 259–267. DOI:10.1016/j.jep.2010.08.029 |
 2017, Vol. 48
2017, Vol. 48


