2. 南京中医药大学 江苏省中药炮制重点实验室, 江苏 南京 210023
2. Jiangsu Provincial Key Laboratory of Chinese Medicine Processing, Nanjing University of Chinese Medicine, Nanjing 210023, China
五味子为木兰科植物五味子Schisandra chinensis (Turcz.) Baill的成熟干燥果实,始载于《神农本草经》,是我国常用传统中药。五味子酸、苦、甘、辛、咸五味俱全,故具有收敛固涩、益气生津、补肾宁心之功效,用于久咳虚喘、梦遗滑精、自汗、盗汗、津伤口渴、内热消渴、心悸失眠等症[1]。现代研究表明,五味子有效成分主要包括木脂素、多糖、挥发油、有机酸、脂肪油、氨基酸、色素、鞣质等[2-4],药理作用涉及中枢神经系统、心血管系统、消化系统、生殖系统以及泌尿系统等方面。目前,文献报道的五味子治疗急性酒精性肝损伤(alcoholic liver disease,ALD)作用机制的研究大多数是从药理作用、肝药酶等分子角度进行的[5-8]。从胆汁代谢组学的视角探讨醋制对中药五味子的影响鲜有报道。本课题组经前期研究发现,五味子醋制后可以促进大鼠的胆汁分泌,其胆汁排泄总量与生五味子组相比具有显著性差异,本实验以胆汁为研究对象,从代谢的角度研究药物对肝脏系统的扰动,采用超高效液相色谱-四级杆飞行时间质谱(UPLC-Q/TOF-MS)分析方法及模式识别的统计学分析方法,研究生、醋五味子提取物干预后对大鼠胆汁中代谢物组的影响,挖掘潜在的生物标志物,寻找五味子治疗ALD可能的作用机制,以期阐述五味子醋制后保肝作用增强的科学内涵。
1 材料Ekspert ultra LC 100-XL超高效液相系统,包括在线脱气机、四元泵、自动进样器、柱温箱;AB Sciex TripleTOF 5600飞行时间质谱仪(美国AB Sciex公司),配有Analyst® TF1.6工作站、PeakView、MarkerView分析软件等;FA1104型电子分析天平(上海精密科学仪器有限公司);LDZ5-2型全自动离心机(北京医用离心机厂);KQ-500B型超声波清洗器(昆山市超声仪器有限公司);Milli-Q Gradient A10超纯水器(Millipore,Bedford,MA,美国);涡旋振荡混合器(上海沪西分析仪器厂)。
乙腈(HPLC级,EMD Millipore公司),甲酸(HPLC级,上海凌峰化学试剂股份有限公司),甲醇[分析纯,禹王试剂有限公司(山东)提供];天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)均由南京建成生物工程研究所提供;活性氧(ROS)购于南京奥青生物技术有限公司;羧甲基纤维素钠[CMC-Na,化学纯,国药集团(上海)化学试剂有限公司];56°红星二锅头(北京红星股份有限公司,生产日期:2015年9月)。五味子药材由安徽丰原铜陵中药饮片有限公司提供,经南京中医药大学陆兔林教授鉴定为木兰科植物五味子Schisandra chinensis (Turcz.) Baill的成熟干燥果实。
SPF级雄性SD大鼠,约8周龄,体质量200~220 g,由上海斯莱克实验动物有限责任公司提供,合格证号SCXK(沪)2015-0005。实验前于南京中医药大学实验动物中心适应饲养1周,以适应本实验室环境,给予标准光照周期(12 h光照、12 h黑暗),实验室温度维持20~25 ℃,相对湿度控制在65%左右。
2 方法 2.1 生、醋五味子饮片及提取液的制备生、醋五味子以《中国药典》2015版一部五味子“炮制”项下收载的炮制方法加工炮制即得。生品:除去杂质,用时捣碎,即可。醋品:取净五味子,加入20%醋拌匀,闷润1.5 h,置适宜的密闭容器内,蒸制5 h,取出,晾凉,干燥。加工炮制所得五味子饮片加85%乙醇回流提取2次,合并提取液,减压回收乙醇,得五味子稠浸膏,最后将浸膏加0.5% CMC-Na溶液研磨制成生、醋五味子醇提取液,生药比质量浓度为1.0 g/mL。所得受试药物−4 ℃条件下保存,备用。生、醋五味子醇提取液中主要含有木脂素类成分,见表 1。
|
|
表 1 生、醋五味子中8种木脂素类成分定量分析(n=3) Table 1 Content of eight lignans between raw and vinegar processed Schisandra chinensis(n=3) |
2.2 分组与给药
大鼠常规饲养1周适应环境后随机分为对照组、模型组、生五味子组、醋五味子组,模型组12只,其余各组每组8只。除对照组外,每组大鼠每天15:00 ig 56°二锅头(10 g/kg);在造模的同时生五味子组、醋五味子组每天9:00 ig给予五味子醇提取液,给药剂量按生药计为10 g/kg[9-10];对照组和模型组ig给予等量的CMC-Na溶液。
2.3 大鼠胆汁及肝组织样本采集连续给药12 d,并在此过程的第0、4、8、12天取模型组大鼠肝脏做病理切片,进行肝损伤病理评价。于末次给药0.5 h后ip 10%水合氯醛(3 mL/kg)麻醉后,迅速打开腹腔,仰位固定,做胆总管插管引流术,并以生理盐水纱布覆盖腹部。插管成功后,收集12 h内大鼠胆汁,−80 ℃冰箱保存备用。取出所有大鼠肝脏组织,−80 ℃冰箱保存,用于肝组织ALT、AST及ROS的活性测定(试剂盒方法)。
2.4 大鼠胆汁前处理精密吸取胆汁样品400 μL,置5 mL离心管中,分别加甲醇3.6 mL,涡旋30 s,离心10 min(12 000 r/min),取上清液于EP管中,4 ℃条件下氮气吹干,再次分别加入3.6 mL甲醇,涡旋30 s,离心10 min(12 000 r/min),取上清液于EP管中,4 ℃条件下氮气吹干,最后以200 μL初始流动相复溶,涡旋30 s,离心5 min(12 000 r/min),取上清液作为胆汁样品供试液。
2.5 UPLC-Q/TOF-MS分析 2.5.1 色谱条件Agilent ZorBax SB-C18反相色谱柱(50 mm×2.1 mm,1.8 μm),流动相0.1%甲酸水(A)-乙腈(B),梯度洗脱条件:0~2 min,15%→21% B;2~4 min,21% B;4~5 min,21%→23% B;5~8 min,23% B;8~9 min,23%→30% B;9~13 min,30% B;13~16 min,30%→37% B;16~20 min,37% B;20~22 min,37%→100% B;22~25 min,100% B;25~27 min,100%→15% B;体积流量1.0 mL/min,进样体积2 μL,柱温25 ℃。
2.5.2 Q/TOF-MS质谱条件离子化模式为电喷雾正、负离子模式(ESI+/−),正负离子源电压分别为5 000 V/−4 500 V,离子源温度为550 ℃,裂解电压(DP)分别为60 V/−55 V,碰撞能量(CE)分别为45 eV/−40 eV,碰撞能量扩展(CES)分别为15 eV/−20 eV。雾化气体为氮气(N2),雾化气(gas1)、辅助气(gas2)压力均设定为379.225 kPa(55 psi),气帘气(CUR)为241.325 kPa(35 psi)。一级质谱母离子扫描范围为m/z 100~1 000,子离子扫描范围为m/z 50~1 000,开启动态背景扣除(DBS)。数据采集工作站为Analyst® TF 1.6 software(AB SCIEX,Foster City,CA)。
2.5.3 数据分析各样品组UPLC-Q/TOF-MS图谱及数据导入MarkerView软件进行峰提取、峰匹配及归一化前处理,进而将前处理得到的数据通过SIMCA-P 14.1软件进行模式识别及判别分析,并进行t检验单维统计分析得到差异代谢产物,进而采用Analyst® TF 1.6 software工作站的PeakView软件(包括XIC Manager、BPC、DBS、EPL及MDF等功能)对差异代谢产物的色谱峰进行识别和峰匹配,对照标准谱图鉴定潜在生物标志物种类,最后与对照组、模型组进行t检验单维统计分析排除给药前后不发生显著变化的代谢物,最终确认潜在生物标志物。
3 结果 3.1 模型成功判定随着造模的进行,肝脏细胞出现水样变性,细胞肿大,胞浆疏松;造模后期,肝脏细胞充满大小脂滴,汇管区及细胞间隙出现大量炎性细胞,有的甚至出现肝脏点状灶性坏死;肝小叶结构出现破坏以及肝索排列不规则,而且出现大量的空泡病变情况(图 1)。并对各组大鼠进行肝组织效应评价(AST、ALT、ROS),结果(表 2)显示,模型组与对照组比较具有极显著性差异,表明模型复制成功。
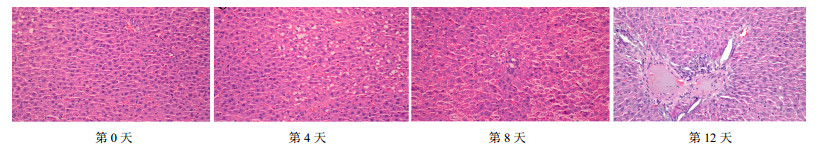
|
图 1 模型组造模不同时间大鼠肝脏病理学切片观察 Fig.1 Pathological photographs of rat liver in model group at different time points |
|
|
表 2 各组大鼠肝组织中AST、ALT、ROS活力变化(x±s, n=8) Table 2 Changes of AST, ALT, and ROS activities in liver tissues of rats in each group (x±s, n=8) |
3.2 胆汁样品UPLC-Q/TOF-MS分析
各组大鼠的胆汁样品UPLC-Q/TOF-MS总离子流图见图 2。经直观分析,各组大鼠胆汁代谢物谱存在较明显差异。模型组与对照组、醋五味子组与生五味子组相比,总离子流图有明显差异,而且醋五味子组的总离子流图与对照组最为相似,提示醋五味子组大鼠的胆汁代谢水平更趋于正常大鼠。在本实验条件下,8~24 min有大量的物质被洗脱出,生、醋五味子代谢物谱的组间差异还需进一步分析。
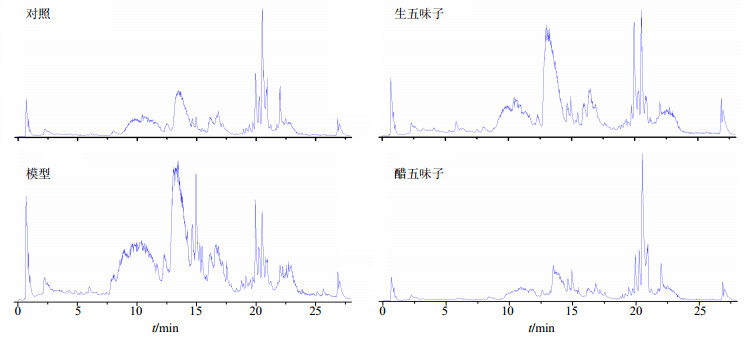
|
图 2 正离子模式下大鼠胆汁样品UPLC-Q/TOF-MS总离子流图 Fig.2 TIC chromatograms of rats bile samples in positive ion mode |
3.3 模式识别与判别分析
为了使样本的分析结果更加直观,首先采用主成分分析(PCA)进行LC-MS复杂数据的降维处理,以便直观区分各组样本差异。将对照组、模型组、生五味子组和醋五味子组胆汁代谢物的UPLC-Q/TOF-MS原始图谱及数据导入MarkerView软件进行峰匹配及归一化等前处理,将前处理得到的数据导入SIMCA-P 14.1软件进行模式识别,绘制反映组间离散程度的3D-Score scatter plot散点图,见图 3,任一点代表一个对应的样本,可以发现给药组及模型组与对照组间的代谢轮廓呈明显分离趋势,提示给药组及模型组与对照组的代谢物谱存在组间差异;同时生、醋五味子组之间的代谢轮廓也呈分离趋势,提示2组代谢物谱存在差异。为进一步得到生、醋五味子组间的差异代谢物,分别对对照组与模型组、生五味子组与醋五味子组进行了偏最小二乘判别分析(OPLS-DA,SIMCA-P 14.1软件),绘制的S-plot图见图 4,每一个点代表一个化合物,越靠近“S”两端的物质就是组间差异成分。
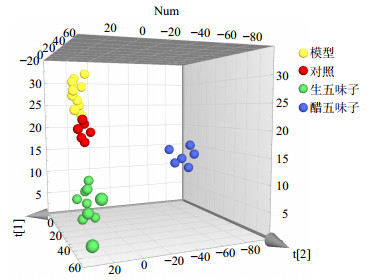
|
图 3 大鼠胆汁样品组PCA三维得分图 Fig.3 PCA 3D-Score scatter plot of UPLC-Q/TOF-MS data from bile samples |
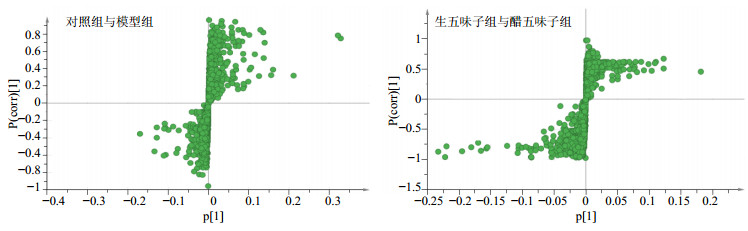
|
图 4 大鼠胆汁样品S-plot图 Fig.4 S-plot of UPLC-Q/TOF-MS data from bile samples |
3.4 生、醋五味子组间差异代谢物的鉴定
生物标志物(差异代谢物)是能够客观反映生物体的生理、病理变化或外界环境刺激的内源性小分子物质,相对分子质量一般小于1 000。为了进一步明确胆汁代谢物在生、醋五味子组间差异及寻找具有显著性差异的生物标志物,采用单维统计分析(独立样本t检验)对组间数据进行统计学分析,首先筛选出对照组与模型组间具有显著性差异的36个代谢物(P < 0.05,VIP > 1.0),见表 3;最终从上述36个差异物中鉴定出生、醋五味子组间具有显著性差异代谢物9个,提取相应离子峰进行比对,各成分按顺序排列为潜在生物标志物,见表 4。代谢产物筛选的具体步骤:1)基于对照组与模型组S-plot图中的VIP值,从大到小的顺序排序所有检测的质谱值,VIP值越大,说明对该疾病的贡献越大,初步选定为差异成分;2)在生、醋五味子组中跟踪上述的差异成分,筛选出有显著性差异的成分(t检验),这些差异代谢物最终被选定为结构鉴定的对象;3)采用AB Sciex的PeakView软件进行峰识别,对照METLIN、HMDB、Chemspider等化合物在线数据库,设定误差值小于5×10−6,综合分析鉴定了其中的8个潜在生物标志物。这些潜在的生物标志物主要包括卵磷脂、胆汁酸和甘油酸三酯等。说明ALD模型组大鼠的脂质代谢、胆酸代谢和氨基酸代谢存在异常。
|
|
表 3 对照组与模型组间胆汁代谢物中具显著性差异成分 Table 3 Summary of differential metabolites between control and model groups |
3.5 代谢通路分析
本实验鉴定出的8种潜在生物标志物的主要代谢通路和生物功能见表 4,结合MetPA等数据库分析可知这些潜在生物标志物主要与机体的脂质代谢途径相关,包括磷脂代谢、胆汁酸代谢和脂肪转化过程。由此推测五味子醋制后可能通过调控脂质代谢过程,促进脂肪转化,提高机体抗氧化能力而达到增强抗肝损伤的功效,其具体作用机制与信号通道需进一步研究。
|
|
表 4 鉴定的8个潜在生物标志物及其相关代谢途径 Table 4 Identification and related metabolic pathways of eight potential biomarkers |
3.5.1 胆汁酸代谢、脂代谢
胆汁酸是机体内胆固醇代谢的最终产物。异常胆汁酸的成分变化和肝损伤有密切联系[11-12]。模型组大鼠胆汁中12-酮基脱氧胆酸(12-ketodeoxycholic acid)和3b, 17a-dihydroxy-5a-androstane(一种类固醇激素)浓度明显高于对照组,提示酒精性肝损伤模型大鼠体内胆汁酸代谢受到明显干扰,从而引起脂代谢功能障碍。由于肝功能损伤,胆红素分泌增加,肝细胞合成初级胆汁酸增加,促进了12-酮基脱氧胆酸和3b, 17a-dihydroxy-5a-androstane的排出量,使得其在胆汁中检测到的量也增加。因此,肝脏损伤越严重,其在胆汁中的量也越高[13]。与模型组相比,生、醋五味子组大鼠体内12-酮基脱氧胆酸和3b, 17a-dihydroxy-5a-androstane水平显著降低,且醋五味子组降低更为明显,提示生、醋五味子均可以通过调节胆汁酸代谢,产生调脂效果,干预肝损伤,且醋品疗效更佳。
3.5.2 氨基酸代谢本实验中肝损伤模型大鼠胆汁中5-膦酰-L-赖氨酸(5-phosphonooxy-L-lysine)浓度明显升高,预示着酒精致肝损伤模型与氨基酸代谢紊乱密切相关。5-膦酰-L-赖氨酸为羟赖氨酸激酶和5-磷酸羟基-L-赖氨酸磷酸酶的基质,而羟赖氨酸激酶和5-磷酸羟基-L-赖氨酸磷酸酶是调节蛋白赖氨酸磷酸化、控制细胞生长和分化所必须的酶。当发生肝损伤或病变时,由于肝功能出现障碍,肝细胞内氨基酸代谢水平降低,导致胆汁、血液中某些氨基酸(赖氨酸、酪氨酸、色氨酸等)浓度升高,同时机体本身对氨基酸的摄取能力降低[14-15]。与模型组相比,醋五味子组大鼠体内5-膦酰-L-赖氨酸水平显著降低,而生五味子组5-膦酰-L-赖氨酸水平无显著变化,说明醋五味子可以显著调节氨基酸代谢干预肝损伤。
3.5.3 磷脂代谢溶血磷脂酰胆碱和磷脂酰甘油酯均为机体内源性磷脂类成分,溶血磷脂酰胆碱是低密度脂蛋白的主要成分,被认为是影响血管内皮功能的重要因素之一,在动脉粥样硬化和炎症疾病中有重要作用。一般而言,它在细胞或组织中的量很少,如果浓度过高则会对细胞的膜系统造成伤害[16]。磷脂酰甘油酯是甘油磷脂之一,是构成生物膜脂双层的基本骨架,研究发现肝源性磷脂酰甘油酯对肝癌细胞的生长具有明显的抑制作用,且能诱导其发生凋亡。溶血磷脂酰胆碱和磷脂酰甘油酯的代谢调节贯穿于炎症的发生和消退过程,是炎症发生、消退过程中的重要的脂质标记物[17]。由结果可推测,五味子醋制后可以显著下调溶血磷脂酰胆碱的水平,上调磷脂酰甘油酯水平,调控机体的磷脂代谢,从而产生优于生五味子的疗效,也可能是五味子“醋制入肝”的重要机制之一。
3.5.4 脂肪酸代谢13-羟酸(13-hydroxyeicosatetraenoic acid,13-HETE)是15-脂氧合酶(15-Loxs)的主要代谢物之一,是PPARR的内源性配体。它可以抑制细胞增殖,并在几种类型的人类癌症中诱导细胞凋亡。13-HETE也是在大鼠肝微粒中花生四烯酸的代谢物,并且是在许多细胞类型中由花生四烯酸的酶介导的羟基化形成的脂加氧酶(LPO)代谢产物(HETEs及其前体HPETEs和LTs)[18]。13-HETE的代谢水平能够反映机体中花生四烯酸、CYP450、垂体生长激素(PGH)及脂氧合酶等的代谢水平。Tracylglycerol(64:2)是一种重要的三酰甘油,是极低密度脂蛋白(VLDL)和乳糜微粒的主要成分,在能量代谢和膳食脂肪转运中发挥重要作用。乙酰左旋肉碱(L-acetylcarnitine)能促进乙酰辅酶A进入哺乳动物线粒体基质参与脂肪酸氧化。除了它的代谢作用,乙酰左旋肉碱(ALC)还具有独特的神经保护、神经调节和神经营养性作用,这可能在对抗各种疾病中发挥重要作用。与模型组相比,生、醋五味子组均能上调13-HETE水平,但醋五味子效果更为显著;醋五味子组三酰甘油(TG)的量显著低于模型组,提示醋五味子还可以通过降低TG的量来保护肝脏[19];相对于模型组,生、醋五味子组的ALC的量均有所降低,推测其是通过维持机体氧化-抗氧化作用平衡而达到保护肝脏的效果。
4 讨论五味子经炮制增效已为大量临床和实验所验证,尤其是其醋制增强保肝作用机制,依然还是研究的热点及难点。效应的变化与炮制后化学成分改变有着密切联系,而中药多成分、多靶点的特征,使得效应物质及机制难以直接阐明,代谢组学从药物经体内代谢和药效作用后的生物标志物入手,通过分析不同状态下生物标志物的变化规律,探讨中药效应变化的机制。本研究基于UPLC-Q/TOF-MS技术的代谢组学方法,采用单维统计与多元统计相结合,MarkerView、PeakView软件与网络数据库相比对的数据分析方法,分析醋制前后五味子醇提取液对大鼠胆汁代谢物谱的影响,鉴定得溶血磷脂酰胆碱、磷脂酰甘油酯12-酮基脱氧胆酸、tracylglycerol (64:2)、13-羟酸等8个与酒精性肝损伤相关的潜在生物标志物,并对其参与的代谢通路加以详细分析。本课题组目前正采用不同的分析技术对血浆、尿液、胆汁、肝组织等进行代谢组学的整体研究,并对其进行进一步的分析和报道。
| [1] | 中国药典[S].二部.2015. |
| [2] | 李伟, 刘亚丽, 宋永贵, 等. UPLC-Q-TOF-MSE结合OPLS-DA模式快速鉴定南、北五味子化学成分与识别差异标志物[J]. 中草药, 2015, 46(15):2212–2218. |
| [3] | 史琳, 王志成, 冯叙桥. 五味子化学成分及药理作用的研究进展[J]. 药物评价研究, 2011, 34(3):208–212. |
| [4] | 汪艳群.五味子多糖的分离、结果鉴定及免疫活性研究[D].沈阳:沈阳农业大学, 2012. |
| [5] | 徐丽华, 黄芳, 孙萌, 等. 南北五味子镇静催眠活性部位共有成分的分析[J]. 分析化学研究报告, 2009, 6(37):828–834. |
| [6] | 任丽佳, 李林, 殷放宙, 等. 五味子抗肿瘤活性成分及作用机制研究进展[J]. 中国药理学通报, 2012, 28(1):140–142. |
| [7] | 朱力杰.北五味子总三萜、木脂素对酒精性肝损伤的保护作用及其机制的研究[D].沈阳:沈阳农业大学, 2014. |
| [8] | 王春梅, 李贺, 李生, 等. 北五味子木脂素对小鼠酒精性肝损伤的保护作用[J]. 食品科学, 2014, 35(13):262–265. |
| [9] | 周渊, 毛春芹, 胡俊扬, 等. 液-质联用研究五味子醇甲、五味子甲素和五味子乙素在大鼠体内的组织分布[J]. 药物分析杂志, 2013, 33(7):1121–1126. |
| [10] | 李惠连, 季德, 毛春芹, 等. LC-MS测定大鼠血浆中五味子的3个木脂素成分及其药动学研究[J]. 中国药理学通报, 2013, 29(9):1313–1317. |
| [11] | 张莉, 孟梅霞, 安军民, 等. 基于UPLC-MS/MSE方法研究马兜铃酸肾病大鼠的血清代谢组学[J]. 药物分析杂志, 2014, 34(11):1948–1953. |
| [12] | Yao W F, Gu H W, Zhu J J, et al. Integrated plasma and urine metabolomics coupled with HPLC/QTOF-MS and chemometric analysis on potential biomarkers in liver injury and hepatoprotective effects of Er-Zhi-Wan[J]. Anal Bioanal Chem, 2014, 406(28): 7367–7378. DOI:10.1007/s00216-014-8169-x |
| [13] | Adachi Y, Nanno T, Itoh T, et al. Determination of individual serum bile acids in chronic liver diseases:fasting levels and results of oral chenodeoxycholic acid tolerance test[J]. Gastroenterol Jpn, 1988, 23(4): 401–407. |
| [14] | Morgan M Y, Marshall A W, Milsom J P, et al. Plasma aminoacid patterns in liver disease[J]. Gut, 1982, 23(5): 362–370. DOI:10.1136/gut.23.5.362 |
| [15] | Rosen H M, Yoshimura N, Fischer J E. Plasma amino acid patterns in hepatic encephalopathy of differing etiology[J]. Gastroenterology, 1977, 72(3): 483–487. |
| [16] | 陈友琴, 陈怀卿, 吴立志. 溶血磷脂酰胆碱对内皮细胞表面粘附分子表达的影响[J]. 生物医学工程学杂志, 2000, 17(2):139–142. |
| [17] | 赵丽丽.NSAIDs干预RAW264.7细胞炎症模型甘油磷脂代谢的UPLC-Q/TOF MS分析[D].广州:广东药学院, 2012. |
| [18] | 袁成凌, 姚建铭, 余增亮. 花生四烯酸及其代谢物的生物学作用[J]. 中国药物化学杂志, 2000, 10(1):75–78. |
| [19] | 段荟, 付成效, 邹瑾. 黄芪对酒精性肝损伤小鼠MDA、GSH和TG的影响及肝脏保护作用的研究[J]. 陕西医学杂志, 2010, 39(3):271–273. |
 2017, Vol. 48
2017, Vol. 48


