2. 山西大学化学化工学院, 山西 太原 030006;
3. 九芝堂股份有限公司, 湖南 长沙 410205
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Jiuzhitang Co., Ltd., Changsha 410205, China
驴胶补血颗粒可以改善骨髓造血功能,但其作用机制尚不十分清楚。
溶血性贫血是由于红细胞存活周期缩短,破坏过多过快,骨髓造血代偿能力不足时发生的一种常见的贫血类型[3]。由乙酰苯肼诱导的溶血性贫血模型比较成熟且具有代表性,目前已应用于四逆汤[4]、当归-川芎药对[5]以及复方阿胶浆[6]等中药复方的补血作用的研究中,但在驴胶补血颗粒的补血作用机制研究方面报道较少。
代谢组学是系统生物学的重要组成部分,能够及时、灵敏、真实地表征在各种外界因素刺激以及病理状态下生物体功能的整体应答与调节[7,8]。这与中药治疗的整体动态性原则相一致,在中药方剂多组分、多靶点整体药效评价以及作用机制研究中具有明显优势[9]。其中,1H-NMR代谢组学是最常用的方法之一,具有分析速度快、选择性好、样品无破坏性、无偏向性等优点[10]。本课题组前期已将其应用于补中益气汤[11,12]、逍遥散[13]、京尼平[14,15]等药物的治疗效果评价及作用机制研究中。本研究采用1H-NMR代谢组学方法从大鼠血清中代谢产物的变化及其规律方面探讨驴胶补血颗粒的补血作用机制,为该药的合理使用提供科学依据。
1 材料与方法 1.1 药品、试剂及仪器乙酰苯肼(上海生工生物工程股份有限公司,规格25 g/瓶,批号RS1014S4011Z);D2O(美国默克试剂公司);驴胶补血颗粒(九芝堂股份有限公司,批号201311023);Bruker 600 MHz Advance III NMR谱仪(德国布鲁克公司);HEMAVET950动物血液分析仪(美国Drew公司)。
1.2 动物SPF级健康雄性SD大鼠,体质量180~220 g,由北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2014-0001。
1.3 模型复制、分组及给药大鼠在室温(24±1)℃、湿度(60±5)%及昼夜自然节律光照环境下适应1周,随机分为对照组、模型组、给药组,每组12只。除对照组外,所有大鼠分3次sc 2%的乙酰苯肼氯化钠注射液,时间和剂量分别为第1天100 mg/kg、第4天50 mg/kg和第7天50 mg/kg。造模第7天后,给药组开始ig给予驴胶补血颗粒(蒸馏水配制,8 g/kg,依据临床人用剂量,按照体表面积换算成大鼠给药剂量),对照组和模型组分别ig等量蒸馏水,每天1次,连续2周。
1.4 样本收集所有大鼠于末次给药1 h后眼眶取血,用于血液学常规指标测定。末次给药2 h后麻醉大鼠,股动脉取血,常温下静置30 min后,以4 ℃、3 000r/min离心15 min,收集上清液,得血清,置于−80 ℃冰箱保存。
1.5 血液学常规指标测定所有大鼠于末次给药1 h后眼眶取血,置肝素抗凝管中,迅速旋摇,以防凝血。并用血液分析仪进行红细胞总数(RBC)、红细胞分布宽度(RDW)、红细胞压积(HCT)、平均红细胞体积(MCV)、白细胞总数(WBC)、血红蛋白(HGB)、血小板数量(PLT)和血小板体积(MPV)等血液学常规指标测定。
1.6 血清样本1H-NMR检测参考文献方法[16],取450 μL血清和350μL D2O,充分振荡均匀后在4 ℃下,以13000 r/min离心20min,取550 μL上清液加入5 mm核磁共振管中待测。采用CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列,弛豫时间为320 ms,谱宽为12.019kHz,扫描次数为64次。其他参数设置如下:PW=30 ℃(12.7μs),RD=1.0s,Fid转换LB=0.3 Hz。
1.7 1H-NMR谱图预处理与数据分析核磁谱图采用MestReNova(version 8.0.1,Mestrelab Research,Santiago de Compostella,Spain)处理。参照文献方法[16],以肌酐甲基峰的化学位移(δ 3.04)为标准对谱图进行校正,并进行相位、基线调整后,去除水峰(δ 4.5~5.2)干扰,对化学位移区间δ 0.7~8.0按照δ 0.01步长进行分段积分,将所得积分值进行归一化处理后导入软件SIMCA-P 13.0(Umetric,Sweden)中,采用帕莱托换算(Pareto Scaling)进行预处理后用主成分分析(PCA)进行初步分析,再用偏最小二乘法判别分析(PLS-DA)[17,18]。最后为了消除相关因素对分组的影响,消除组内差异、强化组间差异,采用正交信号校正(Orthogonalsignal correction,OSC)处理,运用正交偏最小二乘法判别分析(OPLS-DA)得到得分散点图(Scores plot)和相应的S-plot,并找出内源性差异代谢产物[10]。
2 结果与分析 2.1 大鼠体质量变化与对照组比较,模型组和给药组给药前大鼠体质量显著降低(P<0.05)。与模型组比较,给药组给药后大鼠体质量有所增加,但差异不显著,结果见表 1。
2.2 血液学常规指标比较| 表 1 各组大鼠体质量 Table 1 Body weight of rats in each group |
与对照组比较,模型组大鼠RBC、HGB、WBC降低(P<0.05),MCV、RDW、HCT均升高(P<0.05),而PLT和MPV显著下降(P<0.01),表明乙酰苯肼诱导的溶血性贫血模型复制成功。与模型组比较,给药组大鼠RBC、HGB、PLT、MPV升高(P<0.01),WBC、MCV、RDW、HCT均降低(P<0.05、0.01),表明驴胶补血颗粒可以增加红细胞数量,增强溶血性贫血大鼠的造血功能以及血小板功能,结果见表 2。
| 表 2 各组大鼠血液学常规指标比较 Table 2 Comparison on routine blood index of rats in each group |
对照组大鼠血清1H-NMR典型谱图如图 1所示,通过化学位移、偶合常数、峰型等核磁数据分析,参照文献报道[10,16]并结合Chenomx NMR suite(Chenomx Inc.,Edmonton,AB,Canada)软件分析,共指认出38种内源性代谢产物,包括氨基酸、脂质以及有机酸等。代谢产物化学信号归属如表 3所示,其中谱图中δ 1.24处的三重峰为实验中麻醉剂乌拉坦的信号,在指认和统计分析时均予以排除。
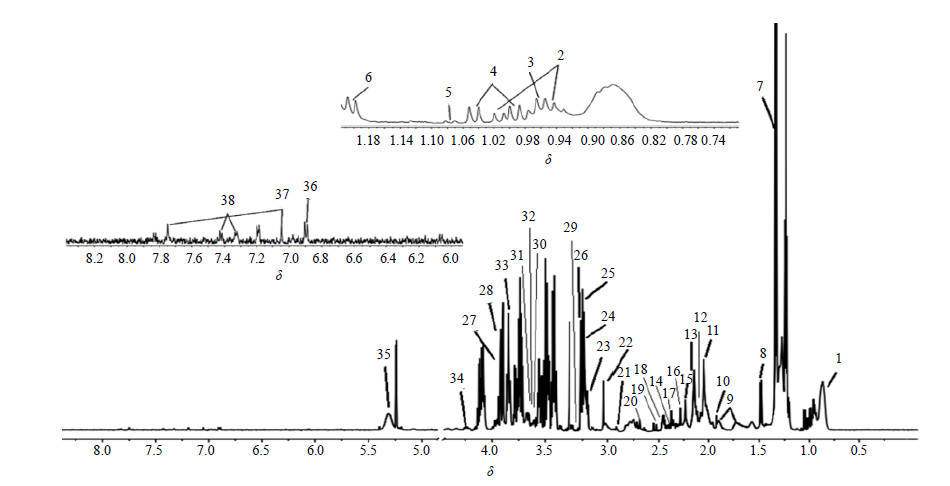 | 图 1 对照组大鼠血清样本1H-NMR图谱Fig.1 Typical 1H-NMR spectrum of serum in rats incontrol group |
| 表 3 大鼠血清样本1H-NMR数据归属 Table 3 1H-NMR assignments of major metabolites in serum of rats |
为了进一步分析各组间代谢产物的微小差异,对所得的复杂数据通过降维处理后进行多元统计分析。采用PLS-DA对所有血清样本数据矩阵进行统计分析,结果见图 2。模型组与对照组明显分开,表明模型复制成功。给药组与模型组明显分开并与对照组接近,表明驴胶补血颗粒对大鼠溶血性贫血有明显改善作用,与血液学常规指标测定结果一致。
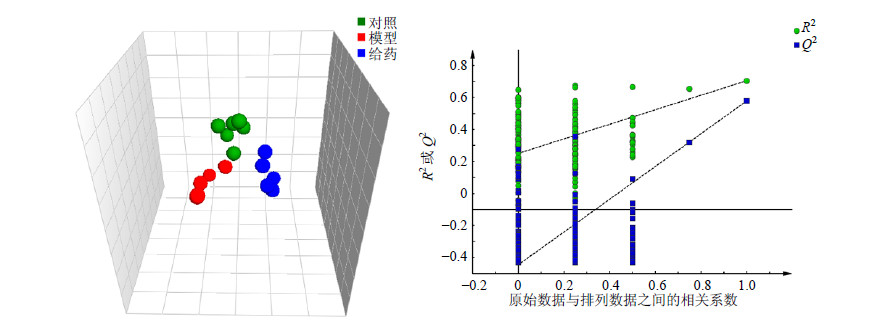 | 图 2 大鼠血清样本1H-NMR谱图PLS-DA散点图(A)和相应的模型验证图(B)Fig.2 PLS-DA scores plot(A)and corresponding validation plot(B)derived from 1H-NMR spectra of serum from all rats |
为了能最大程度确定造模前后大鼠血清中内源性代谢产物发生的变化以及驴胶补血颗粒的干预作用,分别采用OPLS-DA分析对模型组与对照组、模型组与给药组进行单独分析,得到OPLS-DA得分图和S-plot图,见图 3。在S-plot中,“S”曲线上离原点越远的点VIP值越大,对分组贡献也越大。在本实验中筛选出VIP>1的内源性代谢产物后,对这些代谢物所属的相对峰面积进行独立样本t检验,从而得到峰面积具有显著性差异的内源性代谢产物,结果见图 4。
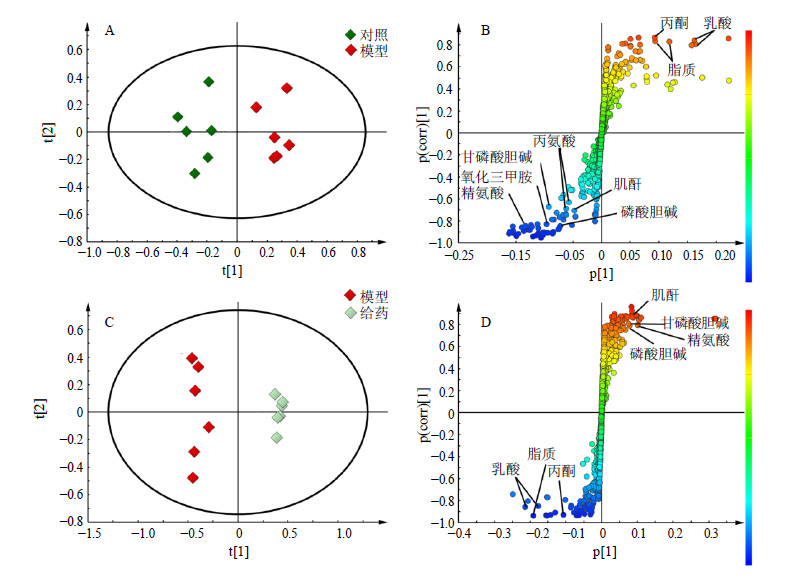 | 图 3 对照组与模型组大鼠血清样本1H-NMR谱图OPLS-DA散点图(A)和相对应的S-plot图(B)以及模型组与给药组大鼠血清样本1H-NMR谱图OPLS-DA散点图(C)和相对应的S-plot图(D)Fig.3 OPLS-DA scores plot(A)and corresponding S-plot(B)of rats in both control and model groups;OPLS-DA scores plot(C),and corresponding S-plot(D)of rats in Lvjiao Buxue Granules and model groups derived from 1H-NMR spectra ofserum |
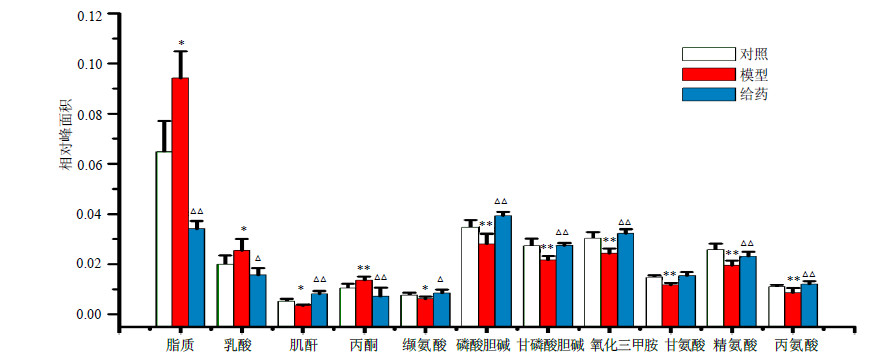 | 图 4 大鼠血清中差异代谢产物相对峰面积Fig.4 Relative peak areas of endogenous metabolites with difference in serum of rats |
模型组与对照组OPLS-DA分析结果(图 3-A)表明,对照组与模型组明显分开,造模成功。由图 3-C可知,给药组与模型组明显分开,表明驴胶补血颗粒可以明显回调贫血模型大鼠血清中内源性物质,补血作用效果明显。由图 4可知,与对照组比较,模型组大鼠血清中脂蛋白、乳酸、丙酮水平升高,而丙氨酸、缬氨酸、肌酐、磷酸胆碱、甘油磷酸胆碱、氧化三甲基胺、甘氨酸以及精氨酸水平下降。给药组大鼠血清中这11种内源性差异代谢产物均得到了不同程度的回调,接近对照组水平。
3 讨论中药复方成分复杂,多种成分之间还有协同和拮抗作用,传统的药理实验方法只能在一定程度上揭示中药的药理作用机制[19],而代谢组学将机体看作一个整体,研究药物引起的内源性代谢产物变化及内在变化规律,为中药复方作用机制的研究提供了有力的技术支持。本研究结果显示驴胶补血颗粒能较好地调节乙酰苯肼诱导的溶血性贫血血清差异代谢产物的水平而发挥补血作用,为驴胶补血颗粒的补血作用机制研究提供充分的理论依据。
与对照组比较,模型组大鼠血清中乳酸和丙酮水平升高,肌酐和丙氨酸水平下降,说明溶血性贫血可以引起机体能量代谢下降,这与临床溶血性贫血患者疲乏无力的症状相吻合。而驴胶补血颗粒使得大鼠血清中乳酸、肌酐以及丙酮水平出现回调现象并趋于正常水平,表明驴胶补血颗粒对大鼠溶血性贫血的改善作用与调节能量代谢有关。
模型组大鼠血清中脂质水平下降表现为能量代谢水平低下或脂肪存储不足。而给药组大鼠血清中均出现了显著回调,表明驴胶补血颗粒对大鼠溶血性贫血的改善作用与脂质代谢有关。
模型组大鼠血清中氧化三甲胺水平明显低于对照组,表明溶血性贫血可以导致大鼠肠道菌群代谢紊乱,而给药组大鼠血清中氧化三甲胺趋于对照组水平,说明驴胶补血颗粒的补血机制与肠道菌群代谢有关。
综上所述,驴胶补血颗粒通过调节能量代谢(乳酸、肌酐、丙酮)、脂质代谢和肠道菌群代谢(氧化三甲胺、磷酸胆碱、甘油磷酸胆碱)以及其他代谢途径(缬氨酸等)来发挥补血作用。
在中医理论中,“气为血帅,血为气母,气重于血”。驴胶补血颗粒中的阿胶和熟地黄主要用于补血,党参、黄芪和白术主要用于补气,当归补血以润肠通便。现代医学认为能量代谢与气虚和血虚密切相关。因此驴胶补血颗粒补血作用机制的不同与其成分的配伍有关,其谱效关系有待进一步研究。
此外,本研究结果表明驴胶补血颗粒在病理条件下能够引起血液学指标的变化及内源性代谢物的回调,但在生理条件下是否也会引起类似的血液学指标和内源性代谢物的变化有待进一步探讨,在后续研究中将设置正常大鼠给药组,从而探讨中药复方对机体稳态的影响以及预防疾病的作用。
| [1] | 谷陟欣, 张妮瑜, 梁逸曾, 等. 驴胶补血颗粒HPLC指纹图谱研究[J]. 中国实验方剂学杂志, 2011, 17(22):80-82. |
| [2] | 林洁, 张敏, 陈锦黎, 等. 新驴胶补血颗粒治疗气血两虚型月经过少的多中心, 随机对照, 临床等效性研究[J]. 上海中医药杂志, 2014, 48(12):52-55. |
| [3] | 张玉荣. 溶血性贫血的临床研究[J]. 亚太传统医药, 2008, 4(5):65-67. |
| [4] | 龚文君, 沃兴德. 四物汤对乙酰苯肼致溶血性贫血模型大鼠的治疗作用[J]. 浙江中医杂志, 2009, 44(9):640-641. |
| [5] | 李伟霞, 唐于平, 郭建明, 等. 当归-川芎药对及其组成药味对3种血虚模型补血作用的比较研究[J]. 中国中药杂志, 2011, 36(13):1808-1814. |
| [6] | 杜先婕, 宋林奇, 谢人明, 等. 复方阿胶浆对乙酰苯肼所致小鼠溶血性贫血模型的实验研究[J]. 中成药, 2009, 31(5):790-793. |
| [7] | Nicholson J K, Lindon J C, Holmes E. "Metabonomics":understanding the metabolic responses of living systems to pathophysio-logical stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenbiotica, 1999, 29(11):1181-1189. |
| [8] | Nicholson J K, Lindon J C. Systemsbiology:metabonomics[J]. Nature, 2008, 455(7216):1054-1056. |
| [9] | 黄晓晨, 宿树兰, 郭建明, 等. 代谢组学在中医药若干科学问题研究中的应用与思考[J]. 中草药, 2014, 45(2):147-153. |
| [10] | Li Z Y, He P, Sun H F, et al. 1H NMR based metabolomic study of the antifatigue effect of Astragali Radix[J]. Mol Biosyst, 2014, 10(11):3022-3030. |
| [11] | 陈磊, 向欢, 邢婕, 等. 补中益气汤干预脾虚证模型大鼠脾脏1H-NMR代谢组学机制研究[J]. 药学学报, 2014, 49(9):1320-1325. |
| [12] | Zheng X F, Tian J S, Liu P, et al. Analysis of the restorative effect of Bu-zhong-yi-qi-tang in the spleen-qi deficiency rat model using 1H NMR-based metabonomics[J]. J Ethnopharmacol, 2013, 151:912-920. |
| [13] | Tian J S, Peng G J, Gao X X, et al. Dynamic analysis of the endogenous metabolites in depressed patients treated with TCM formula Xiaoyaosan using urinary 1H NMR-based metabolomics[J]. J Ethnopharmacol, 2014, 158:1-10. |
| [14] | 彭国茳, 史碧云, 田俊生, 等. 京尼平抗抑郁作用的1H NMR代谢组学机制研究[J]. 药学学报, 2014, 49(2):209-216. |
| [15] | Tian J S, Shi B Y, Xiang H, et al. 1H-NMR-based metabonomic studies on the anti-depressant effect of Genipin in the chronic unpredictable mild stress rat model[J]. PLoS One, 2013, 8(9):e75721. |
| [16] | Shi B Y, Tian J S, Xiang H, et al. A 1H-NMR plasma metabonomic study of acute and chronic stress models of depression in rats[J]. Behav Brain Res, 2013, 241:86-91. |
| [17] | Liu C C, Wu Y F, Feng G M, et al. Plasma-metabolite-biomarkers for the therapeutic response in depressed patients by the traditional Chinese medicine formula Xiaoyaosan:A 1H NMR-based metabolomics approach[J]. J Affect Disord, 2015, 185:156-163. |
| [18] | 田俊生, 那丽丹, 向欢, 等. 基于核磁代谢组学的驴皮与其伪品的鉴别研究[J]. 中草药, 2015, 46(2):255-261. |
| [19] | 赵珊, 王鹏程, 冯健, 等. 代谢组学技术及其在中医药研究中的应用[J]. 中草药, 2015, 46(5):756-765. |
 2016, Vol. 47
2016, Vol. 47


