2. 重庆市食品药品检验所, 重庆 401121;
3. 重庆桑禾动物药业有限公司, 重庆 401122
2. Chongqing Institute for Food and Drug Control, Chongqing 401121, China;
3. Chongqing Honoroad Animal Health Co., Ltd., Chongqing 401122, China
金钱草Lysimachiae Herba是中医治疗结石症最常用的中药。金钱草存在严重的同名异物现象,在全国范围内,至少有7个科14种植物在不同地方被用作金钱草[1],其中应用最为广泛的是报春花科(Primulaceae)珍珠菜属Lysimachia L. 植物过路黄Lysimachia christinae Hance. 的全草和豆科(Leguminosae sp.)山蚂蝗属Desmodium Desv. 植物广金钱草Desmodium styracifolium (Osb.) Merr. 的地上部分。尽管《中国药典》自1977年版就已确定正品金钱草的基原植物是过路黄,但目前国内很多中药店仍将广金钱草作为金钱草销售。
过路黄和广金钱草都具有利湿退黄、利尿通淋等作用,都被用于治疗热淋、砂淋、小便涩痛、黄疸尿赤、尿路结石、肝胆结石等[2]。在临床治疗结石症上,过路黄和广金钱草常相互替代。但也有医家认为,过路黄偏向于肝胆疾病而广金钱草偏向于泌尿系统疾病[3]。要判断过路黄和广金钱草的药用价值的异同,比较二者的化学成分就很有必要,尤其在二者的作用机制尚不明确的情况下。
曹进等[4]已比较过过路黄和广金钱草的HPLC指纹图谱,但它们的图谱是采用340 nm波长检测的,检测到的成分多为黄酮类和酚酸类。文献报道过路黄和广金钱草都含有丰富的三萜类成分[5, 6, 7, 8, 9, 10],该类成分在近紫外区没有明显吸收。为更全面地比较过路黄和广金钱草的化学组成,本实验采用紫外(UV)和蒸发光散射(ELSD)2种检测器,在相同色谱条件下分别建立过路黄和广金钱草的RP-HPLC指纹图谱,并对二者的相应指纹图谱进行比较。
1 材料 1.1 仪器岛津LC-20AD型液相色谱仪,包括自动进样器、LC-20AD输液泵、SPD-20A检测器、岛津LCsolution色谱工作站,日本岛津公司;TXB-622L电子天平、AUW220D电子天平,岛津仪器有限公司;KQ5200E型超声波清洗器,昆山市超声仪器有限公司;SHB-IIIS循环水式真空泵,郑州长城科工贸有限公司;Heidolph Laborota 4001 Efficient旋转蒸发仪,北京莱比信科技发展有限公司。
1.2 试药甲醇、乙腈为色谱纯,美国Tedia 公司;冰醋酸为分析纯,成都市科龙化工试剂厂;水为超纯水;黄芪苷对照品(批号141022,质量分数≥98%)购自南京狄尔格医药科技有限公司。
1.3 药材过路黄Lysimachia christinae Hance. 和广金钱草Desmodium styracifolium (Osb.) Merr. 样品各13批,均经西南大学药学院邓君博士鉴定,分别为过路黄的干燥全草和广金钱草的地上部分。来源见表 1。
|
|
表 1 样品编号及来源 Table 1 Numbers and sources of samples |
色谱柱为Inertsil ODS-3 C18(150 mm×4.6 mm,3 μm);流动相为0.5%乙酸乙腈溶液(A)-0.5%乙酸水溶液(B),梯度洗脱程序:0~5 min,5% A;5~25 min,5%~15% A;25~45 min,15%~18% A;45~65 min,18%~25% A;65~95 min,25%~100% A;95~105 min,100% A;105~105.5 min,100%~5% A;105.5~120 min,5% A。体积流量1.0 mL/min,柱温30 ℃,进样量20 μL。UV检测波长255 nm;ELSD检测条件:漂移管温度60 ℃,雾化气体(空气)压力275.8 kPa(40 psi)。
2.2 溶液制备 2.2.1 内标溶液的制备取黄芪苷对照品适量,用甲醇配制成约100 μg/mL的溶液,贮于棕色瓶中4 ℃保存,备用。
2.2.2 供试品溶液的制备取过路黄或广金钱草干燥药材适量,粉碎,精密称定粉末5.0 g,置于100 mL锥形瓶内,加入甲醇50 mL,称质量。超声提取30 min,冷至室温,用甲醇补至原质量,摇匀,滤过。弃初滤液,取续滤液15 mL,精密加入内标溶液1 mL,减压浓缩至干。残留物用1 mL甲醇溶解,0.22 μm微孔滤膜滤过,取续滤液。
2.3 方法学考察 2.3.1 精密度试验按“2.2.2”项下方法制备过路黄供试品溶液,用“2.1”项下色谱条件分析,连续进样6次,考察各色谱峰相对于内标峰的相对保留时间和相对峰面积的一致性。各主要色谱峰相对保留时间的RSD为0.04%~1.36%,相对峰面积的RSD为2.46%~4.32%。同法考察该色谱条件分析广金钱草供试品溶液的精密度,相对保留时间的RSD为0.03%~1.27%,相对峰面积的RSD为2.16%~3.62%,表明仪器精密度良好。
2.3.2 重复性试验取同一批次过路黄(J1)样品,按“2.2.2”项下方法平行制备供试品溶液6份,用“2.1”项下色谱条件分析,考察各色谱峰的相对保留时间和相对峰面积的一致性。各主要色谱峰的相对保留时间的RSD为0.06%~1.82%,相对峰面积的RSD为3.18%~4.65%。同法考察该条件分析广金钱草的重复性,各色谱峰相对保留时间的RSD为0.04%~1.28%,相对峰面积的RSD为2.74%~3.68%,表明该分析方法重复性较好。
2.3.3 稳定性试验按“2.2.2”项下方法制备过路黄(J1)供试品溶液,用“2.1”项下色谱条件分析,分别在制样后0、4、8、12、24、36、48 h进样,考察各色谱峰的相对保留时间和相对峰面积的一致性。各主要色谱峰相对保留时间的RSD为0.06%~0.24%,相对峰面积的RSD为1.52%~4.83%。同法考察广金钱草供试品溶液的稳定性,相对保留时间的RSD为0.05%~0.22%,相对峰面积的RSD为1.35%~4.39%,表明过路黄和广金钱草供试品溶液在常温下48 h 内均较稳定。
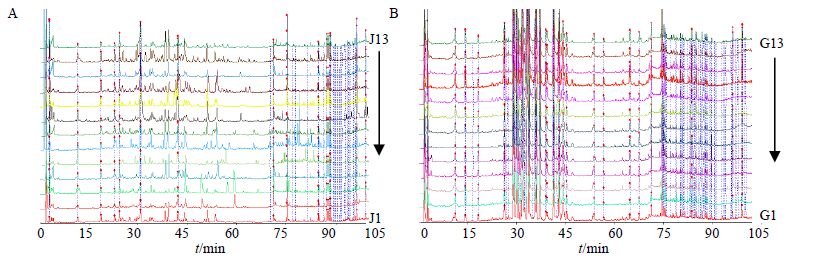
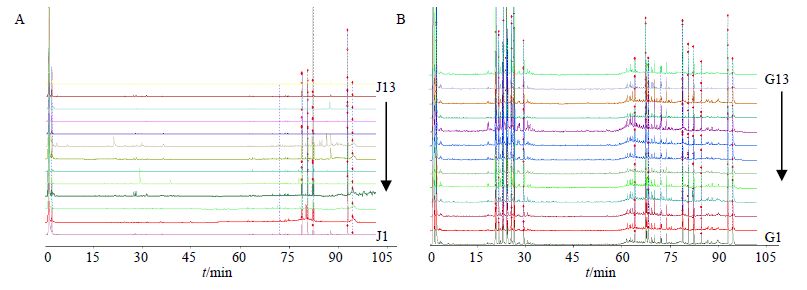
2.4 样品测定取表 1中样品,分别按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,记录色谱图,结果见图 1~2。
|
图 1 过路黄 (A) 和广金钱草 (B) 的HPLC-UV图谱 Fig. 1 HPLC-UV fingerprints of L. christinae (A) and D. styracifolium (B) |
|
图 2 过路黄 (A) 和广金钱草 (B) 的HPLC-ELSD图谱 Fig. 2 HPLC-ELSD fingerprints of L. christinae (A) and D. styracifolium (B) |
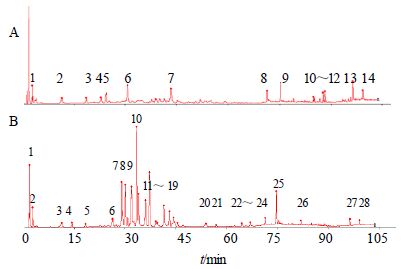
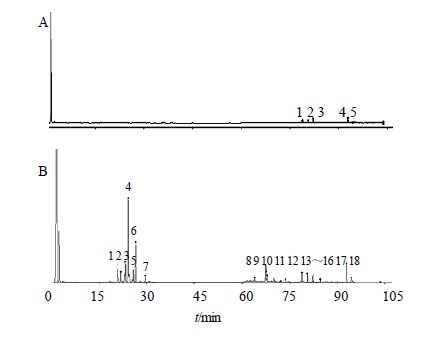
将“2.4”项下测定的指纹图谱采用“中药色谱指纹图谱相似度评价系统2004A版”进行分析,生成13批过路黄的HPLC-UV对照指纹图谱,并对共有峰进行标定。同法生成13批广金钱草的HPLC-ELSD对照指纹图谱,并对共有峰进行标定。结果见图 3、4。
|
图 3 过路黄 (A) 和广金钱草 (B) HPLC-UV对照图谱 Fig. 3 HPLC-UV fingerprints of L. christinae (A) and D. styracifolium (B) |
|
图 4 过路黄 (A) 和广金钱草 (B) HPLC-ELSD对照图谱 Fig. 4 HPLC-ELSD fingerprints of L. christinae (A) and D. styracifolium (B) |
对过路黄和广金钱草的化学成分研究结果显示,它们都含有黄芪苷、新西兰牡荆苷、大豆皂苷I[6, 9, 11, 12, 13],故本实验拟选其中之一作为内标物。采用加样法确认该3个化合物在过路黄和广金钱草的HPLC图谱中的位置,结果显示,13批过路黄样品的共有峰中没有黄芪苷和大豆皂苷I,而在广金钱草中都没有检测到这2个成分;广金钱草的HPLC-UV对照图谱中,第17号峰是新西兰牡荆苷,但其HPLC-ELSD图谱中却没检测到该成分,而在过路黄中都没有检测到新西兰牡荆苷。比较3个对照品的保留时间以及加样样品中该3个化合物的峰与相邻峰的分离度,黄芪苷的保留时间为58.71 min,峰位居中,且与相邻峰基本无干扰,故本实验选择黄芪苷为内标物,定量添加至样品溶液中。
2.7 相似度评价以“2.5”项下生成的对照指纹图谱为参照,采用“中药色谱指纹图谱相似度评价系统2004A版”计算13批药材指纹图谱的相似度,结果见表 2。
|
|
表 2 13批药材的指纹图谱相似度分析结果 Table 2 Similarity analysis of fringerprints of 13 batches of CMM |
实验中考察了甲醇-水、甲醇-0.1%磷酸水溶液、甲醇-0.5%乙酸水溶液、0.5%乙酸乙腈-0.5%乙酸水溶液等多种流动相系统,结果表明,以0.5%乙酸乙腈溶液-0.5%乙酸水溶液进行梯度洗脱,色谱峰的数目较多且各色谱峰分离度较好,因此选择0.5%乙酸乙腈溶液-0.5%乙酸水溶液作为流动相。将供试品溶液进行紫外全波长扫描,在255、360 nm有最大吸收。实验结果证明在255 nm进行检测时,基线平稳,各色谱峰吸收较强,因此选择255 nm作为过路黄和广金钱草HPLC-UV指纹图谱的检测波长。
3.2 过路黄和广金钱草的指纹图谱的色谱峰分析13批过路黄的HPLC-UV指纹图谱中,色谱峰大致分散在整个洗脱时间段内;而HPLC-ELSD指纹图谱中,75 min前色谱峰很少(图 1、2),且在该保留时间段内没有共有峰(图 4)。表明过路黄的甲醇提取物中,高极性和中等极性的成分量很低。而13批广金钱草的HPLC-UV指纹图谱和HPLC-ELSD指纹图谱中,色谱峰均分散在整个洗脱时间段内(<图 1、2),且广金钱草的HPLC-ELSD指纹图谱中,20~35 min时间段内洗脱的组分量较多(图 2),表明广金钱草的甲醇提取物中,中等极性的成分量较高。
在进样等量药材的提取物时,过路黄的HPLC-UV色谱峰普遍低于广金钱草,尤其是30~40 min内的洗脱组分(图 1),提示过路黄所含对255 nm光波有较强吸收的化合物少于广金钱草,如黄酮类及酚酸类,该结果与Sun等[14]的研究结果一致。
过路黄的HPLC-UV对照图谱和HPLC-ELSD对照图谱中,共有峰并不相对应(图 3、4);对于广金钱草,只有HPLC-UV对照图谱的15号峰和HPLC-ELSD对照图谱的8号峰相对应(图 3、4)。可见,用UV检测到的强峰,所对应的成分(黄酮和酚酸类)量并不高;而量高的成分几乎都没有强的紫外吸收。因此,仅用HPLC-UV建立过路黄和广金钱草的指纹图谱,并不能真实反映它们的化学组成,而用ELSD检测能反映药材中量较高的非挥发性成分的全貌。
3.3 过路黄和广金钱草的指纹图谱比较以黄芪苷为内标,计算各色谱峰的相对保留时间,初步确定:过路黄的HPLC-UV对照图谱中的6、7、13、14号峰分别与广金钱草的HPLC-UV对照图谱中的7、14、27、28号峰相对应;过路黄的HPLC-ELSD对照图谱中的1、5号峰分别与广金钱草的HPLC-ELSD对照图谱中的13、17号峰相对应。ELSD检测到的2个量较高的共有成分,可能是该2种药材相同疗效的物质基础。
3.4 不同批次过路黄和广金钱草分析13批过路黄药材的HPLC-UV指纹图谱的相似度在0.519~0.873,整体相似度较低,提示不同产地过路黄药材的化学组成差异较大;而13批广金钱草药材的HPLC-UV指纹图谱的相似度均高于0.97,且有28个共有峰,远多于过路黄的HPLC-UV指纹图谱的共有峰(14个),表明不同产地广金钱草的质量稳定。尽管过路黄的HPLC-ELSD指纹图谱的相似度几乎均高于0.97,但过路黄的HPLC-ELSD指纹图谱只有5个共有峰,不能说明过路黄的质量稳定;而广金钱草的HPLC-ELSD指纹图谱有18个共有峰,且相似度在0.99~1.00,再次证明不同产地广金钱草的质量稳定。
Sun等[14]的研究结果也表明,不同批次广金钱草的黄酮类和酚酸类成分组成相似,而过路黄的该类成分组成差异很大。过路黄化学组成不稳定正好能解释过路黄的临床疗效不稳定的现象,这也提示了对过路黄实施GAP生产和规范加工、贮藏方法的必要性和迫切性,以及建立更科学的金钱草质量控制方法的迫切性。本研究表明过路黄和广金钱草的组分中,相同者很少,绝大多数不同,提示它们的临床功用应有所不同,即使对于同种疾病有效,作用机制也可能不同,应明确区分二者。
| [1] | 蒋苏国, 陈爱萍. 金钱草的原植物考察[J]. 中草药, 2004, 35(7):828-829. |
| [2] | 中国药典[S]. 一部. 2010. |
| [3] | 《全国中草药汇编》编写组. 全国中草药汇编(上册)[M]. 北京:人民卫生出版社, 1975. |
| [4] | 曹进, 叶兆波, 车镇涛. 广金钱草与金钱草指纹图谱比较[J]. 药物分析杂志, 2006, 26(9):1248-1250. |
| [5] | 王植柔, 白先忠, 刘锋, 等. 广金钱草化学成分的研究[J]. 广西医科大学学报, 1998, 15(3):l0-14. |
| [6] | 怡悦. 金钱草中的三萜糖苷[J]. 国际中医中药杂志, 2006, 28(6):353. |
| [7] | Tian L J, Yang N Y, Chen W Q. Triterpene saponins from Lysimachia christinae[J]. J Asian Nat Prod Res, 2008, 10(3):265-269. |
| [8] | 杨峻山, 苏亚伦, 王玉兰. 广金钱草化学成分的研究[J]. 药学学报, 1993, 28(3):197-201. |
| [9] | Kubo T, Hamada S, Nohara T, et al. Study on the constituents of Desmodium styracifolium[J]. Chem Pharm Bull, 1989, 37(8):2229-2231. |
| [10] | 杨全, 程轩轩, 郭楚楚, 等. 广金钱草种子的化学成分和DPPH自由基清除活性研究[J]. 中草药, 2015, 46(17):2517-2521. |
| [11] | 杨念云, 段金廒, 李萍, 等. 金钱草中黄酮类化合物的分离与结构鉴定[J]. 中国药学杂志, 2006, 41(21):1621-1624. |
| [12] | Minh G P, Tong S P, Katsuyoshi M, et al. Flavonoid compounds from Desmodium styracifolium of Vietnamese origin[J]. Chem Nat Compd, 2010, 46(5):797-798. |
| [13] | 苏亚伦, 王玉兰. 广金钱草黄酮类化学成分的研究[J]. 中草药, 1993, 24(7):343-344. |
| [14] | Sun D X, Dong L H, Guo P P, et al. Simultaneous detection of flavonoids and phenolic acids in Herba Lysimachiae and Herba Desmodii Styracifolii using liquid chromatography tandem mass spectrometry[J]. Food Chem, 2013, 138(1):139-147. |
 2016, Vol. 47
2016, Vol. 47


