2. 南阳市卧龙区林业局, 卧龙区林业技术推广站, 河南 南阳 473056
2. Department of Forestry, Wolong District, Nanyang 473056, China
药用植物月季花Rosa chinensis Jacq.和玫瑰Rosa rugosa Thunb.均为蔷薇科(Rosaceae)蔷薇属Rosa L.植物[1],在《中国药典》中均以花入药,中药材名为月季花Rosae Chinensis Flos和玫瑰花Rosae Rugosae Flos[2]。月季花具有活血调经、疏肝解郁之功效,用于气滞血瘀、月经不调、痛经、闭经、胸胁胀痛。玫瑰花具有行气解郁、和血、止痛的功效,用于肝胃气痛、食少呕恶、月经不凋、跌扑伤痛[2]。此外,月季花和玫瑰经常作为园林观赏植物、天然芳香植物及重要的鲜切花资源,具有极高的商业价值[3]。由于大量的人工选育和自然杂交,药用植物月季花、玫瑰栽培品种变异较大,形态特征差异显著,品种较为混杂,二者与同属其他物种也很难区分,影响鉴定的准确性。同属的一些近缘种类的花与月季花和玫瑰极为相似如城口蔷薇Rosa chengkouensis Yu et Ku、刺梗蔷薇Rosa setipoda Hemsl. et Wils.,且部分也具有芳香味[1],经常作为伪混品入药,容易与月季花和玫瑰花混淆,直接影响临床用药的安全。目前,有关药用植物月季花和玫瑰的遗传多样性及亲缘关系的鉴定主要集中在种下栽培品种间[4-5],药用植物月季花和玫瑰及其同属的近缘种类(易混品)遗传多样性及亲缘关系的(inter simple sequence repeat,ISSR)分子鉴定研究鲜见报道。
ISSR技术是Zietkeiwitcz等[6]于1994年发展起来的一种分子标记,结合了SSR[7]和RAPD[8]标记手段的优点。具有RAPD的操作简单,所需DNA量少,不需预知研究对象的基因组序列等优点,并具有SSR的稳定性,同等条件下可揭示出比RFLP、RAPD、SSR更多的多态性[9]。该技术已经成功地应用于贝母[9]、人参[10]、菘蓝[11]和菊花[12]等药用植物及其近缘种的亲缘关系和遗传多样性分析。为确保中药材月季花和玫瑰花的正确和安全用药,探讨药用植物月季花和玫瑰及其近缘种类的遗传多样性、亲缘关系及分子鉴定,本实验利用ISSR分子标记技术对栽培的月季花、玫瑰及其近缘种类(易混品)进行系统分析,旨在为蔷薇属药用植物资源的收集、鉴定、保护和人工栽培育种等方面提供理论依据。
1 材料与方法 1.1 材料材料主要来源于南阳独山月季园蔷薇属种质资源圃,部分野蔷薇Rosa multiflora Thunb.样品来源南阳紫山,金樱子Rosa laeⅥgata Michx.实验材料来源信阳固始。共收集蔷薇属植物15个种,其中包括月季花8个栽培品种,玫瑰6个栽培类型,野蔷薇7个类型及同属12个近缘种,共33个样品。实验材料由河南农业大学生命科学院植物科学系朱长山教授鉴定,凭证标本保存于河南农业大学农学院标本馆。实验材料来源植物新鲜叶片,硅胶快速干燥后保存于−80 ℃冰箱,实验材料信息见表 1。
|
|
表 1 材料及来源 Table 1 Sources of materials |
1.2 仪器与试剂
采用北京天根生化植物DNA提取试剂盒(Tiangen Biotech Co.,中国)提取样品DNA,PCR扩增应用PTC0200PCR仪(BIO-RAD公司),样品DNA和PCR扩增产物采用DYYⅢ型电泳仪(北京六一仪器厂),凝胶紫外成像系统(BIORAD)检测,ISSR引物参照高蕾[4]和赵倩[5]筛选的引物序列(上海Sangon合成),用1%的琼脂糖凝胶电泳检测DNA质量,EB(上海Sangon公司)染色,其余试剂均为分析纯。
1.3 基因组DNA提取与检测本研究是采用改良的CTAB法提取DNA,取样约10 mg,研磨1 min后,利用植物DNA提取试剂盒提取总DNA。用浓度为1%琼脂糖凝胶电泳筛选出DNA主带清晰,无弥散带,无明显的RNA带,且经DNA质量检测仪Nandrop2000微量分光光度计检测260 nm和280 nm吸光度(A),A260/A280值均在1.8~2.0的DNA样品进行实验。
1.4 PCR扩增及产物检测PCR反应体系:基因组DNA 1.0 μL(约40 ng),1.2 μL引物(10 μmol/L),2.5 μL(2×Taq PCR Master Mix),加灭菌双蒸水至25 μL,总反应体系为25 μL。PCR扩增程序如下:94 ℃预变性5 min 1个循环;94 ℃变性30 s,50~54 ℃退火30 s,72 ℃延伸1 min;35个循环后,72 ℃完全延伸5 min;最后4 ℃保存。PCR产物用2%的琼脂糖凝胶电泳检测,EB染色,凝胶成像系统成像,用DL2000 Marker作相对分子质量标记,观察记录结果,分析扩增谱带。PCR扩增引物及每条引物扩增的退火温度见表 2。
|
|
表 2 ISSR引物及扩增的退火温度 Table 2 ISSR primers and annealing temperature of PCR reaction |
1.5 数据的统计分析
每一条引物均重复扩增、电泳3次,选取稳定清晰的条带进行统计分析。采用人工读带和Gel-pro32软件读带相结合的方法,根据分子标记的迁移率及其有无统计所有的二元数据,“有”赋值为“1”(包括强带和重复性好的弱带),“无”赋值为“0”,从而得到原始数据矩阵,计算多态性条带比率。利用软件POPGEN(Version 1.32)对数据进行遗传多样性统计,分析各种群多态位点百分率(PPB)、Nei’s基因多样性指数(H)、Shannon’s多态性信息指数(I)、基因分化系数(Gst)、基因流(Nm)、Nei’s遗传距离(D),并应用NTSYS(Version 2.10e)软件采用基于遗传相似性系数(GS)的UPGMA法构建系统树状图。
2 结果与分析 2.1 扩增结果用选取的6个ISSR引物对33份材料进行扩增,结果显示每个样品均能扩增出清晰、数量较多的条带。共扩增出110条带,每条引物平均能扩增出18.3条带。其中引物F-1对栽培月季花、玫瑰及野蔷薇部分样品的扩增结果见图 1。

|
A1~A7-野蔷薇B1~B6-玫瑰C1~C8-月季花M-Marker A1-A7-Rosa multiflora B1-B6-Rosa rugosa C1-C8-Rosa chinensis M-Marker 图 1 引物F-1对部分样品的ISSR扩增 Fig.1 Amplification results of partial samples by primer F-1 |
2.2 遗传多样性分析 2.2.1 栽培月季花、玫瑰及野蔷薇3个种群的遗传多样性分析
选取6条ISSR引物对栽培月季花、玫瑰和野蔷薇3个种群的21份个体进行了PCR扩增,通过POPGEN(Version 1.32)软件处理分析,结果显示3个物种种群间共检测到110个位点,其中多态性位点为104个,多态性位点百分率(PPB)平均为94.55%,I平均值为0.477 7,H平均值为0.317 2,各指标均高于3个物种种群内的遗传信息参数见表 3,PPB在49.09%~70%,I在0.258 0~0.371 0,H值在0.172 4~0.249 1。说明栽培月季花、玫瑰和野蔷薇在物种间水平上具有较高的遗传多样性,种群内遗传多样性水平明显低于种群间。
|
|
表 3 月季花、玫瑰和野蔷薇3个种群的遗传信息参数 Table 3 Parameters of genetic information on three species of R. chinesis, R. sugosa, and R. multiflora |
2.2.2 栽培月季花、玫瑰与同属近缘种15个种群的遗传多样性分析
选取6条ISSR引物对15个种群的33份个体进行PCR扩增,利用POPGEN(Version 1.32)软件分析,结果显示检测到110个位点,其中多态性位点109个,PPB为99.09%,H平均值为0.370 5,I平均值0.546 4。各个指数均显示栽培月季花、玫瑰及其同属近缘种在物种水平上具有较高的遗传多样性。种群间的Gst平均值为0.886 8,这表明有88.68%的变异存在于种群间,而11.32%的变异存在于种群内。种群的遗传分化表明,种群间的分化程度较大,而种群内的分化程度较低。Nm平均值为0.063 8,表明不同种群间几乎没有基因交流。Nei’s遗传距离在0.169 1~0.730 2,见表 4,说明种间遗传距离变异幅度较大。
|
|
表 4 栽培月季花、玫瑰及其同属近缘种的遗传距离 Table 4 Nei's genetic distance of R. chinesis, R. sugosa, and their relative species in Rosa L. |
2.3 聚类分析 2.3.1 栽培月季花和玫瑰的种内ISSR聚类分析
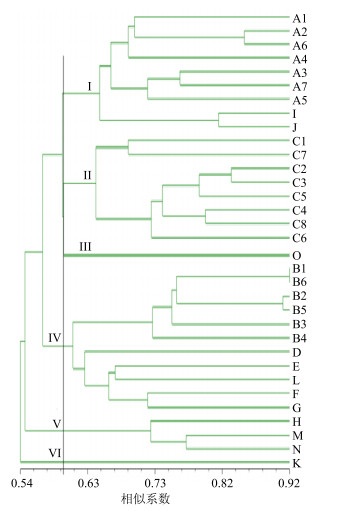
月季花栽培品种聚类分析结果如图 2中Ⅱ组所示。结果表明以相似系数0.65为标准,8份栽培月季花品种聚在一支,可将其分为2组,其中第1组包括C1和C7,二者的花较小,且均为低矮的微型月季;第2组包括C2、C3、C5、C4、C8、C6,这一组的月季花栽培品种的花较大,植株相比C1和C7较高。聚类结果表明,栽培月季花的不同品种能完全聚在一起,它们的遗传距离又相对较近,表明月季花的不同栽培品种间亲缘关系较近。
|
图 2 蔷薇属15个种群的UPGMA聚类树 Fig.2 UPGMA dendrogram for 15 species of Rosa L. |
玫瑰不同栽培类型的聚类分析结果如图 2中Ⅵ组所示,结果表明以相似系数0.73为标准,6份不同玫瑰栽培类型聚在一支,可将其分为2组,B4独立为一组。另一组所包括的玫瑰栽培类型B1、B2、B3、B5、B6为一亚组。聚类结果表明,玫瑰的不同栽培类型能完全聚在一起,它们的遗传距离又相对较近,表明玫瑰的不同栽培类型间的亲缘关系较近。
2.3.2 栽培月季花、玫瑰及其近缘种15个种群的ISSR聚类分析根据ISSR扩增得到的数据矩阵,利用NTSYS(Version 2.10e)软件构建栽培月季花及其同属近缘种的UPGMA聚类图(图 2),聚类结果显示,供试材料两两间相似系数范围在0.54~0.92。在遗传系数0.60处,蔷薇属的15个物种聚为Ⅰ、Ⅱ、Ⅲ、Ⅳ、V和Ⅵ 6组。Ⅰ组包括蔷薇属蔷薇亚属合柱组的3个种,野蔷薇、伞花蔷薇(J)和光叶蔷薇(Ⅰ),其中野蔷薇的7个不同居群A1、A2、A3、A4、A5、A6和A7聚在一支。Ⅱ组中仅包括一个种月季花,其中月季花的8个不同栽培品种C1、C2、C3、C4、C5、C6、C7和C8聚在一支,隶属于蔷薇属蔷薇亚属的月季组。Ⅲ组为金樱子组的金樱子(O)。Ⅳ组包括蔷薇属蔷薇亚属桂味组的6个种,玫瑰、钝叶蔷薇(D)、刺梗蔷薇(E)、全针蔷薇(F)、城口蔷薇(L)和山刺玫(G),其中玫瑰的6个栽培类型B1、B2、B3、B4、B5和B6聚在一支。V组包括蔷薇属蔷薇亚属蔷薇组的3个种,法国蔷薇(H)、突厥蔷薇(N)和白蔷薇(M)。Ⅵ组为蔷薇属蔷薇亚属木香组的木香花(K)。聚类分析的结果与传统分类相一致。
3 讨论本研究利用6个适宜引物对蔷薇属15个物种33份供试材料进行扩增,结果显示,DNA多态性好,条带清晰,共扩增出110条带,多态性条带109条,多态性位点百分率为99.09%,这表明蔷薇属内,月季花、玫瑰及其近缘种间存在丰富的遗传多样性。根据Nei’s物种间基因多样性指数计算出种间分化系数Gst为0.886 8,表明栽培月季花、玫瑰及其同属近缘种的种质资源有88.68%变异发生在物种间,有11.32%变异发生在物种内,说明种间变异明显大于种内变异。月季花、玫瑰和野蔷薇3个种群间21个个体共检测到110个位点,其中多态性位点为104个。说明栽培月季花、玫瑰和野蔷薇在物种间水平上具有较高的遗传多样性,种群内遗传多样性水平明显低于种群间。这表明ISSR分子标记可以用于蔷薇属药用植物月季花、玫瑰与其同属近缘种类的遗传关系研究,有效地揭示蔷薇属种质资源具有丰富的多态性和遗传多样性。
一直以来,药用植物月季花、玫瑰和野蔷薇随着人们的广泛栽培,其形态特征出现大量变异,三者之间及其与同属近缘种间很难区分,从而影响鉴定的准确性,造成传统鉴定困难,影响临床用药安全[13]。本研究中33份材料的UPGMA聚类分析结果表明,在蔷薇属内,以遗传相似性系数0.60为截值,可将蔷薇属15个种分为6组,这与许凤[14]的研究结果相一致,表明依据ISSR的聚类分析与传统分类学对蔷薇属属下的分类学研究结果相吻合。栽培月季花不同品种很好的聚在一支,且来源同一个区域,表明这些栽培品种间可能存在共同起源,具有较近的亲缘关系。玫瑰的不同栽培类型也能很好地聚在一支,与钝叶蔷薇(D)、刺梗蔷薇(E)、全针蔷薇(F)、城口蔷薇(L)和山刺玫(G)聚为一支,亲缘关系较近,这一分支隶属于蔷薇属蔷薇亚属的桂味组。由于该组的上述部分植物(如城口蔷薇和山刺玫等)花多具有芳香味,且含有芳香的精油,与玫瑰极为相似,常用来作为药用植物玫瑰的替代品入药[15],因此深入研究其化学成分和药理学作用,将确定这些药用植物能否在临床替代玫瑰入药。栽培的野蔷薇和南阳紫山分布的野生野蔷薇聚在一支,表明野蔷薇栽培类型可能来源于本地的野生居群。从ISSR数据分析、聚类结果来看,选用的6条ISSR引物能很好地区分出蔷薇属药用植物月季花、玫瑰及其近缘种类,揭示了药用植物月季花、玫瑰及其近缘种类之间的亲缘关系。
蔷薇属植物是世界上重要的观赏植物之一,同时也是我国重要药用植物种类丰富的大属之一。由于该属植物长期的人工栽培和定向选择,绝大多数是杂交后代,遗传背景较为复杂。种间亲缘关系研究和遗传多样性分析对于该属植物育种具有重要的意义,可以减少育种工作中亲本选配的盲目性[16]。基于ISSR对蔷薇属的药用植物月季花、玫瑰及其近缘种的遗传多样性和亲缘关系研究进行初步探讨,但鉴于该属植物种类较多,栽培品种众多,因此进一步在该属扩大取样范围,开展多种分子标记联合的DNA指纹图谱研究,方能全面构建蔷薇属种质资源的遗传多样性和亲缘关系。这为我国蔷薇属的药用植物的资源开发与利用、品种选育、引种栽培提供可靠的理论依据。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志(第37卷)[M]. 北京: 科学出版社, 1985. |
| [2] | 中国药典[S].一部. 2015. |
| [3] | 章银柯, 江燕, 朱炜. 我国蔷薇属植物资源极其园林应用前景[J]. 种子, 2009, 28(8):68–70. |
| [4] | 高蕾.油用玫瑰品种遗传关系分析[D].上海:上海交通大学, 2011. |
| [5] | 赵倩.月季组织培养及利用ISSR标记进行遗传多态性分析[D].武汉:华中农业大学, 2008. |
| [6] | Zietkiewica E, Rafalske A, Labuda D. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplified[J]. Genomics, 1994, 20(2): 176–183. DOI:10.1006/geno.1994.1151 |
| [7] | Liu T, Zhu S, Fu L, et al. Development and characterization of 1827 expressed Sequence tag-derived simple sequence repeat markers for ramie (Boehmeria nivea L. Gaud)[J]. PLoS One, 2013, 8(4): e60346. DOI:10.1371/journal.pone.0060346 |
| [8] | 任爱农, 秦民坚. 基于RAPD分子标记技术的中药材鉴定研究进展[J]. 中南药学, 2008, 3(6):338–341. |
| [9] | 王果平, 樊丛照, 李晓瑾, 等. 基于ISSR的新疆贝母属植物遗传多样性研究[J]. 中草药, 2013, 44(7):887–890. |
| [10] | 许永华, 张爱华, 金慧, 等. 人参种源遗传关系的ISSR分析[J]. 中草药, 2010, 41(7):1164–1167. |
| [11] | 孙稚颖, 姚辉. 不同产地菘蓝ISSR分析与鉴定[J]. 中草药, 2014, 45(22):3323–3326. |
| [12] | 邵清松, 郭巧生, 张志远. 药用菊花种质资源遗传多样性的ISSR分析[J]. 中草药, 2009, 40(12):1971–1975. |
| [13] | 江菊仙, 李水福. 玫瑰花与月季花的真伪优劣检定[J]. 中草药, 2003, 34(7):667–668. |
| [14] | 许凤. 90份蔷薇属(Rosa L.)种质资源的SSR遗传多样性研究[D].成都:西南大学, 2009. |
| [15] | 高蕾, 姚雷. 9个油用玫瑰品种遗传关系的ISSR分析[J]. 上海交通大学学报, 2010, 28(5):449–466. |
| [16] | 王明明, 宋振巧, 王建华. ISSR标记技术及其在药用植物遗传育种中的应用[J]. 中草药, 2007, 38(1):134–137. |
 2016, Vol. 47
2016, Vol. 47


