多聚半乳糖醛酸酶抑制蛋白(polygalacturonase-inhibiting proteins,PGIPs)是一种富含亮氨酸重复序列(extracellular leucine-rich repeat,eLRR)的植物细胞壁糖蛋白,它能抑制真菌所分泌的多聚半乳糖醛酸酶(polygalacturonases,PGs)水解植物细胞壁的活性,并在植物体内积累能激活多种防御反应的长链寡聚半乳糖醛酸(oligogalacturonides,OGs),从而抑制真菌的侵染[1-2]。PGIPs的结构是由10个不完整的eLRR组成,每一个eLRR由24个残基组成,且氨基酸序列通常为LxxLxxLxLxxNxLt/sgxIPxxLGx[3],这10个eLRRs组成2个β-折叠,其中一个β-折叠(sheet B1)位于PGIPs的凹面,其包含的氨基酸残基决定PGIPs和PGs的相互作用[4]。
PGIPs作为一种植物防御蛋白,在植物对病原菌的防卫反应中具有重要作用。病原真菌Bipolaris sorokiniana侵染小麦Triticum aestivum L.后,小麦中Tapgip1和Tapgip2基因的表达水平上调,过表达Tapgip1和Tapgip2基因的转基因烟草植株在受B. sorokiniana感染12 h时,其对B. sorokiniana的抗性最强,与野生型烟草相比,Tapgip1和Tapgip2转基因烟草对B. sorokiniana的抗性分别增加了22倍和16倍[5]。油菜Brassica napusL. Bnpgip1和Bnpgip2基因的表达均受死体营养型真菌Sclerotinia sclerotiorum的诱导,过表达Bnpgip1和Bnpgip2的拟南芥Arabidopsis thaliana L.植株延迟了S. sclerotiorum侵染引起的病害症状[6],过表达Bnpgip2的转基因油菜显著减轻了S. sclerotiorum侵染造成的腐烂症状[7]。大豆Glycine max (L.) Merr中Gmpgip5和Gmpgip7基因的表达也受S. sclerotiorum诱导,S. sclerotiorum侵染大豆48 h时,Gmpgip5基因的表达量显著增加(大于1 000倍),而Gmpgip7基因的表达量在S. sclerotiorum侵染的最初24 h内缓慢增加,48 h时表达水平最高[8]。此外,表达大豆Gmpgip3基因的转基因小麦对分别由病原真菌Gaeumannomyces graminis var. tritici和B. sorokiniana引起的全蚀病和根腐病表现出较强抗性,其病害症状分别减轻了47%~83%和42%~60%[9]。
三七Panax notoginseng (Burk) F. H. Chen为五加科(Araliaceae)人参属Panax L.多年生草本植物,是我国传统的名贵中药材,其主要药用活性成分是三七总皂苷(Panax notoginseng total saponins,PNS)。研究表明三七总皂苷具有抗肿瘤、抗病毒、活血祛瘀等多种生物活性,是预防心脑血管疾病的重要药物[10-11]。随着对三七药用价值的不断研究,其应用范围越来越广泛。然而,三七的生长周期长,一般生长3年以上的三七才可入药。此外,三七生长条件极其苛刻,适宜在温暖阴湿的环境下生长,其独特的生长环境易诱发多种病虫害的发生,其中真菌病害尤为严重。云南文山三七主产区中的三七所遭受的真菌病害主要是根腐病和黑斑病,常年发病率为5%~20%,严重时高达60%以上[12],严重影响了三七的产量。在本实验的前期研究中发现三七根腐病的主要致病菌是茄腐镰刀菌Fusarium solani(Mart.) Sacc,黑斑病的主要致病菌是人参链格孢Alternaria panax Whetz,同时还发现,三七感染黑斑病后更容易导致根腐病的发生,所以把这2种病害放在一起来研究。另外,前期研究还发现外源茉莉酸甲酯(methyl jasmonate,MeJA)预处理三七可显著增强三七对茄腐镰刀菌的抗性。MeJA预处理三七受茄腐镰刀菌侵染过程中,三七根中一个PGIP基因的表达量上升,为了深入研究茉莉酸(jasmonic acid,JA)信号途径介导的三七对茄腐镰刀菌的抗性防卫反应机制,本实验克隆了上述PGIP基因的全长cDNA,并进行了表达特性分析。
1 材料与方法 1.1 材料与试剂植物材料三七购买自文山三七主产区,种于温室中培养,实验所用茄腐镰刀菌和人参链格孢菌株均由本实验室分离、鉴定并保存。
大肠杆菌DH5α感受态购于北京全式金生物科技有限公司,TRIGene总RNA提取试剂盒购自北京GenStar Biosolutions公司,NucleoTrap® mRNA Midi Kit购自德国Macherey-Nagel公司,SMART RACE cDNA Amplification kit购自美国Clontech公司,pMD18-T载体购自日本TaKaRa公司,GoTaq® 2-Step RT-qPCR System购自美国Promega公司,本实验所用的引物及相关测序均在上海生工生物工程有限公司完成,其他试剂均为国产或进口分析纯。
1.2 方法选取温室中生长状态良好且株高一致的一年生三七作为待处理材料,处理前用剪刀在三七根部或叶片形成伤口,将供试三七分为9组(30棵/组),每组分别进行以下处理:第1组和第2组分别采用100 μmol/L MeJA和无菌水(CK)预处理三七根部30 min,处理方法为蘸根法,然后分别将MeJA和无菌水预处理的三七种于陶瓷花钵中,24 h后同样采用蘸根法接种新鲜的茄腐镰刀菌分生孢子悬液(浓度为2×106个孢子/mL),接种30 min后将2组三七移栽至陶瓷花钵中,收集接种后4、12、24、48、72 h的三七根;第3组和第4组分别用活化的人参链格孢菌丝和无菌水(CK)接种三七叶片,用保鲜膜包裹所接种叶片以保湿,并在接种2、12、24、48、72、96 h时采集三七的叶片;第5~9组分别用100 μmol/L MeJA、200 μmol/L水杨酸(salicylic acid,SA)、1 mmol/L过氧化氢(H2O2)、1 mmol/L乙烯利(ethylene,ETH)以及无菌水(CK)浸泡三七根部30 min,然后将这5组三七种于花钵中培养,分别在处理后4、12、24、48、72 h时采集三七的根。所有采集的样品经液氮速冻后于−80 ℃保存备用。
1.2.1 RNA提取及mRNA分离采用TRIGene总RNA提取试剂盒提取各样品中的总RNA。取适量上述各样品提取总RNA,从各RNA样品中取等量混匀,并按照NucleoTrap® mRNA Midi Kit说明书从中分离mRNA,以分离的mRNA为模板逆转录合成RACE模板。
依据三七转录组测序产生的PGIP EST序列,设计5’-RACE和3’-RACE特异性引物。5’-RACE特异性引物为5’-GAAGGGAGAGTGGAATTGAGCCAT-AGAG-3’,3’-RACE特异性引物为5’-CCTCAAGA-GACTTCGGCTTCACAAGATG-3’。RACE PCR产物经TA克隆后连接到pMD18-T载体中,并将连接产物导入大肠杆菌DH5α感受态细胞,挑选阳性克隆测序。
1.2.2 三七PGIP(PnPGIP)基因全长最大开放阅读框(open reading frame,ORF)的克隆以及生物信息学分析通过NCBI(http://www.ncbi.nlm.nih.gov/)中的bl2seq工具将PnPGIP基因的5’-RACE扩增序列、3’-RACE扩增序列与EST序列进行拼接,并利用NCBI的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)查找PnPGIP基因拼接序列中的ORF。根据拼接的全长cDNA序列设计扩增PnPGIP基因全长ORF的特异引物,并对全长ORF进行PCR扩增,扩增产物经TA克隆后测序。ORF扩增特异引物序列为5’-GGAAGACCAATGTTGTT-ACTCCTCT-3’和5’-TCCATTGAGTACTAGGGAA-ACCATG-3’。使用NCBI中的BLAST在线分析工具来分析PnPGIP基因及其编码的蛋白质序列的同源性(http://www.ncbi.nlm.nih.gov/BLAST)。使用SignalP4.1(http://www.cbs.dtu.dk/services/SignalP/)来完成PnPGIP的信号肽序列预测。利用MEGA6软件进行多重序列比对和聚类分析。借助ProtParam(http://www.au.expasy.org/tools/protpatam.html)在线分析工具完成PnPGIP理化性质的预测。采用PredictProtein(http://www.predictprotein.org/)在线工具来分析PnPGIP的二级结构并进行亚细胞定位预测。PnPGIP的三维结构分析由WISS-MODEL(http://swissmodel.expasy.org/)在线分析工具完成。
1.2.3 PnPGIP基因的表达特性分析采用qRT-PCR分析PnPGIP基因在三七受茄腐镰刀菌、人参链格孢侵染过程中的表达特性以及是否在转录水平响应MeJA、H2O2、SA、ETH 4种信号分子的处理。以三七PnACT2(KF815706.1)作为内参基因。PnPGIP基因特异引物为5’-CATACCTCAAGA-GACTTCGGCTTC-3’和5’-AGGGAGAGTGGAAT-TGAGCCAT-3’。内参基因PnACT2的特异引物序列分别为5’-TCCAAGGGT GAATATGATGAATCG-3’和5’-AACCTCTCCAAAGAGAATTTCTGAGT-3’。反应体系和条件均参考GoTaq® 2-Step RT-qPCR System。反应条件为95℃、2 min;95 ℃,15 s,60 ℃、1 min,40个循环;之后是熔解曲线分析。每个qRT-PCR反应均设置3次重复,以正常生长发育三七根中PGIP基因的表达量为对照,采用2−ΔΔCt法计算PGIP基因在其他样品中的相对表达水平。
1.2.4 统计分析三七受茄腐镰刀菌和人参链格孢侵染以及MeJA、ETH、H2O2、SA处理后,PnPGIP基因的相对表达水平用x±s表示。与处理前(对照)相比,处理后PnPGIP基因相对表达水平的差异显著性采用t检验进行分析。
2 结果与分析 2.1 PnPGIP基因全长cDNA的克隆基于前期研究中三七转录组测序产生的编码PGIP的EST序列(未公开),通过5’-RACE和3’-RACE扩增获得该EST的全长cDNA序列。RACE扩增结果如图 1-a所示,测序分析显示5’-RACE产物长约464 bp,3’-RACE产物长约804 bp。经过序列拼接获得PGIP的全长cDNA,序列长1 171 bp,其包含一个981 bp的ORF、13 bp的5’-非翻译区(untranslated region,UTR)以及177 bp的3’-UTR,ORF编码一个具有326个氨基酸的蛋白质。根据拼接的全长cDNA序列设计特异性引物,成功扩增出了长度为1 029 bp包含全长ORF的cDNA(图 1-b)。分别以三七cDNA和DNA为模板,用PnPGIP基因ORF引物进行PCR,琼脂糖凝胶电泳检测发现,分别以三七cDNA和DNA为模板得到的PCR产物片段大小一致,说明PnPGIP基因中不含有内含子。后续的生物信息学分析表明克隆得到的cDNA序列编码PGIP蛋白,将该基因命名为PnPGIP,GenBank登录号为KU361076。
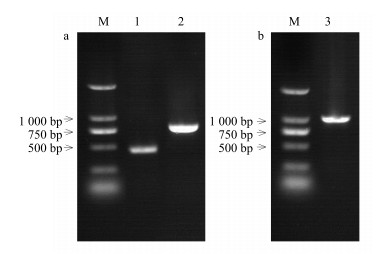
|
M-Marker 1-5’-RACE扩增产物2-3’-RACE扩增产物3-PnPGIP基因全长ORF的扩增产物 M-Marker 1-amplification product of 5'-RACE 2-amplification product of 3'-RACE 3-amplification product of ORF 图 1 PnPGIP基因的RACE扩增产物(a)及其全长ORF扩增产物(b) Fig.1 Amplification results of RACEs (a) and full-length ORF of PnPGIP gene (b) |
2.2 序列同源性分析、多重序列比对以及进化树构建
BLASTn分析表明PnPGIP的第735~989位核苷酸序列与芝麻Sesamum indicum Linn. PGIP(SiPGIP,XM_011088934.1)的第747~998位核苷酸序列具有74%的同源性。BLASTp分析结果显示PnPGIP所编码PGIP蛋白与葡萄Vitis vinifera L. PGIP(VvPGIP,XP_010659524.1)和向日葵Helianthus annuus L.(HaPGIP,AIF27224.1)的序列同源性较高,分别为62%和59%。保守结构域分析结果显示,PnPGIP包含8个LRR结构域(图 2-a)。此外,PnPGIP与HaPGIP、SiPGIP、VvPGIP以及人参P. ginseng C. A. Mey PGIP(PgPGIP,ACU27355.1)的多重序列比对见图 2-b,尽管三七和人参都属于人参属,但PnPGIP与HaPGIP、SiPGIP、VvPGIP的蛋白序列同源性较高,而与PgPGIP的蛋白序列相似性仅为30%。PgPGIP蛋白序列中第1~4、58~61、80~92和201~221位的氨基酸残基在PnPGIP蛋白序列中缺失,而PnPGIP蛋白序列中第301~304位的氨基酸残基在PgPGIP蛋白序列中缺失。使用MEGA6软件对来自于沙梨Pyrus pyrifolia Nakai PGIP(PpPGIP)、巨桉Eucalyptus grandis Hill ex Maiden PGIP(EgPGIP)、苹果Malus domestica Borkh. PGIP(MdPGIP)等与PnPGIP进行多重序列比对,并构建系统进化树(图 3)。进化树中13个PGIPs聚类为2大支,人参PgPGIP单独为一支,PnPGIP和其他12个物种的PGIPs聚为另一大支。PnPGIP所在的这一大支又分为3小支,水稻Oryza sativa L. PGIP(OsPGIP)单独为一小支,PnPGIP、HaPGIP、SiPGIP、VvPGIP聚为一小支,其余7个PGIPs聚为一小支。进化树分析结果再次表明PnPGIP与HaPGIP、SiPGIP、VvPGIP具有很高的同源性。
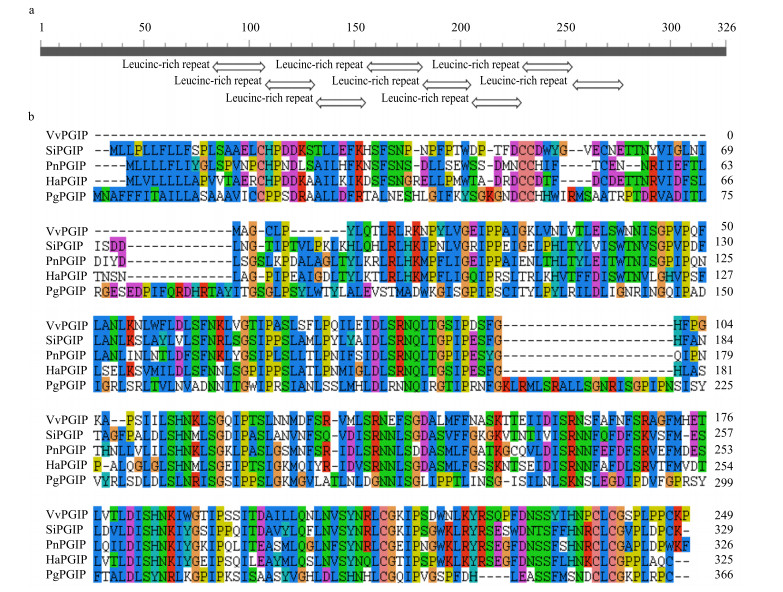
|
图 2 PnPGIP蛋白质序列的保守结构域分析(a)以及PnPGIP与4种植物PGIPs的多重序列比对(b) Fig.2 Conserved domains analysis of PnPGIP (a) and multiple alignment of amino acid sequence of PnPGIP and four plant PGIPs (b) |

|
PnPGIP用方框标识;括号内分别为各物种PGIPs的登录号 PnPGIP is indicated with frame; GenBank numbers of plant species PGIPs are given in parentheses, respectively 图 3 PnPGIP与几种植物PGIPs的系统进化树分析 Fig.3 Phylogenetic tree of the deduced amino acid sequence of PnPGIP and several plant PGIPs |
2.3 PnPGIP编码蛋白质的理化性质及信号肽预测
利用ProtParam在线工具预测PnPGIP的理化性质,结果显示PnPGIP的相对分子质量约为36 770,等电点约为5.83。该蛋白在酵母和大肠杆菌中的半衰期分别大于20 h和10 h。SignalP 4.1分析结果表明PnPGIP中存在信号肽,剪切位点位于第16和第17个氨基酸残基之间。去掉信号肽的成熟PnPGIP,相对分子质量约为34 980,等电点为5.84。此外,PredictProtein预测PnPGIP蛋白质可能定位于细胞质膜。
2.4 PnPGIP编码蛋白质的二级结构及三维结构预测根据PredictProtein分析结果,PnPGIP蛋白具有α-螺旋、β-折叠和无规卷曲,它们所占的百分比分别为26.38%、11.66%和61.96%。其二级结构中共包含13个α-螺旋和23个β-折叠。蛋白质的三级结构在很大程度上决定了蛋白质的功能,为了研究PnPGIP的结构和功能之间的关系,以菜豆Phaseolus vulgaris L. PvPGIP2(1OGQ_A)为模板构建了PnPGIP的三维模型,PnPGIP与PvPGIP2的氨基酸序列相似性为42.09%。PnPGIP的主链信息和折叠模式与PvPGIP2的结构特征高度相似。在PnPGIP的三维结构中,在中心LRR结构域的凹面有一条长的β-折叠,在蛋白质的凸面有一系列310螺旋,另外,还有一条延伸的β-折叠与其前面的二级结构连接(图 4)。
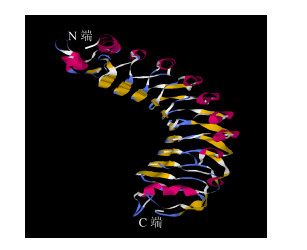
|
图 4 PnPGIP的三维结构模型 Fig.4 Putative 3D structure of PnPGIP |
2.5 PnPGIP基因的表达特性分析
前期研究发现MeJA预处理三七根部明显提高三七对茄腐镰刀菌的抗性,本实验采用qRT-PCR对PnPGIP基因在MeJA和无菌水预处理三七受茄腐镰刀菌侵染过程中的表达变化进行了分析。无菌水预处理三七(CK)接种茄腐镰刀菌后,PnPGIP基因的表达量急剧上升,并在4 h时,其表达量达到最高水平,约为接种前的5倍,之后表达量急剧降低,到72 h时,只能检测到微弱的表达量;PnPGIP基因的表达受外源MeJA诱导,MeJA预处理三七24 h后PnPGIP基因的转录水平大幅度提高,接种茄腐镰刀菌后12 h内,MeJA预处理三七中PnPGIP基因的表达量逐渐降低,12 h后PnPGIP基因的表达量又缓慢上升,24 h后表达量又迅速下降(图 5)。
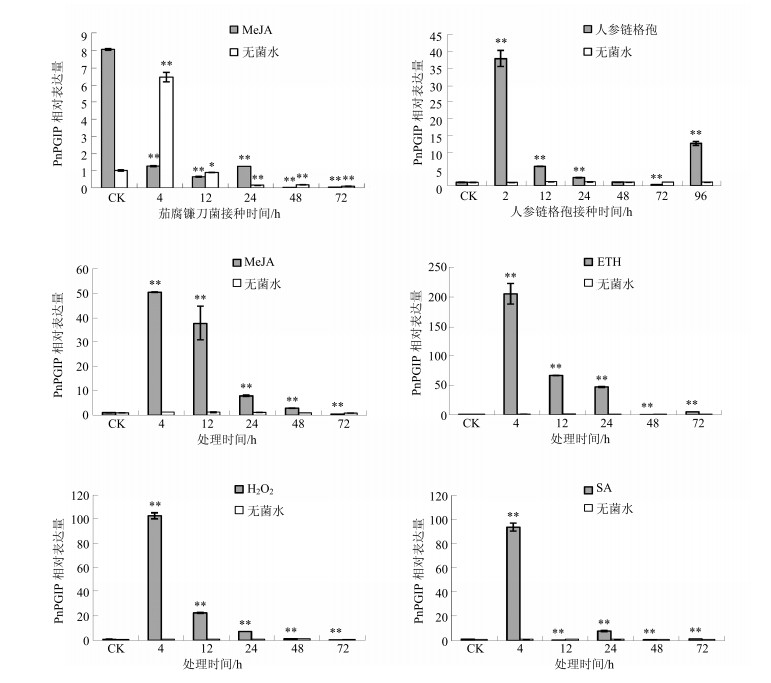
|
*表示与接种(处理)前差异显著(P<0.05),**表示与接种(处理)前差异极显著(P<0.01) *indicated significant difference (P < 0.05) compared with controls (before inoculation/treatment), **indicated highly significant difference (P < 0.01) compared with controls (before inoculation/treatment) 图 5 茄腐镰刀菌和人参链格孢侵染过程中及MeJA、ETH、H2O2、SA处理后PnPGIP基因的表达水平 Fig.5 Expression levels of PnPGIP during F. Solani and A. panax infection as well as after treatment by MeJA, ETH, H2O2, and SA |
同时还分析了PnPGIP基因在人参链格孢浸染三七和4种信号分子JA、ETH、H2O2、SA处理三七后的表达水平。人参链格孢接种三七后,PnPGIP基因的表达量急剧上升,在接种后2 h时达到最高水平,约为正常表达水平的19倍,随后表达量逐渐降低,到96 h时表达量又大幅上升,约为接种前表达量的7倍。4种信号分子JA、ETH、H2O2、SA处理三七均会迅速诱导三七根中PnPGIP基因的表达,并且PnPGIP基因的表达量均在处理后4 h时达到最高水平,但PnPGIP基因受这4种信号分子的诱导程度不同,ETH最高,H2O2和SA次之,而MeJA的诱导幅度最低(图 5)。综上所述,PnPGIP基因在转录水平响应茄腐镰刀菌和人参链格孢的侵染,并受几种逆境胁迫相关信号分子的诱导,PnPGIP基因可能参与三七对茄腐镰刀菌和人参链格孢的防卫反应。
3 讨论本研究从三七中分离了1种新的PGIP基因,PnPGIP基因的全长ORF为981 bp,编码含有326个氨基酸的蛋白质,该蛋白质的序列与来自于向日葵和葡萄的PGIP序列有较高的同源性。PnPGIP具有8个保守的LRR结构域,多重序列比对显示位于LRR结构域的残基比其他位置的残基更加保守,在与PG配体结合的亲和性和特异性方面,PGIP的LRR结构域起关键作用[13]。尽管人参PgPGIP以及三七PnPGIP的一级结构相似性较低,但三级结构模型上,人参PgPGIP以及三七PnPGIP均与菜豆P. vulgaris L. PvPGIP2高度相似[14]。不同物种PGIPs的3D结构的高度保守性表明PGIP家族在进化过程中高度保守,这种保守的结构对于维持PGIP的功能是必需的。
在单子叶植物和双子叶植物中,PGIPs是与细胞壁相连的糖蛋白,生物信息学分析表明PnPGIP中具有6个N-糖基化位点。来自于西洋梨Pyrus communis L.的PGIP有7个N-糖基化潜在位点,其中一些位点只被N-糖基化所修饰,而其他位点可以被多糖糖基化和非糖基化共同修饰[15],这表明糖基化修饰对于维持蛋白质的结构和功能至关重要,尤其在蛋白质和蛋白质相互作用方面起重要作用。PnPGIP中富含的糖基化修饰可能参与PnPGIP与真菌分泌的PGs之间的相互作用。以前的研究表明葡萄VvPGIP1对葡萄孢菌Botrytis cinerea有较高的抗性[16],在系统发育树中,PnPGIP与VvPGIP基因位于相近的位置,暗示PnPGIP可能也具有抗真菌活性。
PGIPs是重要的植物防卫蛋白质,大量研究结果表明PGIPs能有效地抑制真菌入侵,且PGIP的表达水平与植物对真菌的抗性相关联[17]。OGs、JA、ETH、SA、机械损伤、真菌侵染等因素均不同程度地诱导PGIPs基因的表达水平。桃Prunus persica L. Batch经外源水杨酸处理后,与对照组相比,其PPGIP1基因的表达水平明显增加[18]。拟南芥PGIP2的表达受伤口、茉莉酸和B. cinerea侵染的诱导,过表达Atpgip2的拟南芥植物不仅减少了由B. cinerea引起的病害症状[19],同时还降低了对半活体营养型病原真菌Fusarium graminearum Petch的敏感性[20],相反地,由反义Atpgip引起的基因沉默导致拟南芥对F. graminearum的敏感性增加[21]。PvPGIP2基因的表达不仅受伤害、SA、葡聚糖和OGs等的诱导[17],还受茉莉酸处理的诱导,外源MeJA处理菜豆后,PvPGIP1、PvPGIP2、PvPGIP3基因的表达量均显著增加,并且增强了菜豆对S. sclerotiorum的抗性[22]。本实验中,qRT-PCR分析表明在接种茄腐镰刀菌和人参链格孢后PnPGIP基因在三七根中的表达量迅速上升,且分别在接种后4 h和2 h表达量增加至正常水平的7倍和19倍,暗示PnPGIP基因可能参与三七应对茄腐镰刀菌和人参链格孢入侵的防卫反应。同时PnPGIP基因的转录水平明显受到信号分子MeJA、ETH、H2O2以及SA的诱导。本实验的前期研究发现MeJA预处理三七根部能明显增强三七对茄腐镰刀菌的抗性,本实验分离的三七PnPGIP基因响应MeJA预处理,可能参与JA信号途径介导的三七对茄腐镰刀菌的抗性机制。
PGIPs是一类与植物自身免疫相关的多功能蛋白,通过抑制病原真菌的PGs活性来提高植物对真菌的抗性,在植物抵御病原菌侵染的防卫反应中扮演着重要角色。本研究结果表明,PnPGIP基因参与三七对茄腐镰刀菌和人参链格孢的防卫反应,因此有必要对其功能以及生物学活性进行深入分析。接下来,本课题组将构建PnPGIP基因的原核表达载体,分析PnPGIP重组蛋白的活性以及对不同真菌PGs的识别特性,并采用反向遗传学的方法验证PnPGIP基因的生物学功能。
| [1] | De Lorenzo G, D'Ovidio R, Cervone F. The role of polygalacturonase-inhibiting proteins (PGIPs) in defense against pathogenic fungi[J]. Annu Rev Phytopathol, 2001, 39: 313–335. DOI:10.1146/annurev.phyto.39.1.313 |
| [2] | 李文娴, 刘迪秋, 葛峰, 等. 多聚半乳糖醛酸酶抑制蛋白的结构、功能以及应用研究进展[J]. 生物学杂志, 2010, 27(5):77–80. |
| [3] | Kobe B, Kajava A V. The leucine-rich repeat as a protein recognition motif[J]. Curr Opin Struct Biol, 2001, 11(6): 725–732. DOI:10.1016/S0959-440X(01)00266-4 |
| [4] | Di Matteo A, Federici L, Mattei B, et al. The crystal structure of polygalacturonase-inhibiting protein (PGIP), a leucine-rich repeat protein involved in plant defense[J]. PNAS, 2003, 100(17): 10124–10128. DOI:10.1073/pnas.1733690100 |
| [5] | Janni M, Bozzini T, Moscetti I, et al. Functional characterisation of wheat Pgip genes reveals their involvement in the local response to wounding[J]. Plant Biol, 2013, 15(6): 1019–1024. DOI:10.1111/plb.2013.15.issue-6 |
| [6] | Bashi Z D, Rimmer S R, Khachatourians G G, et al. Brassica napus polygalacturonase inhibitor proteins inhibit Sclerotinia sclerotiorum polygalacturonase enzymatic and necrotizing activities and delay symptoms in transgenic plants[J]. Can J Microbiol, 2013, 59(2): 79–86. DOI:10.1139/cjm-2012-0352 |
| [7] | Huang F H, Guan C, Jin F, et al. Prokaryotic expression and protein function of Brassica napus PGIP2 and its genetic transformation[J]. Plant Biotechnol Rep, 2013, 8(2): 171–181. |
| [8] | Kalunke R M, Cenci A, Volpi C, et al. The pgip family in soybean and three other legume species:evidence for a birth-and-death model of evolution[J]. BMC Plant Biol, 2014, 14: 189–200. DOI:10.1186/s12870-014-0189-3 |
| [9] | Wang A, Wei X, Rong W, et al. GmPGIP3 enhanced resistance to both take-all and common root rot diseases in transgenic wheat[J]. Funct Integr Genomics, 2015, 15(3): 375–381. DOI:10.1007/s10142-014-0428-6 |
| [10] | 王莹, 禇扬, 李伟, 等. 三七中皂苷成分及其药理作用的研究进展[J]. 中草药, 2015, 46(9):1381–1392. |
| [11] | 贺旭, 葛金文, 邓长青, 等. 三七总皂苷抑制大鼠全脑缺血后海马CA1区神经元凋亡及其机制研究[J]. 中草药, 2016, 47(8):1337–1344. |
| [12] | 蒋妮, 覃柳燕, 叶云峰. 三七病害研究进展[J]. 南方农业学报, 2011, 42(9):1070–1074. |
| [13] | Leckie F, Mattei B, Capodicasa C, et al. The specificity of polygalacturonase-inhibiting protein (PGIP):A single amino acid substitution in the solvent-exposed beta-strand/beta-turn region of the leucine-rich repeats (LRRs) confers a new recognition capability[J]. EMBO J, 1999, 18(9): 2352–2363. DOI:10.1093/emboj/18.9.2352 |
| [14] | Sathiyaraj G, Srinivasan S, Subramanium S, et al. Polygalacturonase inhibiting protein:Isolation, developmental regulation and pathogen related expression in Panax ginseng C. A. Meyer[J]. Mol Biol Rep, 2010, 37(7): 3445–3454. DOI:10.1007/s11033-009-9936-1 |
| [15] | Lim J M, Aoki K, Angel P, et al. Mapping glycans onto specific N-linked glycosylation sites of Pyrus communis PGIP redefines the interface for EPG:PGIP interactions[J]. J Proteome Res, 2009, 8(2): 673–680. DOI:10.1021/pr800855f |
| [16] | Joubert D A, Slaughter A R, Kemp G, et al. The grapevine polygalacturonase-inhibiting protein (VvPGIP1) reduces Botrytis cinerea susceptibility in transgenic tobacco and differentially inhibits fungal polygalacturonases[J]. Transgenic Res, 2006, 15(6): 687–702. DOI:10.1007/s11248-006-9019-1 |
| [17] | D'Ovidio R, Raiola A, Capodicasa C, et al. Characterization of the complex locus of bean encoding polygalacturonase-inhibiting proteins reveals subfunctionalization for defense against fungi and insects[J]. Plant Physiol, 2004, 135: 2424–2435. DOI:10.1104/pp.104.044644 |
| [18] | Liang F S, Zhang K C, Zhou C J, et al. Cloning, characterization and expression of the gene encoding polygalacturonase-inhibiting proteins (PGIPs) of peach[Prunus persica (L.) Batch][J]. Plant Sci, 2005, 168(2): 481–486. DOI:10.1016/j.plantsci.2004.09.011 |
| [19] | Ferrari S, Vairo D, Ausubel F M, et al. Tandemly duplicated Arabidopsis genes that encode polygalacturonase-inhibiting proteins are regulated coordinately by different signal transduction pathways in response to fungal infection[J]. Plant Cell, 2003, 15(1): 93–106. DOI:10.1105/tpc.005165 |
| [20] | Ferrari S, Sella L, Janni M, et al. Transgenic expression of polygalacturonase-inhibiting proteins in Arabidopsis and wheat increases resistance to the flower pathogen Fusarium graminearum[J]. Plant Biol, 2012, 14(1): 31–38. |
| [21] | Ferrari S, Galletti R, Vairo D, et al. Antisense expression of the Arabidopsis thaliana AtPGIP1 gene reduces polygalacturonase-inhibiting protein accumulation and enhances susceptibility to Botrytis cinerea[J]. Mol Plant Microbe Interact, 2006, 19(8): 931–936. DOI:10.1094/MPMI-19-0931 |
| [22] | Oliveira M B, Junior M L, Grossi-de-Sá M F, et al. Exogenous application of methyl jasmonate induces a defense response and resistance against Sclerotinia sclerotiorum in dry bean plants[J]. J Plant Physiol, 2015, 182: 13–22. DOI:10.1016/j.jplph.2015.04.006 |
 2016, Vol. 47
2016, Vol. 47


