丹参Salviae Miltiorrhizae RadixetRhizoma为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bge.的干燥根和根茎,具有活血祛瘀、通经止痛、清心除烦、凉血消痈之功效[1];三七Notoginseng Radix et Rhizoma为五加科人参属植物三七Panax notogin-seng (Burk.) F. H. Chen的干燥根和根茎,具有散瘀止血、消肿定痛之功效[1]。丹参与三七是主要的药对之一,目前,我国已生产上市的以丹参、三七为主药的复方制剂有复方丹参片[2]、复方丹参滴丸[3]、复方丹参缓释片[4]、三七丹参颗粒[5]、三七丹参片[6]等。但在这些制剂处方中丹参和三七的配伍比例存在很大差异,曾桂凤等[7]研究表明丹参与三七配伍合煎在一定程度上能够增加丹参中主要有效成分的提取率;陈宇飞等[8]研究表明三七可促进丹参酮ⅡA的溶出。本研究对丹参提取工艺参数以及在此参数控制下,与三七配伍提取后成分的溶出情况进行了研究。
1 仪器与材料DZTW电子调温电热套,天津市静海县工兴电器厂;BS-6KH电子天平,上海友声衡器有限公司;Ichrom5100高效液相色谱仪,大连依利特仪器工业有限公司;P230Ⅱ高效液相色谱仪,大连依利特仪器工业有限公司。
对照品隐丹参酮(批号140929,质量分数>98%)、迷迭香酸(批号140311,质量分数>98%)、丹酚酸B(批号140929,质量分数>98%),四川省维克奇生物科技有限公司;对照品丹参酮ⅡA(批号120910,质量分数>98%),成都植标化纯生物技术有限公司。三七药材(批号20160713)、丹参药材(批号20151101、20160715),均购于成都市荷花池中药材市场,经成都大学药学与生物工程学院刘涛研究员鉴定,丹参药材为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bge.的干燥根和根茎,三七药材为五加科人参属植物三七Panax notoginseng (Burk.) F. H. Chen的干燥根和根茎。甲醇、乙腈,均为色谱纯,购自西格玛奥德里奇(上海)贸易有限公司;水为娃哈哈或怡宝纯净水,其余试剂均为分析纯,市售。
2 方法与结果 2.1 丹参醇提最佳工艺条件优选 2.1.1 隐丹参酮、丹参酮ⅡA的定量测定[1](1)色谱条件:采用SinoPak C18色谱柱(250 mm×4.6 mm,5 μm);以甲醇-水(75:25)为流动相;柱温20 ℃;体积流量1.0 mL/min;进样量10 μL;检测波长为270 nm;理论塔板数按丹参酮ⅡA峰计算大于2 000。
(2)对照品溶液的制备:取隐丹参酮、丹参酮ⅡA对照品适量,精密称定,加甲醇制成质量浓度分别为隐丹参酮52.8 μg/mL、丹参酮ⅡA 90.7 μg/mL的混合对照品溶液。
(3)供试品溶液的制备:称取丹参药材100 g,按所设定的条件回流提取。提取液滤过,取滤液,即得。
(4)隐丹参酮、丹参酮ⅡA溶出量的测定:取“2.1.1(3)”项下供试品溶液进行定量测定,计算提取液中隐丹参酮、丹参酮ⅡA总量,并与提取丹参药材总量(100 g)相比,即为隐丹参酮、丹参酮ⅡA溶出量。
2.1.2 固含物的测定精密量取提取液50 mL,置已干燥至恒定质量的蒸发皿中,在水浴上蒸干后,于105 ℃干燥3 h,置干燥器中冷却30 min,迅速精密称定质量,并按照取样体积与样品总体积的比例折算成样品固含物总量。
2.1.3 丹参醇提最佳工艺研究以隐丹参酮、丹参酮ⅡA溶出量及固含物量为考察指标,采用单因素试验及正交试验法[9]优选丹参醇提最佳工艺条件。
(1)浸泡时间优选:利用单因素试验对浸泡时间进行筛选。称取丹参药材3份,每份100 g,分别浸泡0、0.5、1.0 h,8倍量70%乙醇回流提取3次,每次0.5 h。滤过,合并提取液,测定其隐丹参酮、丹参酮ⅡA溶出量及固含物量,利用加权评分法进行比较,固含物量、丹参酮ⅡA溶出量、隐丹参酮溶出量3者的权重系数为20%、50%、30%,综合评分=(固含物总量/固含物总量最大值)×20%+(隐丹参酮溶出量/隐丹参酮溶出量最大值)×30%+(丹参酮ⅡA溶出量/丹参酮ⅡA溶出量最大值)×50%,结果见表 1。结果表明随着浸泡时间的延长,加权评分下降,故本实验选择浸泡0 h,即不浸泡。
|
|
表 1 浸泡时间优选 Table 1 Optimization of soaking time |
(2)提取时间优选:研究表明丹参酮ⅡA不稳定,在长时间的提取过程中会转化分解,提取1.5 h后收率有明显下降的趋势[10-11]。利用单因素试验对提取时间进行筛选。称取丹参药材3份,每份100 g,浸泡0 h,8倍量70%乙醇提取3次,每次分别回流提取0.5、1.0、1.5 h。滤过,合并提取液,测定其隐丹参酮、丹参酮ⅡA溶出量及固含物量,利用加权评分法进行比较,结果见表 2。结果表明,随着提取时间延长,加权评分逐步升高,故本实验选择提取1.5 h。
|
|
表 2 提取时间优选 Table 2 Optimization of extraction time |
(3)正交试验考察提取工艺参数[9]:选取不同乙醇体积分数(A)、乙醇用量(B)、提取次数(C)为考察因素,以固含物量、丹参酮ⅡA溶出量、隐丹参酮溶出量3者的综合评分为指标。称取丹参药材9份,每份100 g,按L9(34)正交试验表进行试验。正交试验设计因素水平见表 3,试验设计及结果见表 3,方差分析见表 4。
|
|
表 3 L9(34)正交试验优选丹参醇溶性成分提取工艺 Table 3 Optimization of extraction of alcohol soluble components from SMRR by L9(34) orthogonal experiment |
|
|
表 4 丹参醇提工艺方差分析(综合评分) Table 4 Variance analysis of alcohol extraction process of SMRR (comprehensive score) |
直观分析可知,各因素对丹参醇提取工艺的影响顺序为C>A>B。表 4方差分析表明,因素A、B、C的影响均无显著性意义。因此,确定最佳提取工艺为A1B3C2,即加10倍量75%乙醇,提取2次,每次1.5 h。
(4)验证试验:称取丹参药材3份,每份50 g进行验证试验,结果隐丹参酮溶出量分别为467.5、494.9、471.1 μg/g,RSD为3.12%;丹参酮ⅡA溶出量分别为1.409 8、1.359 4、1.399 5 mg/g,RSD为1.92%;固含物量分别为20.72%、20.90%、22.58%,RSD为4.78%;结果表明所选择的工艺稳定可行。
2.2 丹参水提最佳工艺条件优选 2.2.1 迷迭香酸、丹酚酸B的定量测定[1](1)色谱条件:采用SinoPak C18色谱柱(250 mm×4.6 mm,5 μm);以甲醇-乙腈-水-甲酸(30:10:59:1)为流动相;柱温20 ℃;体积流量1.0 mL/min;进样量10 μL;检测波长为286 nm;理论塔板数按丹酚酸B峰计算大于2 000。
(2)对照品溶液的制备:取迷迭香酸、丹酚酸B对照品适量,精密称定,加甲醇制成质量浓度分别为迷迭香酸37.0 μg/mL、丹酚酸B 118.2 μg/mL的混合对照品溶液。
(3)供试品溶液的制备:称取丹参药材50 g,按所设定的工艺条件回流提取。提取液滤过,精密移取1 mL滤液于5 mL量瓶中,加水稀释至刻度,摇匀,即得。
(4)迷迭香酸、丹酚酸B溶出量测定:取“2.2.1(3)”项下供试品溶液进行定量测定,计算提取液中迷迭香酸、丹酚酸B总量,并与提取丹参药材总量50 g相比,即为迷迭香酸、丹酚酸B溶出量。
2.2.2 丹参水提最佳工艺参数研究选取水用量(A)、提取时间(B)、提取次数(C)为考察因素,以固含物量、迷迭香酸溶出量、丹酚酸B溶出量的综合评分[综合评分=(固含物总量/固含物总量最大值)×30%+(迷迭香酸溶出量/迷迭香酸溶出量最大值)×30%+(丹酚酸B溶出量/丹酚酸B溶出量最大值)×40%]为指标,称取丹参药材9份,每份50 g,按L9(34)正交试验表进行试验。正交试验设计因素水平见表 5,试验设计及结果见表 5,方差分析见表 6。
|
|
表 5 L9(34)正交试验优选丹参水溶性成分提取 Table 5 Optimization of extraction of aqueous soluble components from SMRR by L9(34) orthogonal experiment |
|
|
表 6 丹参水提工艺方差分析(综合评分) Table 6 Variance analysis of water extraction process of SMRR (comprehensive score) |
直观分析可知,各因素对丹参水提取工艺的影响顺序为C>B>A。表 6方差分析表明,因素B、C的影响具有极显著性意义,因素A的影响则无显著性意义。因此,确定最佳提取工艺为A1B3C3,即加8倍量水,提取3次,每次2.0 h。
2.2.3 验证试验称取丹参药材3份,每份50 g,按最佳工艺进行验证试验,结果迷迭香酸溶出量分别为0.329 5、0.333 5、0.316 7 mg/g,RSD为2.70%;丹酚酸B溶出量分别为8.049 2、7.961 7、7.803 6 mg/g,RSD为1.57%;固含物分别为55.45%、55.86%、54.81%,RSD为0.96%;表明所选择的工艺稳定可行。
2.3 三七对丹参中主要成分溶出的影响 2.3.1 对醇溶性成分丹参酮ⅡA的影响(1)色谱条件:采用SinoPak C18色谱柱(250 mm×4.6 mm,5 μm),以0.02%磷酸水溶液-乙腈为流动相,梯度洗脱:0~6 min,61%乙腈;6~20 min,61%~90%乙腈;20~20.5 min,90%~61%乙腈;20.5~25 min,61%乙腈;柱温20 ℃;体积流量1.0 mL/min;进样量10 μL,检测波长为270 nm;理论板数按丹参酮ⅡA峰计算大于6 000[1]。
(2)供试品溶液的制备:称取三七药材30 g,共3份,丹参药材50 g,共4份,4组(丹参单独提取,三七-丹参配伍1、2、3号)平行浸泡0 h、10倍量75%乙醇回流提取2次,每次1.5 h,合并提取液。提取液滤过,取滤液,即得。
(3)三七-丹参配伍对丹参酮ⅡA溶出的影响:取“2.3.1(2)”项下丹参单独提取、三七与丹参配伍提取供试品进行定量测定,计算丹参丹参酮ⅡA总溶出量,并根据判定“可疑值”能否舍弃的Smirnov法[12-13],计算判定值(T),依此判定三七对丹参醇溶性成分丹参酮ⅡA是否存在影响。结果见表 7。
|
|
表 7 三七对丹参中丹参酮ⅡA溶出的影响 Table 7 Effect of NRR on extraction of tanshinone ⅡA |
T=|Xi-X|/s
Xi为可疑值,X为包括可疑值在内的平均数,s为标准差
查询Smirnov法附表,n=4时,T>1.689表明有显著差异,而表 7中T值均小于1.689,说明三七对丹参中丹参酮ⅡA的提取无显著影响。
2.3.2 对水溶性成分丹酚酸B的影响(1)色谱条件:采用SinoPak C18色谱柱(250 mm×4.6 mm,5 μm);以乙腈-0.1%磷酸水溶液(22:78)为流动相;柱温20 ℃;体积流量1.2 mL/min;进样量10 μL;检测波长为286 nm;理论板数按丹酚酸B峰计算大于6 000[1]。
(2)供试品溶液的制备:称取三七药材30 g,共3份,丹参药材50 g,共4份,4组(丹参单独提取,三七-丹参配伍4、5、6号)平行8倍量水回流提取3次,每次2 h,合并提取液,样品液滤过,取滤液,即得。
(3)三七-丹参配伍对丹酚酸B溶出的影响:取“2.3.2(2)”项下丹参单独提取、三七与丹参配伍提取供试品进行定量测定,计算丹酚酸B总溶出量,并根据判定“可疑值”能否舍弃的Smirnov法,计算T值,结果见表 8。
|
|
表 8 三七对丹参中丹酚酸B溶出的影响 Table 8 Effect of NRR on extraction of salvianolic acid B |
查询Smirnov法附表,n=4时,T>1.689表明有显著差异,而表 8中T值均小于1.689,说明三七对丹参中丹酚酸B的溶出无显著影响。
2.4 三七对丹参中其他成分溶出的影响上述实验表明,三七对于丹参醇溶性成分丹参酮ⅡA和水溶性成分丹酚酸B的提取溶出无显著性影响。但有文献认为三七能促进丹参成分溶出,郑琴等[14]总结了丹参和三七的配伍研究概况,表明丹参、三七配伍合煎在一定程度上能够增加丹参主要有效成分的提取率;曹枫[15]测定了丹参、三七单煎与合煎水煎液的指纹图谱,结果表明,不同配比的合煎、分煎水煎液中出现了成分量的改变和成分数的增减。针对文献[7-8, 14]认为三七能促进丹参成分溶出的观点,本实验进一步研究了三七对丹参中其他醇溶性成分及水溶性成分的影响。
2.4.1 三七对丹参中其他醇溶性成分的影响按照“2.3.1”项下方法,将供试品所得峰的峰面积与参照物丹参酮ⅡA的峰面积进行比较,见图 1,得到峰面积之比,并计算其T值,结果见表 9,表中T值均小于1.689,表明三七对丹参中其他醇溶性成分的提取溶出无显著影响。
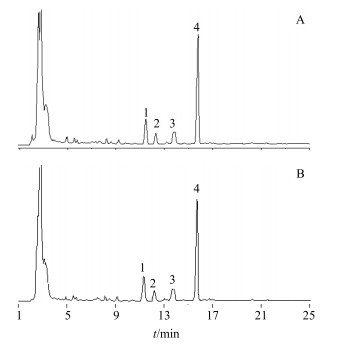
|
1-隐丹参酮4-丹参酮ⅡA 1-cryptotanshinone 4-tanshinone ⅡA 图 1 丹参单独提取(A)以及丹参-三七配伍提取(B)的HPLC图 Fig.1 HPLC of extraction of SMRR (A), SMRR and NRR compatible extraction (B) |
|
|
表 9 相关峰峰面积与参照物丹参酮ⅡA峰面积之比及T值 Table 9 Ratio of correlation peak area and tanshinone ⅡA peak area, and T value |
2.4.2 三七对丹参中其他水溶性成分的影响
按照“2.3.2”项下方法,将供试品所得峰的峰面积与参照物丹酚酸B的峰面积进行比较,见图 2,得到峰面积之比,并计算其T值,见表 10,表中T值均小于1.689,表明三七对丹参中其他水溶性成分的提取无显著影响。
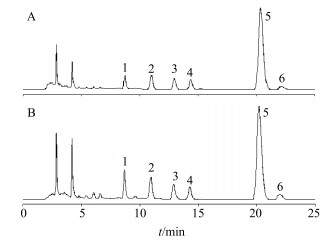
|
2-迷迭香酸5-丹酚酸B 2-rosmarinic acid 5-salvianolic acid B 图 2 丹参单独提取(A)以及丹参-三七配伍提取(B)的HPLC图 Fig.2 HPLC of extraction of SMRR (A), SMRR and NRR compatible extraction (B) |
|
|
表 10 相关峰峰面积与参照物丹酚酸B峰面积之比及T值 Table 10 Ratio of correlation peak area and salvianolic acid B peak area, and T value |
3 讨论
研究过程中发现回流提取时丹参主要成分丹参酮ⅡA提取转移率较低,查阅相关文献,任志会等[16]采用回流提取法考察不同体积分数乙醇对丹参酮ⅡA提取率的影响,结果显示丹参酮ⅡA提取转移率均小于85%。针对此现象,江力等[17]对《中国药典》2010年版一部含丹参制剂的提取工艺进行了分析,发现主要存在溶剂选择不当、提取时间过长、提取温度过高、提取次数过多以及丹参酮ⅡA对光不稳定等问题。
本实验采用判定“可疑值”能否舍弃的Smirnov法计算T值,Smirnov检验是一个非参数检验,可以检验2组数据是否来自同一分布,在本研究中,为了研究三七对丹参成分溶出的影响,用Smirnov法对采用平行实验所得到的结果进行统计分析,更与实验目的相符。
虽然文献报道[7-8, 14]中多次提及三七能促进丹参中成分溶出,但本实验结果表明三七对丹参中主要成分丹参酮ⅡA和丹酚酸B的提取溶出量无显著性影响,且三七对丹参中其他醇溶性成分和水溶性也无显著性影响。
造成结果差异的可能原因:①药材的来源及粒度:曾桂凤等[7]将三七与丹参粉碎至80目使用,陈宇飞等[8]采用由西安市药材公司提供的丹参饮片、三七饮片进行提取;曹枫[15]将丹参、三七粉碎至40目筛以上使用;而本实验使用从成都荷花池中药材市场购买的丹参和三七,按照实际大生产操作,将丹参切制成长度1~3 cm小段、三七碎成直径1 cm小块进行提取。②三七与丹参的配伍比例:陈宇飞等[8]实验中三七与丹参配伍比例为1:1,未考察不同比例的影响;曾桂凤等[7]研究了复方丹参配伍比例对丹参化学成分溶出的影响,三七与丹参配伍比例从0:10变化到10:1,结果表明三七与丹参配伍比例为5:3时丹参中主要成分溶出量最高,所以本实验采用三七与丹参配伍比例为5:3。③提取工艺:陈宇飞等[8]将三七与丹参按8倍量70%乙醇,加热回流提取3次,每次90 min,但未见提取工艺优选研究,因此,其选择的工艺可能存在偶然性,再将提取液通过浓缩、减压干燥等工艺过程,该工艺过程中丹参类成分在受热过程中可能有变化。而本实验对丹参提取工艺进行优选,并按实验所得丹参提取参数进行三七与丹参配伍提取。④统计学方法:曾桂凤等[7]、陈宇飞等[8]在考察提取工艺时,在数据统计时仅以数字高低进行判断,而未见文中进行数据的统计处理。本实验采用判定“可疑值”能否舍弃的Smirnov法计算T值,判断三七对丹参成分溶出有无明显的影响。上述因素均有可能影响实验结果,有待进一步讨论研究。
| [1] | 中国药典[S].一部. 2015. |
| [2] | 覃仁安, 罗佳波, 陈矛, 等. 复方丹参片对阿尔茨海默病大鼠脑内氨基酸类神经递质含量的影响[J]. 中草药, 2004, 35(8):905–907. |
| [3] | 李凌艳, 赵颖, 王平, 等. 复方丹参滴丸对豚鼠离体心脏心电图的影响[J]. 中草药, 2012, 43(11):2236–2241. |
| [4] | 岳鹏飞, 唐剑彬, 郑琴, 等. 基于抑制中性粒细胞呼吸爆发效应的复方丹参缓释片体外释放行为评价研究[J]. 中草药, 2010, 41(6):885–888. |
| [5] | 曾祎华, 韦克先, 张志兰. 三七丹参颗粒质量标准研究[J]. 亚太传统医药, 2013, 9(7):43–44. |
| [6] | 胡清茹, 王中晓, 鲁宜夏. 三七丹参片预处理对心肌缺血再灌注大鼠SOD及MDA的影响[J]. 医学理论与实践, 2011, 24(17):2017–2018. |
| [7] | 曾桂凤, 徐青, 肖红斌, 等. 复方丹参配伍比例对丹参化学成分溶出的影响[J]. 色谱, 2004, 22(2):141–143. |
| [8] | 陈宇飞, 王四旺, 罗卓荆, 等. 丹参配伍三七和川芎不同提取工艺对丹参酮ⅡA含量的影响[J]. 现代生物医学进展, 2011, 11(1):127–130. |
| [9] | 李群, 王瑾, 张会敏. 正交试验法优选桑白皮蜜炙工艺[J]. 中草药, 2013, 44(3):286–290. |
| [10] | 曹明成, 沈善, 潘纯发. 丹参提取工艺的实验研究[J]. 中成药, 1996, 18(1):4–6. |
| [11] | 杨千才, 柳仁民. 丹参脂溶性成分提取方法研究[J]. 中成药, 2010, 32(4):585–588. |
| [12] | 库雷志.磁共振扩散加权成像及动态增强成像在肺癌病理类型鉴别诊断价值研究[D].福州:福建中医药大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10393-1015321990.htm |
| [13] | 李良媛. SWI、血清铁蛋白评价帕金森病临床症状的研究[D].大连:大连医科大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10161-1015626943.htm |
| [14] | 郑琴, 彭常春, 沈美兰, 等. 丹参和三七的配伍研究概况[J]. 中国实验方剂学杂志, 2009, 15(2):85. |
| [15] | 曹枫.丹参三七配伍水煎液化学信息初步研究[D].北京:北京中医药大学, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10026-2004119054.htm |
| [16] | 任志会, 苏会霞, 柏艳柳. 丹参脂溶性及水溶性成分集成提取工艺研究[J]. 中国中医药信息杂志, 2009, 16(3):54–55. |
| [17] | 江力, 朱盛山, 李苑新, 等. 2010年版《中国药典》一部含丹参制剂的提取工艺分析[J]. 中国实验方剂学杂志, 2013, 19(19):361–364. |
 2016, Vol. 47
2016, Vol. 47


