东北岩高兰Empetrum nigrum L.var. japonicum K. Koch又名黑果子、夜明豆,为岩高兰科(Empetraceae)岩高兰属Empetrum L.常绿匍匐状小灌木,属药用珍稀植物,是岩高兰科在中国仅有的一个变种[1],全株可入药,具有补脾胃、滋阴保肝、明目等功能,用于治疗肚腹胀满和消化不良等症,还可作茶饮,具有助消化、提精神的养生功效[2-3]。为进一步发掘研究岩高兰的药用价值,对东北岩高兰全草甲醇提取液正己烷萃取物的化学成分进行了研究,从中分离得到6个查耳酮类化合物,分别鉴定为2′, 5′-二羟基-3′-甲氧基-4′, 6′-二甲基二氢查耳酮(2′, 5′-dihydroxy-3′-methoxy-4′, 6′-dimethyl-dihydrochalcone,1)、2′-甲氧基-4′, 5′-二羟基-3′, 6′-二甲基二氢查耳酮(4′, 5′-dihydroxy-2′-methoxy-3′, 6′-dimethyl-dihydrochalcone,2)、2′, 4′-二羟基二氢查耳酮(2′, 4′-dihydroxy-dihydrochalcone,3)、2′, 4′-二羟基查耳酮(2′, 4′-dihydroxy-chalcone,4)、2′-甲氧基-4′-羟基二氢查耳酮(2′-methoxy-4′-hydroxy-dihydrochalcone,5)、2′, 4′, β-三羟基二氢查耳酮(2′, 4′, β-trihydroxy-dihydrochalcone,6)。其中,化合物1、2为新化合物,命名为岩高兰素A和B;化合物5、6为首次从该植物中分离得到。
1 仪器与材料X-6显微熔点测定仪(温度未校正,北京泰克仪器有限公司);傅里叶变换红外光谱仪、紫外-可见吸收光谱仪(美国PE公司);Waters Xevo QTOF质谱仪(美国沃特斯公司);Bruker-600 MHz核磁共振仪(德国Bruker公司);HITACHI L-7100高压液相色谱仪(日本日立公司);HITACHI L-3350示差检测器(GL SCIRNCES Inc.);Inertsil PREP-ODS(250 mm×10 mm,5 μm)和PREP-Sil(250 mm×10 mm,5 μm)不锈钢色谱柱;柱色谱用硅胶(200~300目)为青岛海洋化工厂产品;薄层色谱硅胶板为烟台化工厂生产。
药材于2013年8月购买于内蒙古自治区根河市,经齐齐哈尔大学裴世春教授鉴定为东北岩高兰Empetrum nigrum L. var. japonicum K. Koch,标本(YGL-201308)保存于齐齐哈尔大学天然产物研究室。
2 提取与分离干燥的东北岩高兰全草7.5 kg粉碎后用甲醇室温浸泡提取4次,每次3 d,合并浸提液,浓缩,加水混悬,依次用正己烷、醋酸乙酯和正丁醇萃取4次,合并相同溶剂萃取液减压浓缩至恒定质量,得到正己烷萃取物384.2 g、醋酸乙酯萃取物598.5 g、正丁醇萃取物304.2 g。
取80.0 g正己烷萃取物,用硅胶柱色谱分离,依次用正己烷-醋酸乙酯8:2(8.0 L)、5:5(8.5 L)、0:1(6.0 L)梯度洗脱,得到13个组分Fr.1~13。Fr. 3(15.8 g)经硅胶柱色谱分离,正己烷-醋酸乙酯(9:1、8:2、0:1)梯度洗脱,得到9个组分Fr. 3-1~3-9。Fr. 3-4共3.7 g,取198.5 mg,经HPLC-SIL分离纯化得化合物1(43.2 mg)、2(9.8 mg)。Fr. 5(3.0 g)经硅胶柱色谱分离,正己烷-醋酸乙酯(8:2、7:3、0:1)梯度洗脱,得到8个组分Fr. 5-1~5-8。其中Fr. 5-3(562.1 mg)和Fr. 5-4(302.2 mg)重结晶后分别得到化合物3(126.1 mg)、4(123.3 mg)。Fr. 7(9.2 g)经硅胶柱色谱分离,正己烷-醋酸乙酯(8:2、7:3、0:1)梯度洗脱,得到9个组分Fr. 7-1~7-9。Fr. 7-7(430.9 mg)重结晶后得到化合物5(90.2 mg)。Fr. 7-5(482.7 mg)经HPLC-ODS分离纯化后得到化合物6(8.7 mg)。
3 结构鉴定化合物1:黄色粉末(正己烷-醋酸乙酯),三氯化铁反应呈暗绿色悬浊液。mp 75.5~76.7 ℃。HR-ESI-MS m/z: 301.145 5 [M+H]+(计算值301.144 0),确定分子式为C18H20O4。UVλmaxMeOH(nm): 210, 290;IRvmaxKBr(cm−1): 3 428, 3 026, 1 706, 1 613, 1 372。1H-NMR (600 MHz, CDCl3)中δ 7.29 (2H, t, J=7.2 Hz), 7.24 (2H, d, J=7.2 Hz), 7.19 (1H, t, J=7.2 Hz)处显示1组单取代苯的质子信号,δ 3.40 (2H, t, J=7.8 Hz), 3.03 (2H, t, J=7.8 Hz)处给出2个亚甲基信号峰,δ 3.67 (3H, s)处给出1个-OCH3,δ 2.12 (3H, s), 2.10 (3H, s)给出2个与不饱和碳相连的甲基,δ 13.46 (1H, s), 5.34 (1H, s)给出2个羟基质子峰。13C-NMR (150 MHz, CDCl3)及DEPT数据显示有18个碳信号,其中有1个羰基碳信号,12个不饱和碳信号,1个甲氧基碳信号,2个甲基碳信号和2个亚甲基碳信号。初步推测该化合物为查耳酮骨架。根据HMBC中δ 13.46 (1H, s)处羟基质子与C-1′, 2′, 3′相关可推断2′-位有羟基存在;δ 3.67 (3H, s)处单峰甲基与C-3′相关可推断出甲氧基位于C-3′位;由δ 2.12 (3H, s), 2.10 (3H, s)处2个单峰甲基分别与C-3′, 4′, 5′及C-1′, 5′, 6′相关,以及δ 5.34 (1H, s)处羟基质子与C-4′, 6′相关可推断出C-4′, 6′位有甲基取代,C-5′位有羟基取代。另外,根据H-α与C=O,H-β与C-α, 1, 2之间存在相关性,确定了化合物1的结构为2′, 5′-二羟基-3′-甲氧基-4, 6′-二甲基二氢查耳酮(图 1)。经Scifinder数据库检索,确定为新化合物,命名为岩高兰素A,其1H-NMR和13C-NMR数据见表 1。
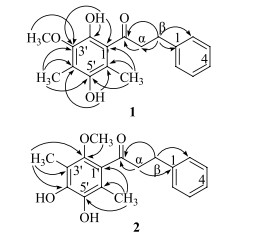
|
图 1 化合物1, 2的主要HMBC相关图 Fig.1 Key HMBC correlations of compounds 1 and 2 |
|
|
表 1 化合物1和2的NMR数据 Table 1 MR data of compounds 1 and 2 |
化合物2:黄色片状结晶(甲醇),三氯化铁反应呈深绿色。mp 61.0~63.4 ℃。HR-ESI-MS m/z: 301.144 6 [M+H]+(计算值301.144 0),确定分子式为C18H20O4。UVλmaxMeOH (nm): 204, 281;IRvmaxKBr(cm−1): 3 441, 3 022, 1 706, 1 596, 1 374。1H-NMR (600 MHz, CDCl3)中δ 7.29 (2H, t, J=7.2 Hz), 7.25 (2H, d, J=7.2 Hz), 7.20 (1H, t, J=7.2 Hz)处显示1组单取代苯的质子信号,δ 3.45 (2H, t, J=7.8 Hz), 3.03 (2H, t, J=7.8 Hz)处显示2个亚甲基信号峰,δ 3.71 (3H, s)处给出1个-OCH3,δ 2.11 (6H, s)给出2个与不饱和碳相连的甲基,δ 9.40 (2H, brs)处显示2个酚羟基质子信号。13C-NMR (150 MHz, CDCl3)及DEPT数据显示有18个碳信号,包括1个羰基碳信号,12个烯碳信号,2个甲基碳信号,1个甲氧基碳信号,2个亚甲基碳信号。化合物2与化合物1的波谱数据相似,推测也为二氢查耳酮骨架。HMBC中3′-CH3与C-2′, 3′, 4′,以及6′-CH3与C-1′, 5′, 6′的相关性可推断出3′、6′位有甲基取代;由δ 3.71处单峰甲基与C-2′相关可推断出甲氧基位于2′位。根据H-α与C=O、C-1,H-β与C=O、C-α、C-2之间存在相关性推断化合物2的结构为4′, 5′-二羟基-2′-甲氧基-3′, 6′-二甲基二氢查耳酮(图 1)。经Scifinder数据库检索,确定为新化合物,命名为岩高兰素B。其1H-NMR和13C-NMR数据见表 1。
化合物3:黄色粉末(甲醇),mp 68.7~70.4 ℃。1H-NMR (600 MHz, CDCl3) δ: 12.73 (1H, s, 2′-OH), 7.64 (1H, d, J=8.7 Hz, H-6′), 7.31 (2H, t, J=7.2 Hz H-3, 5), 7.24 (2H, d, J=7.2 Hz, H-2, 6), 7.22 (1H, t, J=7.2 Hz, H-4), 6.38 (1H, d, J=2.4 Hz, H-3′), 6.36 (1H, dd, J=8.7, 2.4 Hz, H-5′), 3.22 (2H, t, J=9.6 Hz, H-α), 3.04 (2H, t, J=9.6 Hz, H-β);13C-NMR (150 MHz, CDCl3) δ: 140.8 (C-1), 128.4 (C-2), 128.6 (C-3), 126.3 (C-4), 128.6 (C-5), 128.4 (C-6), 39.7 (C-α), 30.3 (C-β), 203.7 (C=O), 113.9 (C-1′), 162.5 (C-2′), 103.6 (C-3′), 165.2 (C-4′), 107.7 (C-5′), 132.2 (C-6′)。以上数据与文献报道[4]基本一致,故鉴定化合物3为2′, 4′-二羟基二氢查耳酮。
化合物4:黄色粉末(甲醇),mp 151.4~152.1 ℃。1H-NMR (600 MHz, CDCl3) δ: 13.36 (1H, s, 2′-OH), 7.89 (1H, d, J=15.4 Hz, H-β), 7.85 (1H, d, J=8.5 Hz, H-6′), 7.66 (2H, m, H-3, 5), 7.59 (1H, d, J=15.4 Hz, H-α), 7.43 (3H, m, H-2, 4, 6), 6.46 (1H, dd, J=8.5, 2.5 Hz, H-5′), 6.44 (1H, d, J=2.5 Hz, H-3′);13C-NMR (150 MHz, CDCl3) δ: 134.7 (C-1), 129.0 (C-2), 128.6 (C-3), 130.8 (C-4), 128.6 (C-5), 129.0 (C-6), 120.3 (C-α), 144.7 (C-β), 192.0 (C=O), 114.6 (C-1′), 166.5 (C-2′), 103.8 (C-3′), 162.7 (C-4′), 107.8 (C-5′), 132.1 (C-6′)。以上数据与文献报道[5]基本一致,故鉴定化合物4为2′, 4′-二羟基查耳酮。
化合物5:黄色粉末(甲醇),mp 131.4~133.7 ℃。1H-NMR (600 MHz, CDCl3) δ: 7.74 (1H, d, J=9.2 Hz, H-6′), 7.28 (2H, t, J=7.2 Hz, H-3, 5), 7.23 (2H, d, J=7.2 Hz, H-2, 6), 7.17 (1H, t, J=7.2 Hz, H-4), 6.45 (1H, dd, J=9.2, 2.2 Hz, H-5′), 6.44 (1H, d, J=2.2 Hz, H-3′), 3.83 (3H, s, 2′-OMe), 3.28 (2H, t, J=7.5 Hz, H-α), 3.00 (2H, t, J=7.5 Hz, H-β);13C-NMR (150 MHz, CDCl3) δ: 141.8 (C-1), 128.5 (C-2), 128.4 (C-3), 125.9 (C-4), 128.4 (C-5), 128.5 (C-6), 30.7 (C-α), 45.3 (C-β), 200.3 (C=O), 120.5 (C-1′), 161.5 (C-2′), 99.0 (C-3′), 161.3 (C-4′), 108.0 (C-5′), 133.0 (C-6′), 55.4 (2′-OMe)。以上数据与文献报道[5]基本一致,故鉴定化合物5为2′-甲氧基-4′-羟基二氢查耳酮。
化合物6:无色粉末(甲醇),mp 165.5~167.0 ℃。1H-NMR (600 MHz, CDCl3) δ: 7.87 (1H, d, J=8.4 Hz, H-6′), 7.47 (2H, d, J=7.2 Hz, H-2, 6), 7.43 (2H, t, J=7.2 Hz, H-3, 5), 7.39 (1H, t, J=7.2 Hz, H-4), 6.54 (1H, dd, J=8.4, 2.4 Hz, H-5′), 6.47 (1H, d, J=2.4 Hz, H-3′), 5.47 (1H, dd, J=13.2, 3.0 Hz, H-β), 3.04 (1H, t, J=16.8, 13.2 Hz, H-α), 2.84 (1H, dd, J=16.8, 3.0 Hz, H-α);13C-NMR (150 MHz, CDCl3) δ: 138.7 (C-1), 128.9 (C-2), 128.8 (C-3), 126.2 (C-4), 128.8 (C-5), 128.9 (C-6), 44.3 (C-a), 79.9 (C-β), 190.8 (C=O), 115.2 (C-1′), 162.7 (C-2′), 103.5 (C-3′), 163.6 (C-4′), 110.6 (C-5′), 129.4 (C-6′)。根据其1H-NMR、13C-NMR及HMBC等波谱数据鉴定化合物6为2′, 4′, β-三羟基二氢查耳酮。经查阅文献,只报道了该化合物的结构[6],未报道其波谱数据。
4 体外抗肿瘤活性为研究东北岩高兰中查耳酮类化合物的抗肿瘤活性,采用MTT法,测试了6种查耳酮类单体化合物对人宫颈癌细胞HeLa体外增殖抑制作用,结果显示,化合物6有一定抑制作用,IC50值为49.8 μg/mL,其余化合物无明显抑制作用。
| [1] | 陈辉. 东北岩高兰的分布及保护利用价值[J]. 内蒙古林业调查设计, 2011, 34(6):120–121. |
| [2] | 尹君, 崔克城, 刘景贵, 等. 亚洲岩高兰的利用价值[J]. 特种经济动植物, 2002(1):23. |
| [3] | 李瑞明, 王振月, 康毅华, 等. 岩高兰生药学研究[J]. 中南药学, 2005, 3(3):175–177. |
| [4] | 吕芳, 徐筱杰. 藏药镰形棘豆中黄酮类化学成分研究[J]. 中国中药杂志, 2007, 32(4):318–320. |
| [5] | 张玉莲, 梅任强, 刘熙, 等. 东北岩高兰化学成分研究[J]. 中草药, 2014, 45(16):2293–2298. |
| [6] | Jiang H, Hu J R, Zhan W Q, et al. Screening for fractions of Oxytropis falcata Bunge with antibacterial activity[J]. Nat Prod Res, 2009, 23(10): 953–959. DOI:10.1080/14786410902906934 |
 2016, Vol. 47
2016, Vol. 47


