2. 北京中医药大学 中药学院, 北京 100102
2. School of Chinese Meteria Medica, Beijing University of Chinese Medicine, Beijing 100102, China
地黄Rehmannia glutinosa为玄参科(Scrophulariaceae)植物地黄Rehmannia glutinosa Libosch.的新鲜或干燥块根,其干燥块根习称为“生地黄”,而其炮制品为“熟地黄”。生地黄具清热凉血,养阴生津之功效,与熟地黄的功能有所不同,可能与其在加工炮制过程中化学成分的变化有密切关系[1-4],所以分别建立质量控制方法能够保证临床用药的有效性。国内外对于地黄较多研究,生地黄不同部位以及药材的指纹图谱也已见诸报道[5-8],还有针对含有地黄的中药复方的化学成分研究[9]。但是通过建立指纹图谱与化学成分定性分析相结合对生地黄进行质量控制的研究尚未见报道[10-11],并且,现有的地黄化学成分分析所鉴定的化合物数量少,难以实现地黄药材化学成分的全面分析。因此目前仍缺乏整体的综合评价地黄质量的方法。本实验通过建立生地黄HPLC指纹图谱,并结合系统的化学成分鉴定,为生地黄质量综合评价提供可行方法,并为进一步药效物质基础研究提供依据
1 实验材料岛津高效液相色谱仪(配备泵LC-20ADXR×2,自动进样器SIL-20AC,柱温箱CTO-20A,紫外检测器SPD-M20A,脱气机DGU-20A,控制器CBM-20A,日本岛津公司);Accela 600 pump高效液相色谱-LTQ-Orbitrap XL质谱联用仪(美国Thermo Scientific公司);Milli-Q超纯水净化系统(美国Millipore公司);Mettler ME204型电子分析天平(瑞士Mettler Toledo公司)。色谱级和质谱级甲醇、乙腈以及质谱级甲酸均购自美国Thermo Fisher公司,水为超纯水,其余试剂均为分析纯。毛蕊花糖苷由本实验室制备、鉴定所得,并经HPLC-DAD检测,质量分数均大于98%。
15批地黄药材(表 1)经北京大学药学院屠鹏飞教授鉴定均为玄参科植物地黄Rehmannia glutinosa Libosch.的干燥块根。样本存放于北京中医药大学中药现代研究中心。
|
|
表 1 15批生地黄药材信息 Table 1 Sources of 15 batches of Rehmanniae Radix |
2 方法与结果 2.1 溶液的制备 2.1.1 供试品溶液的制备
取生地黄切成约5 mm的小块,经80 ℃减压干燥24 h后,磨成粗粉。取约2.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇20.0 mL,密塞,称定质量,超声提取40 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,用0.22 μm微孔滤膜滤过,取续滤液,即得。
2.1.2 对照品溶液的制备取毛蕊花糖苷对照品适量,精密称定,加50%甲醇溶解并稀释成含毛蕊花糖苷40 μg/mL的对照品溶液。
2.2 HPLC指纹图谱的建立 2.2.1 色谱条件Agilent Extend C18色谱柱(250 mm×4.6 mm,5.0 μm),柱温40 ℃,体积流量1.0 mL/min,检测波长215 nm,进样量5 μL。流动相为乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱程序为0~15 min,2%~5% A;15~29 min,5%~15% A;29~50 min,15%~35% A;50~55 min,35%~57% A;色谱采集时间55 min。
2.2.2 精密度试验取地黄粗粉(S10)约2.0 g,按“2.1.1”制备供试品溶液,在“2.2.1”所述色谱条件下连续进样6次,将所得的色谱图输入“中药色谱指纹图谱相似度评价系统(2004A版)”进行处理,相似度高于0.998。以色谱峰7(毛蕊花糖苷)为参照峰,其他9个色谱峰的相对保留时间RSD值均小于0.26%,相对峰面积RSD值均小于2.23%。
2.2.3 稳定性试验取供试品溶液分别在0、2、4、6、8、12和24 h按“2.2.1”所述方法进样分析,记录指纹图谱。将所得的色谱图输入“2.2.2”项下相似度评价系统软件进行处理,相似度高于0.996。以色谱峰7(毛蕊花糖苷)为参照峰,其他9个色谱峰的相对保留时间RSD值小于0.23%,相对峰面积RSD值小于6.93%。
2.2.4 重复性试验取地黄粗粉(S10)6份,每份约2.0 g,按“2.1.1”项方法制备供试品溶液,按“2.2.1”所述方法进样分析,记录指纹图谱。将所得的色谱图输入“2.2.2”项下相似度评价系统软件进行处理,相似度高于0.975。以色谱峰7(毛蕊花糖苷)为参照峰,其他9个色谱峰的相对保留时间RSD值小于0.16%,相对峰面积RSD值均小于6.99%。
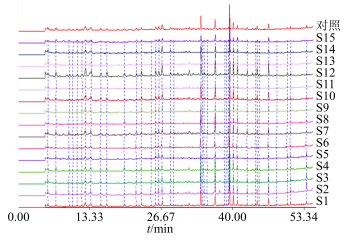
2.2.5 生地黄指纹图谱的建立与相似度评价按“2.1.1”项所述方法制备15批次样品的供试品溶液,按“2.2.1”项所述色谱条件进行分析,得到各批次药材的HPLC指纹图谱,将所得数据输入“2.2.2”项相似度评价系统软件进行处理,15批叠加的HPLC指纹图谱见图 1,同时生成对照指纹图谱(图 2)。以色谱峰7(毛蕊花糖苷)为参照,其他9个色谱峰的相对保留时间均小于1.18,RSD值均小于0.17%,表明10个共有峰具有较好的保留重现性。计算得到的15批样品与对照指纹图谱的相似度结果见表 2。结果表明各批次药材之间具有较好的一致性,所建立的HPLC指纹图谱可用于生地黄的质量评价。
|
图 1 15批生地黄药材的HPLC指纹图谱(215 nm) Fig.1 HPLC fingerprints of 15 batches of Rehmanniae Radix (215 nm) |

|
图 2 生地黄药材的对照指纹图谱 Fig.2 Similarity results of 15 batches of Rehmanniae Radix |
|
|
表 2 15批生地黄相似度结果 Table 2 Similarity results of 15 batches of Rehmanniae Radix |
2.3 HPLC-ESI-MS分析条件 2.3.1 质谱条件
电喷雾离子源(ESI)负离子模式检测,全离子扫描模式,质量扫描范围m/z 150~1 000。喷雾电压3 kV,毛细管电压-35 V,毛细管温度350 ℃,鞘气体积流量40 L/min,辅助气体积流量20 L/min。一级质谱采用FT全扫描,分辨率为30 000,多级质谱采用数据依赖性扫描,进行碰撞诱导解离(CID)模式,碰撞能设为35%。
2.3.2 色谱条件Sigma-Aldrich Supelco Discovery® HS F5-3色谱柱(150 mm×3.0 mm,3.0 μm),柱温25 ℃,体积流量0.5 mL/min,进样量5 μL。流动相乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱程序为0~8 min,2%~15% A;8~15 min,15%~35% A;15~17 min,35%~80% A;17~20 min,80%~90% A;20.1~25 min,2% A。
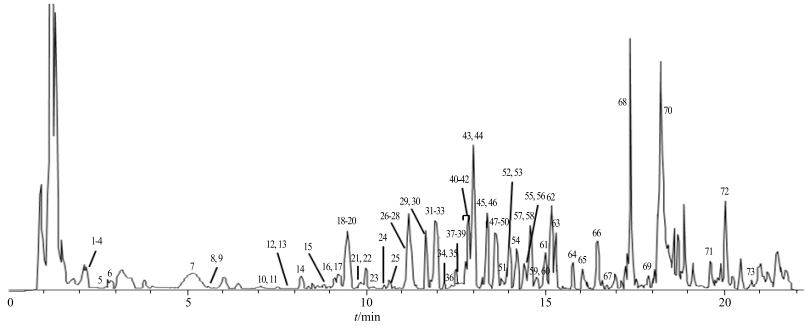
2.4 成分鉴定采用UPLC-LTQ-Orbitrap MS对甲醇超声提取的样品(S10)进行化学成分定性分析,负离子模式下基峰图见图 3,共检出73个化合物。通过对照品、保留时间和质谱信息,并结合相关文献数据[11-15]比对进行化学成分确认,初步鉴定了其中67个化合物,另有6个未知化合物,其中9个化合物通过对照品指认,结果见表 3。
|
图 3 生地黄甲醇提取样品负离子模式下基峰图 Fig.3 Base peak chromatogram in negative mode of methanol extract fromRehmanniae Radix |
|
|
表 3 生地黄甲醇提取样品的HPLC-ESI-MS化学成分分析 Table 3 Chemical constituents of methanol extract from Rehmanniae Radix analyzed by HPLC-ESI-MS |
3 讨论 3.1 指纹图谱色谱条件优化
本实验比较了甲醇-水、乙腈-水、乙腈-0.1%甲酸水、乙腈-0.1%磷酸水作为流动相,在215 nm检测波长下的结果,甲醇-水系统洗脱所得到的色谱峰不成形,乙腈-水条件下色谱峰峰形差,采用0.1%甲酸水虽然改善了峰形,但会造成基线漂移,故选用乙腈-0.1%磷酸水作为HPLC指纹图谱的流动相。同时考察了不同流速、柱温、进样量等条件对于生地黄指纹图谱的影响,以所得色谱信息最多,满足HPLC指纹图谱信息量大的检测要求进行优化。
3.2 指纹图谱实验条件优化本实验比较了用不同提取溶剂,如25%甲醇、50%甲醇和甲醇,在超声、回流、静置条件下提取生地黄样品。通过对比不同方法所得到的色谱峰峰容量,并考虑到前处理方法的简便和可靠性,最终确定甲醇超声提取作为样品处理方法。又分别考察了15、40、60 min的超声处理时间,结果表明提取时间对保留时间在30 min前的峰容量影响不大,而超声提取40 min时对于极性稍小的色谱峰的峰容量达到最大,故选取40 min作为超声处理时间。同时考察了不同甲醇体积所提取样品对于指纹图谱的影响,确定了2.0 g地黄加入20.0 mL甲醇(1:10)提取。
本研究建立了生地黄药材指纹图谱和化学成分定性分析相结合的质量评价方法。利用中药指纹图谱综合、快速的检测方法,通过其丰富的色谱峰信息以及共有峰相似度的评价,对生地黄药材整体评价。同时通过液质联用技术,采用LTQ-Orbitrap XL高分辨质谱,将线性离子阱的多级质谱功能和Orbitrap高质量精确度和高分辨能力结合,为生地黄化学成分的鉴定和分析提供了丰富、准确的信息,为所建立的质量评价方法提供更可靠的依据。
| [1] | 曹建军, 梁宗锁, 杨东风, 等. 地黄HPLC-DAD多波长指纹图谱的建立及其在熟地黄炮制中的应用[J]. 中草药 , 2014, 45 (2) :265–270. |
| [2] | 李红伟, 孟祥乐. 地黄化学成分及其药理作用研究进展[J]. 药物评价研究 , 2015, 38 (2) :218–228. |
| [3] | 孟祥龙, 马俊楠, 张朔生, 等. 熟地黄炮制(九蒸九晒)过程中药效化学成分量变化及炮制辅料对其影响研究[J]. 中草药 , 2016, 47 (5) :752–759. |
| [4] | 张文婷, 岳超, 黄琴伟, 等. 地黄生品与炮制品中8个糖类成分及不同炮制时间点其量变化分析[J]. 中草药 , 2016, 47 (7) :1132–1136. |
| [5] | 郭东艳, 张丽娟, 王梅, 等. 生地黄止血有效部位HPLC指纹图谱研究[J]. 中国实验方剂学杂志 , 2011, 17 (4) :90–92. |
| [6] | 高新彪, 孙磊, 乔善义, 等. 六味地黄浓缩丸HPLC指纹图谱研究[J]. 中国中药杂志 , 2012, 37 (22) :3411–3415. |
| [7] | 张杰, 刘炯, 张萌, 等. 生地黄低聚糖部位的HPLC指纹图谱[J]. 中国实验方剂学杂志 , 2014, 20 (22) :41–44. |
| [8] | 余进, 王义明, 梁琼麟, 等. 生地黄药材指纹图谱研究[J]. 江西中医药大学学报 , 2012, 24 (4) :40–43. |
| [9] | Su S L, Cui W X, Zhou W, et al. Chemical fingerprinting and quantitative constituent analysis of Siwu decoction categorized formulae by UPLC-QTOF/MS/MS and HPLC-DAD[J]. Chin Med , 2013, 8 (1) :1–15. DOI:10.1186/1749-8546-8-1 |
| [10] | Gong L L, Xu H Y, Wang L, et al. Identification and evaluation of the chemical similarity of Yindan xinnaotong Samples by ultra high performance liquid chromatography with quadrupole time-of-flight mass spectrometry fingerprinting[J]. J Sep Sci , 2016, 39 (3) :611–622. DOI:10.1002/jssc.v39.3 |
| [11] | Zhang N, Song Y L, Song Q Q, et al. Qualitative and quantitative assessments of Aconiti Lateralis Radix praeparata using high-performance liquid chromatography coupled with diode array detection and hybrid ion trap-time-of-flight mass spectrometry[J]. J Chromatogr Sci , 2016, 54 (6) :888–901. DOI:10.1093/chromsci/bmv245 |
| [12] | Wang H Y, Sun H, Zhang A H, et al. Rapid identification and comparative analysis of the chemical constituents and metabolites of Phellodendri amurensis cortex and Zhibai dihuang pill by ultra-performance liquid chromatography with quadrupole TOF-MS[J]. J Sep Sci , 2013, 36 (24) :3874–3882. DOI:10.1002/jssc.v36.24 |
| [13] | 张艳丽.地黄叶的化学成分研究[D].哈尔滨:黑龙江中医药大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10228-1013248995.htm |
| [14] | 刘彦飞.地黄活性物质与功能研究[D].北京:北京协和医学院, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10023-1013311933.htm |
| [15] | 卢鹏伟.地黄的化学成分和炮制的比较研究[D].开封:河南大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10475-2008096254.htm |
 2016, Vol. 47
2016, Vol. 47


