金芪降糖片(Jinqi Jiangtang Tablet, JQJT)是由黄连Coptidis Rhizoma、黄芪Astragali Radix、金银花Lonicerae Flos等组成,临床用于治疗消渴病气虚内热证及轻、中度非胰岛素依赖型糖尿病[1]。黄连的化学成分包括小檗碱、表小檗碱、小檗红碱、药根碱、黄连碱、木兰花碱、非洲防己碱等,其中小檗碱的量最高,是黄连清热燥湿、泻火解毒和降血糖的主要活性成分[2-3]。小檗碱又称黄连素,是一种季铵型异喹啉生物碱,它通过降低T细胞与外基质的黏附能力,阻断炎性细胞mRNA的复制与转录,发挥抗炎作用[4];通过促进胰岛β细胞再生及胰岛素释放,抑制肝脏糖原异生,促进糖酵解,从而发挥降血糖作用[5-8]。
中药配伍可导致主要药效成分间的药物相互作用,药动学研究对阐明复方中药活性成分在吸收、分布、代谢和排泄过程中的药物相互作用至关重要。本实验研究了金芪降糖片中药材配伍对黄连主要活性成分小檗碱大鼠体内药动学的影响,探讨金芪降糖片的药材配伍合理性,为临床应用提供参考。
1 材料与方法 1.1 仪器与试剂日本岛津LCMS-8040三重四极杆液相色谱质谱联用仪(包括LC-30AD二元泵、SPD-M20A检测器、CTO-20AC柱温箱、SIL-30AC自动进样器、DGU-20A5在线真空脱气机、CBM-20A控制器、电喷雾离子化源、LCMS-Solution工作站);德国Eppendorf 5810R型高速离心机;美国Beckman公司Microfuge 20R高速离心机;德国Sartorius BP211D型电子天平;中国上海精科天平厂JA3003型电子天平;韩国BioTron公司Ecospin 3180C真空冷冻干燥机;上海沪西分析仪器厂WH-2微型漩涡混合仪;天津仪器厂Vortex-5型漩涡震荡器;昆山市超声仪器有限公司KQ-250E型超声波清洗器。
盐酸小檗碱(质量分数≥98%,批号110713-200208,中国食品药品检定研究院);绿原酸(质量分数≥98%,批号DR13313,上海历鼎生物技术有限公司);内标为咖啡因(质量分数>98%,批号121128,成都普菲德生物技术有限公司);水为屈臣氏蒸馏水;色谱纯甲醇(德国MERCK公司);色谱纯乙腈(美国TEDIA公司);色谱纯甲酸(Sigma公司);金芪降糖片(天津中新药业集团股份有限公司隆顺榕制药厂,批号CK08898)。
1.2 色谱与质谱条件 1.2.1 色谱条件采用Shim-pack XR-ODS III C18色谱柱(75 mm×2.0 mm,1.6 μm);流动相为乙腈-0.05%乙酸水溶液(15:85);体积流量0.4 mL/min;柱温为35 ℃。
1.2.2 质谱条件加热块温度400 ℃;DL管加热温度250 ℃;雾化气(N2)体积流量3.0 L/min;干燥气(N2)体积流量15.0 L/min;ESI源,离子喷雾电压−4.5 V;采用正离子多反应监测模式(MRM)检测,用于定量分析的离子对分别为m/z 336.1 [M+H]+→m/z 320.1(盐酸小檗碱,碰撞能量−30 V),m/z 195.1 [M+H]+→m/z 138.1(内标咖啡因,碰撞能量−19 V);运行时间5.0 min。
1.3 金芪降糖片定量测定及给药样品制备取同一批金芪降糖片,研细混匀。精密称定5.0 mg置于10 mL Eppendorf离心管中,加甲醇4 mL超声提取30 min后,4 000 r/min离心10 min,取上清;沉淀重复提取1次后,合并2次上清液,甲醇定容至10 mL。摇匀后用0.22 μm微孔滤膜滤过,取滤液进行小檗碱和绿原酸定量测定,测得金芪降糖片中含小檗碱15.33 mg/g,绿原酸10.89 mg/g。
给药前分别精密称取适量金芪降糖片粉末、盐酸小檗碱和绿原酸混合物及盐酸小檗碱适量,混悬于0.5%羧甲基纤维素钠溶液备用。
1.4 药动学研究18只雄性SD大鼠[体质量(250±20)g,湖北省实验动物研究中心,许可证号SCXK(鄂)2015-0018]随机分为3组,每组6只,即金芪降糖片组(0.42 g/kg,相当于盐酸小檗碱剂量为5 mg/kg)、盐酸小檗碱(5 mg/kg)+绿原酸(3 mg/kg)组及盐酸小檗碱组(5 mg/kg)。给药前禁食12 h、自由饮水。单次ig给药后分别于5、10、15、30、45、60、120、240、360、480、600、1 440 min经眼眶取血0.25 mL,置于预先肝素化的EP管中,静置30 min后,4 000 r/min离心10 min分离血浆,−80 ℃保存待测。
血浆样品处理方法:取100 μL血浆,依次加入甲醇5 μL、内标溶液5 μL(5 μg/mL咖啡因溶液)、甲醇200 μL,震荡5 min,12 000 r/min离心10 min后,取上清200 μL于另一EP管中,于35 ℃真空冷冻挥干。再用100 μL流动相复溶,震荡5 min,12 000 r/min离心10 min,取上清液10 μL进样分析。
应用DAS3.0软件(中国药理学会专业委员会)对测得盐酸小檗碱血药浓度数据进行非房室模型拟合,统计矩法计算盐酸小檗碱在大鼠体内的药动学参数。
1.5 数据分析方法实验数据以x±s表示,并运用SPSS软件、采用t检验法进行组间数据统计学分析。
2 结果 2.1 定量方法学考察取大鼠空白血浆100 μL按血浆样品处理方法处理,进样分析得色谱图 1-A,将含盐酸小檗碱对照品溶液(32 ng/mL)及内标溶液(250 ng/mL)的空白血浆依法操作得色谱图 1-B,取受试大鼠ig给予金芪降糖片后的血浆样品同法操作得色谱图 1-C。结果表明,咖啡因和盐酸小檗碱的保留时间分别为1.4 min和3.25 min,空白血浆中的内源性物质不干扰血浆中待测组分和内标的测定。
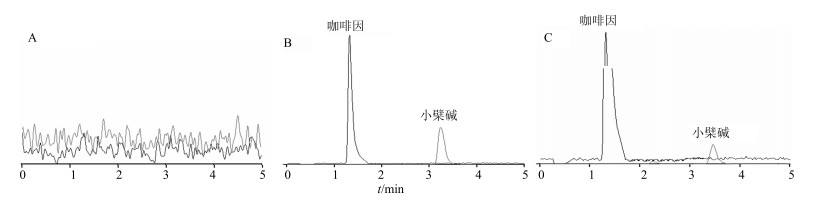
|
图 1 大鼠空白血浆(A)、空白血浆+盐酸小檗碱对照品+咖啡因(B)和ig金芪降糖片后45 min大鼠血浆样品+咖啡因(C)的LC-MS/MS色谱图 Fig.1 LC-MS/MS chromatograms of blank rat plasma (A), blank rat plasma + berberine hydrochloride refterence substances + caffeine (B), rat plasma collected at 45 min after oral administration with JQJT + caffeine (C) |
以血浆样品中待测物质量浓度为横坐标(X),待测物与内标物的峰面积比值为纵坐标(Y),用加权最小二乘法求得盐酸小檗碱的回归方程为Y=0.004 860 26 X+0.0165 126(R2=0.999),线性范围为0.25~64.00 ng/mL,定量下限为0.25 ng/mL。
空白血浆中加入盐酸小檗碱低、中、高质量浓度(0.5、8、60 ng/mL)质控(QC)样品的日内、日间精密度(RSD)均小于5.5%,提取回收率为96.3%~101.5%,基质效应为98.5%~100.7%,样品室温放置12 h、反复冻融3次和−80 ℃保存14 d的稳定性好(RSD≤4.3%);内标(250 ng/mL)的提取回收率为98.3%,基质效应为97.9%。
2.2 配伍对小檗碱药动学的影响金芪降糖片(0.42 g/kg,相当于小檗碱剂量为5 mg/kg)、盐酸小檗碱(5 mg/kg)+绿原酸(3 mg/kg)混合物及盐酸小檗碱(5 mg/kg)单次ig给药后的大鼠血浆中小檗碱药-时曲线见图 2,药动学参数见表 1。
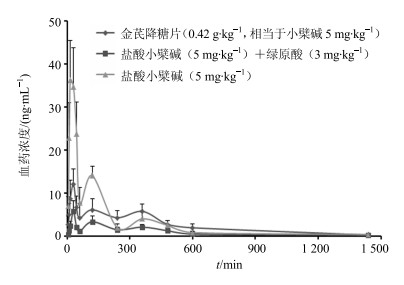
|
图 2 大鼠ig给药后小檗碱平均血药浓度-时间曲线(x±s, n=6) Fig.2 Mean plasma concentration-time curves of berberine hydrochloride after single ig administration to rats (x±s, n=6) |
|
|
表 1 大鼠ig给药后盐酸小檗碱大鼠体内的药动学参数 Table 1 In vivo pharmacokinetic parameters of berberine hydrochloride after ig administration to rats |
3 讨论
Chen等[9]研究了大鼠ig黄连提取物及戊己丸后小檗碱和巴马汀的药动学,发现戊己丸配伍使得小檗碱和巴马汀在大鼠体内的驻留时间(MRT)较黄连提取物延长了2~3倍。其他研究也发现小檗碱在大鼠体内存在的体内药动学性质受配伍中药的影响[10-11]。本研究结果表明:(1)ig给药后盐酸小檗碱的血浆药-时曲线出现了3个吸收峰,与文献报道的小檗碱在大鼠体内的药动学结果一致[12-15],这可能是由于小檗碱在大鼠体内存在重吸收及肝肠循环作用[16]。(2)大鼠单独ig盐酸小檗碱的药时曲线下面积(AUC0~∞)及达峰浓度(Cmax)最大,绿原酸与盐酸小檗碱合用时的AUC0~∞及Cmax最小,提示金银花与黄连配伍使用可能对小檗碱的体内吸收有抑制作用。(3)从体内平均驻留时间(MRT0~∞)、达峰时间(tmax)及消除半衰期(t1/2)来看,黄芪、金银花与黄连配伍对小檗碱的体内作用时间无显著影响。(4)绿原酸与盐酸小檗碱合用时的血浆清除率(CLz)和表观分布容积(Vz)显著高于其他2组,说明绿原酸能促进小檗碱的血浆清除及体内分布;但金芪降糖片组与盐酸小檗碱组间上述药动学参数无显著变化,提示黄芪、金银花与黄连配伍可能对小檗碱的血浆消除及体内分布存在相反的影响。
| [1] | 中国药典[S].一部. 2015. |
| [2] | Tang L Q, Wei W, Chen L M, et al. Effects of berberine on diabetes inducedby alloxan and a high-fat/high-cholesterol diet in rats[J]. J Ethnopharmacol , 2006, 108 (1) :109–115. DOI:10.1016/j.jep.2006.04.019 |
| [3] | Wang Y W, Campbella T, Perry B, et al. Hypoglycemic and insulin sensitizing effects of berberine in high-fat diet and streptozotocin-induced diabetic rats[J]. Metab Clin Exp , 2011, 60 (2) :298–305. DOI:10.1016/j.metabol.2010.02.005 |
| [4] | 田智勇, 李振国. 黄连的研究新进展[J]. 时珍国医国药 , 2004, 15 (10) :704–706. |
| [5] | Zhang X J, Deng Y X, Shi Q Z, et al. Hypolipidemic effect of the Chinese polyherbal Huanglian Jiedu decoction in type 2 diabetic rats and its possible mechanism[J]. Phytomedicine , 2014, 21 (5) :615–623. DOI:10.1016/j.phymed.2013.11.004 |
| [6] | Chen G, Lu F E, Xu L J. Effects of Huanglian Jiedu Decoction on glucose transporter 4 in target tissues of type 2 diabetic rats[J]. Chin J Integr Med , 2007, 5 (4) :412–415. DOI:10.3736/jcim |
| [7] | Dong H, Wang N, Zhao L, et al. Berberine in the treatment of type 2 diabetes mellitus:a systemic review and meta-analysis[J]. Evid Based Complement Alternat Med , 2012 . DOI:10.1155/2012/591654 |
| [8] | 袁雪海, 吕楠, 靳学海, 等. 新工艺金芪降糖片降糖和调脂作用研究[J]. 中草药 , 2015, 46 (21) :3219–3222. |
| [9] | Chen Y, Li Y J, Wang Y J, et al. Comparative pharmacokinetics of active alkaloids after oral administration of Rhizoma Coptidis extract and Wuji Wan formulas in rat using a UPLC-MS/MS method[J]. Eur J Drug Metab Pharmacokinet , 2015, 40 (1) :67–74. DOI:10.1007/s13318-014-0181-1 |
| [10] | Li X, Liu H J, Li J, et al. Simultaneous determination of berberine and palmatine in rabbit plasma by LC-MS-MS and its application in pharmacokinetic study after oral administration of Coptidis and Coptidis-Gardeniae Couple extract[J]. Chromatographia , 2009, 70 (7/8) :1113–1119. |
| [11] | Liu G H, He W, Cai H, et al. The simultaneous determination of berberine, palmatine, coptisine, epiberberine and jatrorrhizine in rat plasma by LC-MS/MS and a pharmacokinetic comparison after the oral administration of Rhizoma coptidis and Jiao-Tai-Wan extract[J]. Anal Methods , 2014, 6 (9) :2998–3008. DOI:10.1039/c3ay42000k |
| [12] | Yu S, Pang X Y, Deng Y X, et al. A sensitive and specific liquid chromatography mass spectrometry method for simultaneous determination of berberine, palmatine, coptisine, epiberberine and jatrorrhizine from Coptidis Rhizoma in rat plasma[J]. Int J Mass Spectrom , 2007, 268 (1) :30–37. DOI:10.1016/j.ijms.2007.08.003 |
| [13] | Deng Y T, Liao Q F, Li S H, et al. Simultaneous determination of berberine, palmatine and jatrorrhizine by liquid chromatography-tandem mass spectrometry in rat plasma and its application in a pharmacokinetic study after oral administration of coptis-evodia herb couple[J]. J Chromatogr B , 2008, 863 (2) :195–205. DOI:10.1016/j.jchromb.2007.12.028 |
| [14] | He W, Liu G H, Cai H, et al. Integrated pharmacokinetics of five protoberberine-type alkaloids in normal and insomnic rats after single and multiple oral administration of Jiao-Tai-Wan[J]. J Ethnopharmacol , 2014, 154 (3) :635–644. DOI:10.1016/j.jep.2014.04.040 |
| [15] | Zan B, Shi R, Wang T M, et al. Simultaneous quantification of multiple active components from Xiexin decoction in rat plasma by LC-ESI-MS/MS:application in pharmacokinetics[J]. Biomed Chromatogr , 2011, 25 (7) :816–826. DOI:10.1002/bmc.v25.7 |
| [16] | Qu Q M, Zhang M F. The pharmacokinetics of berberine[J]. Chin Acad Med Mag Org , 2002, 12 :31–35. |
 2016, Vol. 47
2016, Vol. 47


