2. 盐城卫生职业技术学院, 江苏 盐城 224006
2. Yancheng Health Vocational & Technical College, Yancheng 224006, China
苍耳草、苍耳子为同基源不同药用部位的药材[1],分别收载于1989版《江苏省中药材标准》和《中国药典》2015年版,分别为菊科植物苍耳Xanthium sibiricum Patr. 的地上部分和成熟带总苞的果实。苍耳草性微寒,具清风热、解毒之功效[2];苍耳子性温,具散风寒、通鼻窍、祛风湿之功效[3-4],二者的药性、药效有所不同。由于二者来源于同一植物,其化学成分类型基本一致[5],包括挥发油、倍半萜内酯、酚酸、蒽醌、黄酮、水溶性糖苷以及脂肪油等[6-7]。其中酚酸类成分被认为是苍耳草与苍耳子的重要药效物质基础[8-9]。近年来对苍耳草与苍耳子的品质研究主要集中在化学成分的定量测定和指纹图谱上[10-19],仅有苍耳子化学成分的差异研究报道[20],而未见苍耳草与苍耳子化学成分的整体变化或显著差异性化学成分研究,故一直以来很难从植物化学的角度说明二者药性、药效差异的物质基础。
近年来,液相色谱-质谱联用技术广泛应用于中药复杂体系的定性和定量分析中,常用的质谱技术有四级杆质谱、离子阱质谱、飞行时间质谱,及复合式串联质谱等[21]。得到较少碎片离子的低分辨率质谱能够测得化合物的精确分子质量,进而获得化合物的分子式,且根据多级之偶给出的化合物裂解碎片,结合相关文献资料能够快速鉴定化合物的结构[22]。植物代谢组学即研究不同物种、不同基因型或不同生态类型的植物在不同生长时期或者受某种刺激干扰前后的所有小分子代谢产物,并对其进行定性、定量分析,找出代谢变化的规律[23]。本研究借鉴植物代谢组学的思路和方法,采用超高效液相色谱-串联四级杆飞行时间高分辨质谱(UPLC-Triple TOF-MS/MS)技术分析不同产地来源的苍耳草与苍耳子化学成分的差异性,通过多元统计分析找出其中差异显著的化学成分及其变化规律,旨在为揭示苍耳草与苍耳子二者药性、药效差异的物质基础提供依据。
1 仪器与材料SIL-20A XR快速液相色谱仪(日本岛津公司),DGU-20A3脱气装置,LC-20AD XR液相,SIL-20A XR自动进样器,CTO-20AC柱温箱;Triple Q-TOF 5600质谱仪(AB Sciex公司)配备有电喷雾离子源(ESI)系统,Peakview 1.2数据处理工作站;ME36S型电子分析天平(德国赛多利斯公司);KQ-500E型超声波清洗器(功率500 W,频率40 kHz,昆山市超声仪器有限公司);湘仪H1650-W高速离心机(湖南湘仪实验室仪器开发有限公司)。
对照品绿原酸(批号110753-200413)、阿魏酸(批号110773-201012)、咖啡酸(批号110885-200102)、芦荟大黄素(批号110756-201007)、大黄素(批号110756-200110)、大黄酚(批号110796-201017)、槲皮素(批号100081-200907)、芦丁(批号0080-9705)、金丝桃苷(批号111521-200303)、紫云英苷(批号11092001)购于中国食品药品检定研究院,质量分数均大于98%;新绿原酸(批号12112712)、隐绿原酸(批号121126 05)、1,3-二咖啡酰奎宁酸(批号12061112)、3,5-二咖啡酰奎宁酸(批号12022803)、4,5-二咖啡酰奎宁酸(批号12022804)购于成都普瑞法科技开发有限公司,质量分数均大于98%;原儿茶醛(批号YECQ20140819)、原儿茶酸(批号YECS20140411)、3,4-二咖啡酰奎宁酸(批号YLYB2014041901)购于南京春秋生物工程有限公司,质量分数均大于98%;水为超纯水;甲醇、甲酸均为色谱纯(德国默克公司);其余试剂为分析纯。
苍耳草与苍耳子样品均为实地采集,样品信息见表 1,经南京中医药大学中药鉴定教研室刘训红教授鉴定。样品S1~S4为苍耳草,系菊科植物苍耳Xanthium sibiricum Patr. 的干燥地上部分;S5~S8为苍耳子,系菊科植物苍耳Xanthium sibiricum Patr. 的干燥成熟带总苞的果实;S4及S8为同一苍耳植株不同部位药材。样品晒干,每批样品随机取样3份。留样凭证存放于南京中医药大学中药鉴定实验室。
|
|
表 1 苍耳草、苍耳子药材样品信息 Table 1 Samplesof Xanthii Herba and Xanthii Fructus |
2 方法与结果 2.1 UPLC-MS条件 2.1.1 色谱条件
Agilent ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇(A)- 0.2%甲酸水溶液(B),梯度洗脱:0~10 min,20%~30% A;10~20 min,30%~35% A;20~30 min,35%~80% A;30~45 min,80 %~100% A;45~48 min,100%~20% A;体积流量1.0 mL/min;柱温35 ℃;进样量10 μL;检测波长254 nm。
2.1.2 质谱条件电喷雾离子源(ESI)为负离子模式;质量扫描范围m/z 50~1 000;喷雾电压5.0 kV;气帘气30 L/min;雾化气55 L/min;辅助气55
L/min;离子源温度500 ℃;碰撞室射出电压(CXP)9 V;去簇电压(DP)100 V。
2.2 供试品溶液制备取药材粉末(过3号筛),精密称取样品粉末1.0 g,置于100 mL具塞锥形瓶中,加入40 mL甲醇,称重,室温下超声提取30 min后取出,放冷以甲醇补足减失质量,静置冷却,12 000 r/min离心10 min,取上清液经0.22 μm的微孔滤膜滤过,即得。
2.3 样品分析根据设定的色谱-质谱条件,取供试品溶液进样分析,其中样品S4及S8所得的离子流(BPI)色谱图见图 1。

|
图 1 苍耳草 (S4,A) 与苍耳子 (S8,B) UPLC-Triple TOF-MS/MS基峰强度离子流BPI色谱图 Fig.1 UPLC-Triple TOF-MS/MS base peak intensity (BPI) chromatogram of Xanthii Herb (S4,A) and Xanthii Fructus (S8,B) |
2.4 多元统计分析
将原始质谱数据和色谱图导入Peakview 1.2数据处理工作站进行峰匹配、峰对齐、滤噪处理等,结果保存为文本格式。将文本文件调整后导入SIMCA-P 13.0软件进行分析。采用主成分分析(PCA),通过初步观察各样品的聚集情况,直观的表达苍耳草与苍耳子的化学成分差异;再用偏最小二乘判别分析(PLS-DA)分别对各样品进行分类,其中R2X、R2Y接近1,表示模型越稳定,Q2>0.5表示预测率高。根据PLS-DA模型得到的变量权重值找到潜在的差异化学成分。采用t检验,验证多维统计中找到的差异化学成分是否在单维统计中具有显著性差异,其中P<0.05有显著性差异。
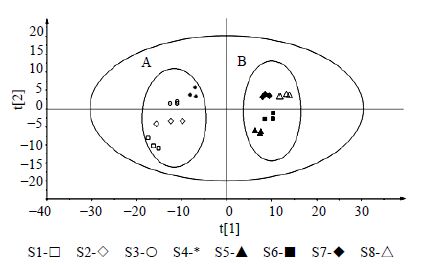
2.4.1 PCA分析采用PCA多变量模式识别方法对苍耳草与苍耳子样品进行降维分析(图 2)。从图中可以看到苍耳草与苍耳子样品可以很明显的分开,各自聚为一类,苍耳草样品在PC1轴的负方向,而苍耳子样品在PC1轴的正方向,表明其化学成分差异较大。苍耳子样品分布相对比较集中,说明组内差异很小,即化学物质组成相近;苍耳草样品分布相对比较分散,说明苍耳草组内差异大于苍耳子。
|
图 2 苍耳草 (A) 与苍耳子 (B) 在负离子模式下PCA得分图 Fig.2 PCA scores of Xanthii Herb (A) and Xanthii Fructus (B) in negative ion mode |
2.4.2 PLS-DA分析
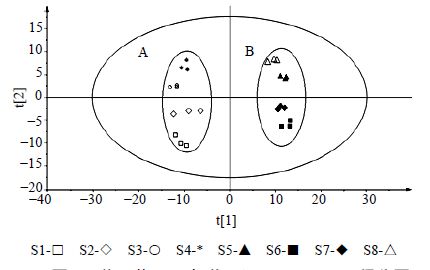
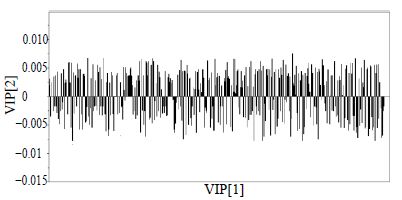
为了进一步证实苍耳草与苍耳子样品中化学成分的差异性,采用有监督的模式识别法PLS-DA分析确定苍耳草与苍耳子样品间的差异化学成分(图 3)。苍耳草与苍耳子样品沿PC1轴明显分开,其中模型参数为R2X=0.976,R2Y=0.982,Q2=0.972,证明模型有效可靠。采用模型相对应的柱状载荷图(图 4)寻找这两组的差异化学成分。常用变量载荷评价参数(VIP)值用于描述变量的贡献程度,当VIP值>1时,一般认为存在潜在的差异化学成分。对其VIP值和柱状载荷图进行考察,初步筛选出44个差异化学成分。
|
图 3 苍耳草 (A) 与苍耳子 (B) PLS-DA得分图 Fig.3 PLS-DA scores of Xanthii Herb (A) and Xanthii Fructus (B) |
|
图 4 苍耳草与苍耳子PLS-DA柱状载荷图 Fig.4 PLS-DA contribution loading plot of Xanthii Herb and Xanthii Fructus |
2.5 差异化学成分的鉴定
通过一级质谱确定精确相对分子质量,二级质谱获得裂解信息,结合HMDB(http://www.hmdb.ca/)和METLIN(http://metlin.scripps.edu/)数据库搜索及已有的文献报道[24-30]推测化合物结构式信息。对VIP>1且P<0.05的44个差异显著化学成分进行结构鉴定。初步鉴定出41个化学成分,其鉴定结果见表 2。
|
|
表 2 苍耳草与苍耳子中差异化学成分的鉴定 Table 2 Identification of different chemical constituents in Xanthii Herb and Xanthii Fructus |
2.6 共有差异化学成分的相对含量变化
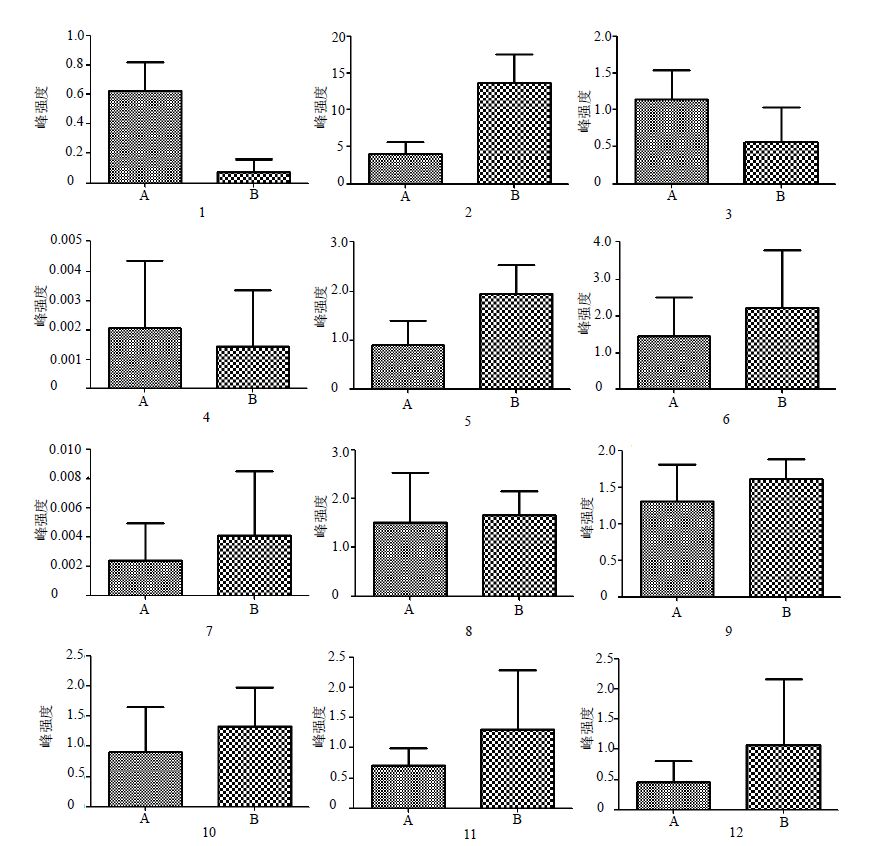
不同产地的苍耳草与苍耳子8批样品中存在12个共有的差异化学成分,包括蔗糖、甘草素-4′-O-芹糖基-O-葡萄糖苷、槲皮素-3-O-(6′-O-丙二酰基) 葡萄糖苷、3′,4′,5,7-四甲氧基黄酮、隐绿原酸、1,3-二咖啡酰奎宁酸、苯乙酸丁酯、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、异鼠李素-7-O-葡萄糖苷、4,5-二咖啡酰奎宁酸、硬脂酸。
提取共有差异成分在各组间对应的峰强度数值以代表其量,对苍耳草和苍耳子样品间同一物质峰强度的平均值和标准差进行计算和作图,能够得到各共有差异成分在不同组间的变化(图 5)。由此可以看出,12个共有差异化学成分中,甘草素-4′-O-芹糖基-O-葡萄糖苷、槲皮素-3-O-(6′-O-丙二酰基) 葡萄糖苷、隐绿原酸、1,3-二咖啡酰奎宁酸、苯乙酸丁酯、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸、异鼠李素-7-O-葡萄糖苷、4,5-二咖啡酰奎宁酸、硬脂酸的相对含量以苍耳子较高;蔗糖、3′,4′,5,7-四甲氧基黄酮的相对含量以苍耳草较高。
|
1-蔗糖 2-甘草素-4′-O-芹糖-O-葡萄糖苷 3-槲皮素-3-O-(6′-O-丙二酰)葡萄糖苷 4-3′,4′,5,7-四甲氧基黄酮 5-隐绿原酸 6-1,3-二咖啡酰奎宁酸 7-苯乙酸丁酯 8-3,4-二咖啡酰奎宁酸 9-3,5-二咖啡酰奎宁酸 10-异鼠李素-7-O-葡萄糖苷 11-4,5-二咖啡酰奎宁酸 12-硬脂酸 1-sucrose 2-liquiritigenin 4′-O-apiosyl-O-glucoside 3-quercetin-3-O-(6′-O-malonyl)-glucoside 4-3′,4′,5,7-tetramethoxyflavone 5-4-dicaffeoylquinic acid 6-1,3-dicaffeoylquinic acid 7-butyl phenylacetate 8-3,4-dicaffeoylquinic acid 9-3,5-dicaffeoylquinic acid 10-isorhamnetin-7-O-glucoside 11-4,5-dicaffeoylquinic acid 12-octadecanoic acid 图 5 苍耳草 (A) 与苍耳子 (B) 样品中共有差异化学成分的相对含量 Fig.5 Relative contents of different chemical constituents in Xanthii Herba (A) and Xanthii Fructus (B) |
3 讨论 3.1 色谱条件优化
分别考察了甲醇-水、乙腈-水、甲醇-0.1%甲酸水、甲醇-0.2%甲酸水等作为流动相对样品中各峰分离度的影响,在流动相中加入一定比例的甲酸可增强样品中待测物的保留,并减少色谱峰拖尾。结果表明,采用甲醇-0.2%甲酸水溶液梯度洗脱时,峰形较好且有良好的分离效果。
3.2 质谱条件优化分别考察了样品中化学成分在正、负离子模式下的响应情况。结果表明,负离子模式比正离子模式提供了更多的峰信息,故采用负离子模式进行分析。
3.3 供试品制备方法的优化供试品溶液的制备中分别考察了甲醇、70%和50%甲醇水3种溶液作为提取溶剂的情况,结果表明以甲醇为溶剂的色谱峰峰形优于其他两种溶剂。同时考察了超声提取30、60、90 min超声提取时间,结果表明超声提取30 min与其他时间的提取效果无明显差异。还考察了料液比1∶20、1∶30、1∶40,结果表明料液比为1∶40具有较大的提取效率。
4 结论苍耳草、苍耳子为同基源不同药用部位的药材,二者虽化学成分类型基本一致,但其药性、药效有所不同。本研究从植物化学的角度,探讨了苍耳草与苍耳子化学成分的整体差异,为说明苍耳草与苍耳子药性、药效的差异提供了一些实验资料。
实验结果显示,苍耳草与苍耳子中44个化学成分存在显著差异,主要为酚酸、黄酮、蒽醌、倍半萜内酯和脂肪酸等类成分;12个共有差异化学成分中,除蔗糖、3′,4′,5,7-四甲氧基黄酮外,其余10个化合物均以苍耳子为高。现代研究表明,苍耳植物中酚酸、黄酮、蒽醌、倍半萜内酯和脂肪酸等类成分均具有一定的活性。酚酸类成分具有抗炎、抗菌、抗血栓等作用[31-32];黄酮类成分具有抗炎、抗氧化、抗肿瘤等作用[33-34];蒽醌类成分具有抗菌消炎、抗病毒、调血脂、增加免疫等作用[35];倍半萜内酯类成分具有抗菌、抗病毒、抗疟、抗肿瘤和抗炎等作用[36];脂肪酸具有抗癌、消炎等作用[37]。由于苍耳草与苍耳子中整体化学成分的潜在差异,可能会导致其在体内的吸收、代谢及效用有所不同,最终导
致二者临床用途的一些差异,因而这些差异化学成分可能与苍耳草与苍耳子药性、药效差异的物质基础有关,至于深层次地阐明二者药性、药效差异的物质基础还有待于进一步药效学研究。
本实验建立了基于UPLC-Triple TOF-MS/MS结合多元统计分析技术的苍耳草与苍耳子中化学成分差异的分析方法,找出差异显著的化学成分及其变化规律,从而为揭示苍耳草与苍耳子二者药性、药效差异的物质基础提供依据。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 凌一揆. 苍耳的本草学研究[J]. 成都中医药大学学报 , 1959, 4 (10) :54–61. |
| [3] | 刘玉红, 郝振峰. 苍耳子成分及药理作用研究进展[J]. 山东医药工业 , 2003, 22 (1) :22–23. |
| [4] | 崔秀荣, 马海波, 张旗, 等. 苍耳子的化学成分和临床应用研究进展[J]. 现代药物与临床 , 2012, 27 (6) :614–618. |
| [5] | 韩婷, 秦路平, 郑汉臣, 等. 苍耳及其同属药用植物研究进展[J]. 解放军药学学报 , 2003, 19 (2) :122–125. |
| [6] | 阮贵华, 李攻科. 苍耳子的化学成分及其分离分析研究进展[J]. 中成药 , 2008, 30 (3) :421–426. |
| [7] | 谭道鹏, 吴志瑰, 褚小兰, 等. 苍耳属植物化学成分研究进展[J]. 时珍国医国药 , 2007, 18 (2) :501–502. |
| [8] | 崔秀荣, 马海波, 张旗, 等. 苍耳子的化学成分和临床应用研究进展[J]. 现代药物与临床 , 2012, 27 (6) :614–618. |
| [9] | 李钰馨, 韩燕全, 洪燕, 等. 苍耳子的主要化学成分及药理活性研究进展[J]. 中国药房 , 2015, 26 (4) :4868–4871. |
| [10] | 田静, 夏玉凤, 房克慧. HPLC法同时测定苍耳类药材中8种酚酸类成分的含量[J]. 中药材 , 2013, 36 (10) :1623–1626. |
| [11] | 朵睿, 刘玉红, 王明奎, 等. HPLC同时测定苍耳子中6个化学成分的含量[J]. 药物分析杂志 , 2013, 33 (1) :78–82. |
| [12] | 杨柳, 苏芝军, 许舜军, 等. UPLC法同时测定苍耳子中4种酚酸类成分的含量[J]. 药学学报 , 2010, 45 (12) :1537–1540. |
| [13] | 秦泗涟, 马利华, 王振中, 等. UPLC法同时测定炒苍耳子配方颗粒中5种酚酸类成分[J]. 中成药 , 2012, 34 (7) :1393–1395. |
| [14] | 洪燕, 韩燕全, 夏伦祝, 等. 超高效液相色谱法同时测定不同产地苍耳子9种酚酸类成分的含量[J]. 中国药学杂志 , 2013, 48 (13) :1109–1112. |
| [15] | 刘娟秀, 罗益远, 刘训红, 等. 毛细管电泳同时测定苍耳类药材中7种酚酸类成分的含量[J]. 中国药学杂志 , 2015, 50 (4) :366–370. |
| [16] | 刘娟秀, 罗益远, 刘训红, 等. 衍生化GC-MS同时测定苍耳子中14种脂肪酸的含量[J]. 天然产物研究与开发 , 2016, 28 (1) :76–82. |
| [17] | 王光忠, 安靖, 吴慧, 等. 苍耳子炒制前后毒性部位的高效液相指纹图谱研究[J]. 时珍国医国药 , 2013, 24 (3) :663–665. |
| [18] | 柏璐, 李伟东, 蔡宝昌, 等. 苍耳草水溶性成分指纹图谱LC-MS/MS研究[J]. 南京中医药大学学报 , 2013, 29 (6) :576–578. |
| [19] | 洪燕, 韩燕全, 夏伦祝, 等. 不同产地苍耳子UPLC指纹图谱研究[J]. 中国中药杂志 , 2013, 38 (11) :1766–1771. |
| [20] | 刘树民, 曹敏, 武斌, 等. 基于UPLC-TOF/MS的苍耳子不同部位化学成分研究[J]. 中药材 , 2013, 36 (6) :924–929. |
| [21] | 奇小城, 章弘扬, 梁琼麟, 等. 液质联用技术及其在代谢组学研究中的应用[J]. 中成药 , 2009, 31 (1) :106–112. |
| [22] | 李坤平, 高崇凯, 李卫民. UPLC/ESI-TOF-MS/MS分析蛇床子提取物中香豆素类化合物[J]. 中成药 , 2009, 31 (4) :584–587. |
| [23] | 刘祥东, 罗国安, 王义明. 代谢物组学应用的领域之二——植物代谢物组学[J]. 中成药 , 2006, 28 (10) :1515–1517. |
| [24] | 程智, 王伦, 陈斌, 等. 苍耳子的化学成分[J]. 应用与环境生物学报 , 2011, 17 (3) :350–352. |
| [25] | 陈洁, 王瑞, 师彦平. 苍耳子的化学成分研究[J]. 中草药 , 2013, 44 (13) :1717–1720. |
| [26] | 韩婷. 苍耳子的生物活性成分及品质评价[D]. 上海:第二军医大学, 2006. |
| [27] | 汪洋. 中药苍耳子的毒性物质基础及中毒机制研究[D]. 上海:第二军医大学, 2010. |
| [28] | 张树军, 刘焕, 李军, 等. 蒙古苍耳全草化学成分研究[J]. 中草药 , 2015, 46 (3) :329–333. |
| [29] | 池玉梅, 李瑶, 张瑜, 等. 超高效液相色谱-四级杆串联飞行时间质谱分析黄酮类化合物及小毛茛茎叶的成分[J]. 色谱 , 2013, 31 (9) :838–844. |
| [30] | 李辰辰, 陆小腾驾, 童华荣. HPLC-Q-TOF-MS-MS测定桑椹中多酚类物质[J]. 食品科学 , 2015, 36 (2) :101–104. |
| [31] | 韩婷, 李慧梁, 胡园, 等. 苍耳子中酚酸类化合物及不同品种和居群苍耳子中总酚酸含量的测定[J]. 中国中西医结合学报 , 2006, 4 (2) :194–198. |
| [32] | 宋琳琳, 沙靖全, 赵宏, 等. 苍耳草中总酚酸的含量测定及其抗炎作用研究[J]. 时珍国医国药 , 2013, 24 (10) :2331–2332. |
| [33] | 钟地长, 张淑凤, 陈振锋, 等. 天然产物黄酮类化合物的提取、纯化及其金属配合物的研究进展[J]. 化学世界 , 2006, 47 (9) :56–59. |
| [34] | 王如阳, 刘晓芳, 刘满红, 等. 苍耳子提取液的抗氧化活性研究与总黄酮含量测定[J]. 云南中医中药杂志 , 2008, 29 (9) :42–43. |
| [35] | 曹亮, 周建军. 蒽醌类化合物的研究进展[J]. 西北药学杂志 , 2009, 24 (3) :237–238. |
| [36] | Vasas A, Hohmann J. Xanthane sesquiterpenoids:structure, synthesis and biological activity[J]. Nat Prod Rep , 2011, 28 (4) :824–842. DOI:10.1039/c0np00011f |
| [37] | 赵长琦, 许有玲. 抗肿瘤植物药及其有效成分[M]. 北京: 中国中医药出版社, 1997 . |
 2016, Vol. 47
2016, Vol. 47


