三叶木通Akebia trifoliata (Thunb.) Koidz.为木通科(Lardizabalaceae)木通属Akebia Decne.落叶木质藤本植物。其主要药用部位为干燥藤茎和干燥近成熟果实,分别作为中药材木通和预知子收录于《中国药典》2015年版,具有利尿通淋、清心除烦、通经下乳、疏肝理气、活血止痛的功效[1]。现代药理研究表明其还具有抗肿瘤的作用[2]。张燕君等[3]调查表明,我国野生三叶木通主要分布于华中、黄河流域以及秦岭地区,陕西镇安县三叶木通的蕴藏量最大,然而目前由于人们过度采收以及生境破坏,造成三叶木通野生资源急剧下降。2003年国家科学技术部将三叶木通列为濒危紧缺中药材,作为国家重大科技专项重点资助[4]。
目前常用的DNA标记技术有SSR、SRAP、AFLP等,其中AFLP技术是由Vos等[5]发展起来的一种检测DNA多态性的技术,具有分辨率高、重复性强等优点,已被广泛应用于物种遗传多样性、种群遗传结构、种质资源保护及评价等研究[6-7]。Li等[8]开发出11个有效多态性微卫星位点,对井冈山48份三叶木通种质的遗传变异水平进行了初步评估;张燕祥等[9]优化了SRAP标记技术,对秦岭地区3个三叶木通居群遗传多样性进行了初步探讨,平均多态位点百分率为58.21%;黄佩蓓等[10]利用AFLP标记技术对10份三叶木通种质进行基因组DNA多态性分析,多态性比率达到90.65%,结果表明AFLP标记技术适用于三叶木通遗传多样性研究。
虽然已有个别学者对三叶木通的遗传多样性做过部分研究,但是涉及的地区狭窄,采集的样本数量有限,对于木通蕴藏量位列首位的秦岭地区没有系统利用分子标记进行过遗传多样性的研究。本研究利用课题组前期建立的AFLP体系对陕西秦岭地区三叶木通种质的遗传多样性、居群亲缘关系和遗传变异进行评估,将为保护和合理利用三叶木通野生资源,以及制定育种策略提供一定的理论依据。
1 材料与方法 1.1 材料6个三叶木通天然居群采自陕西秦岭地区(表 1),随机选择株间距大于50 m的样株,采集每株中下部无病虫害的嫩叶10~15片,硅胶干燥,-20 ℃保存。所有种质样本经陕西师范大学生命科学学院肖娅萍教授鉴定为三叶木通Akebia trifoliata (Thunb.) Koidz.。
|
|
表 1 三叶木通采样地信息 Table 1 Information about localities of A. trifoliate samples |
1.2 方法 1.2.1 基因组DNA提取
采用改良CTAB法提取三叶木通叶片DNA[11],用0.8%琼脂糖凝胶电泳和核酸蛋白仪检测提取的DNA质量和浓度。
1.2.2 AFLP扩增AFLP分析利用课题组前期建立的体系和筛选的引物[12],引物E为“GACTGC GTACCAATTC”,引物M为“GATGAGTCCTGAGTAA”。扩增产物经6%聚丙烯酰胺凝胶电泳和硝酸银染色进行检测,拍照保存。
1.2.3 数据统计根据银染结果图统计条带,同一位置上清晰可见的条带记为“1”,缺失记为“0”,忽略条带之间的强弱差异,生成0/1矩阵。用POPGENE 1.32软件计算遗传多样性参数;用NTSYS 2.10软件根据非加权配对算术平均法(UPGMA)进行聚类分析,用GenALEX 6.2软件进行分子方差分析(AMOVA)、主坐标分析(PCoA)和Mantel检验。
2 结果与分析 2.1 AFLP扩增多态性利用10对AFLP引物扩增三叶木通基因组DNA,观察清晰、稳定的条带。其中引物组合E-AAC/M-CTG对111份三叶木通种质的扩增图谱见图 1,如表 2的分析结果所示,共检测出221条条带,其中多态性条带132条,占总条带数的59.7%,平均每对引物扩增出22.1条条带。其中引物E-AGG/M-CAT分辨能力最好,多态性比率为86.4%,引物E-ACA/M-CTA分辨能力较低,多态性比率为36.0%。

|
图 1 引物组合E-AAC/M-CTG对111份三叶木通种质扩增图谱 Fig.1 AFLP amplification patterns of 111 A.trifoliate using primer pairs of E-AAC/M-CTG |
|
|
表 2 10对AFLP引物扩增结果 Table 2 Amplification of AFLP with 10 primer pairs |
2.2 居群遗传多样性分析
根据AFLP扩增结果制成0/1矩阵,利用POPGENE 1.32软件分析三叶木通居群遗传多样性。如表 3所示,将全部样本按群居地分为6个居群,多态性位点百分率范围为23.98%~28.51%,表明陕西秦岭地区三叶木通各居群内遗传多样性不高,具有相似的遗传背景,这与Shannon信息指数和基因多样性指数揭示的三叶木通遗传变异规律是基本相同的。按照Shannon信息指数由高到低排序依次为ZAX居群 > ZAY居群 > FP居群 > TB居群 > SN居群 > NS居群,说明了三叶木通镇安居群的遗传多样性水平较其他居群高。
|
|
表 3 三叶木通居群的遗传多样性参数 Table 3 Genetic variation indexes of populations of A.trifoliate |
2.3 遗传分化和基因流
如表 4所示,6个三叶木通居群总遗传多样性值为0.185,总居群内遗传多样性值为0.092。总遗传分化系数值为0.505,即总遗传变异中50.5%的变异来自于居群间,居群内和居群间对三叶木通遗传变异水平的贡献率基本相同,这与AMOVA结果一致(表 5)。各居群之间的基因流变化范围为0.590~1.736,不同居群之间基因交流存在差异。遗传分化系数变化范围为0.224~0.459。ZAX居群和TB居群之间的遗传分化系数最高,基因流最低,分别为0.459和0.590,说明两者亲缘关系较远。
|
|
表 4 三叶木通各居群间的遗传分化和基因流 Table 4 Analysis on genetic differentiation and gene flow inter-populations for A.trifoliate |
|
|
表 5 三叶木通居群内和居群间分子变异的AMOVA分析结果 Table 5 AMOVA intra-and inter-populations for A.trifoliate |
2.4 聚类分析
三叶木通6个天然居群的遗传距离变化范围在0.060~0.196,基于Nei’s遗传距离,UPGMA聚类结果显示(图 2),在遗传距离0.13处,6个天然居群可聚为4个大类。其中ZAY居群和NS居群聚为1个大类,TB居群和SN居群聚为1个大类,ZAX居群、FP居群各自为1个类群。虽然TB居群与SN居群的遗传距离最近,但其地理距离最远;ZAX居群与ZAY居群的直线地理距离最近,却没有优先聚在一起。为了解居群遗传距离和地理距离之间是否存在相关性而进行Mantel检验,结果显示未达到显著水平(R=0.037,P=0.414),说明陕西秦岭地区三叶木通居群的地理距离和遗传距离之间没有显著相关性。
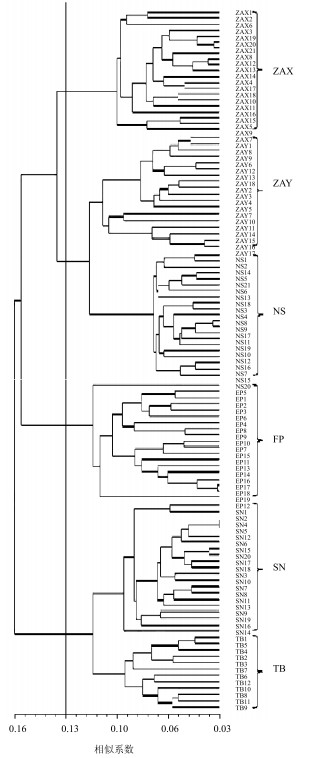
|
图 2 三叶木通的UPGMA聚类图 Fig.2 UPGMA dendrogram of A.trifoliate |
2.5 主坐标分析
对三叶木通的AFLP分子标记扩增结果进行PCoA分析(图 3)。第1、2主坐标把111份三叶木通种质分成4类,占总变异的60.46%。每个居群的个体分布比较集中,这说明居群内个体具有相似的遗传背景。ZAY居群和NS居群,SN居群和TB居群部分交织重叠,说明2个居群亲缘关系较近。PCoA结果揭示了与UPGMA聚类相同的居群遗传结构。
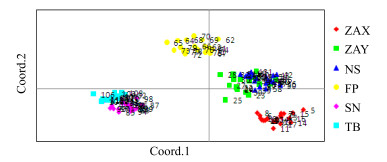
|
图 3 基于相似性矩阵的主坐标分析 Fig.3 PCoA based on similarity index matrices |
3 讨论
研究发现6个三叶木通居群平均多态位点百分率为26.32%,居群内基因多样性为0.092,遗传分化系数为0.505,揭示了陕西秦岭地区三叶木通遗传多样性水平较低,居群内和居群间的遗传变异水平基本相同。UPGMA聚类和PCoA分析结果显示,三叶木通6个天然居群被聚为4大类,其中ZAY居群与NS居群、TB居群与SN居群遗传距离较小,亲缘关系较近。Mantel检测结果发现6个三叶木通居群间亲缘关系的远近与其自然地理分布没有显著关系。李秀华等[13]利用形态学标记对73份三叶木通种质进行研究,结果显示来自ZAX居群的7份种质和ZAY居群的6份种质被划分在4个不同的类群,表明三叶木通种质的遗传差异与其地理分布不存在必然联系,这一结论与本研究结果一致。
影响物种遗传多样性的因素包括生物学特性、基因流、隔离、遗传漂变、环境条件等[14]。Slatkin[15]把基因流作为临界值,认为当居群间的基因流小于1时,遗传漂变是群体间遗传分化的主要原因;如果基因流大于1,基因流可以克服遗传漂变对遗传分化产生的显著影响。本研究结果显示居群间的基因流变化范围为0.590~1.736,其中ZAX居群与ZAY居群、ZAY居群与NS居群、SN居群与TB居群间基因流均大于1,居群间的遗传分化较其他居群小,综合考虑居群间的基因流和遗传分化系数,结果表明有些居群基因流是影响遗传多样性的主要因素,有些居群遗传漂变可能起主要作用。
Slatkin认为基因流对种群遗传多样性的影响主要是通过花粉传播和种子扩散来实现的。李嘉瑞等[16]对三叶木通花器官和开花习性的研究发现,三叶木通花同时具备风媒花和虫媒花的特征。三叶木通完全花序上雄花数多,花粉产量大,干燥,无黏性,表面光滑,易于随风扩散,表现出风媒花的特征;但三叶木通花无香味,雌花色泽艳丽,具蜜腺,性成熟时雌蕊柱头分泌黏性物质,有利于接纳花粉,又反映出虫媒花的特征。三叶木通果实成熟后沿腹缝线开裂,果肉具有甜味,种子数多,种皮内没有发芽抑制物质,且含有天然油脂[17],推测三叶木通种子可以依靠动物进行传播,动物取食成熟果实,种子不能被消化而随粪便排出。通常,风虫媒传粉及种子的长距离传播,可能会提高该地区三叶木通种质资源的遗传多样性[18]。然而三叶木通花粉在自然条件下活力时间短,而且营养生长和生殖生长同时进行,以致三叶木通座果率低,落花落果率很高[16]。由此推测三叶木通居群间有限的基因流动可能是其遗传多样性降低的主要原因,更准确的结论尚有待于进一步深入研究三叶木通的繁育系统、传粉模式和种子传播行为。
近年来随着人类活动范围的扩大和大量的土地开发利用,对三叶木通栖息地的破坏也逾加严重,这些人为破坏导致大量个体消失,可能造成群体基因库发生改变,最终影响了三叶木通的多样性。对一些珍稀濒危物种的遗传多样性研究表明,遗传多样性偏低是导致濒危的重要因素[19-20]。
本实验利用分子标记研究了陕西秦岭地区6个野生居群的三叶木通的遗传多样性,结果表明遗传多样性较低。并从基因流、遗传漂变、环境等方面对产生这一结果的可能原因进行了分析,以期为今后秦岭地区三叶木通的保护提供科学的依据。
| [1] | 中国药典[S].一部. 2015. |
| [2] | Ji D B, Ye J, Jiang Y M, et al. Anti-tumor effect of Liqi, a traditional Chinese medicine prescription, in tumor bearing mice[J]. BMC Complement Altern Med , 2009, 9 (4) :1–9. |
| [3] | 张燕君, 党海山, 杨路路, 等. 药用植物三叶木通(Akebia trifoliata subsp. trifoliata)野生资源的地理分布与调查[J]. 中国野生植物资源 , 2013, 32 (3) :58–62. |
| [4] | 熊大胜, 郭春秋, 谢彬. 三叶木通种子品质性状研究[J]. 中草药 , 2005, 36 (11) :1710–1713. |
| [5] | Vos P, Hogers R, Bleeker M, et al. AFLP: a new technique for DNA fingerprinting[J]. Nucl Acids Res , 1995, 23 (21) :4407–4414. DOI:10.1093/nar/23.21.4407 |
| [6] | Villalobos-Barrantes H M, García E G, Lowe A J, et al. Genetic analysis of the dry forest timber tree Sideroxylon capiri in Costa Rica using AFLP[J]. Plant Syst Evolut , 2015, 301 (1) :15–23. DOI:10.1007/s00606-014-1049-1 |
| [7] | Han Q, Wang G, Li W, et al. Genetic diversity of Potamogeton pectinatus L. in relation to species diversity in a pair of lakes of contrasting trophic levels[J]. Biocheml Syst Ecol , 2014, 57 :60–66. DOI:10.1016/j.bse.2014.07.003 |
| [8] | Li L, Yao X, Chen X, et al. Development and characterization of microsatellite loci in Chinese medicinal plant Akebia trifoliate ssp. australis and cross-species amplification in closely related taxa[J]. Conservat Genet , 2009, 10 (4) :959–962. DOI:10.1007/s10592-008-9666-2 |
| [9] | 张燕祥, 张铮, 董声. 三叶木通SRAP体系的优化及其遗传多样性[J]. 陕西师范大学学报:自然科学版 , 2014, 42 (5) :65–70. |
| [10] | 黄佩蓓, 陈世华, 曹岚, 等. 三叶木通AFLP指纹图谱分析[J]. 时珍国医国药 , 2014, 25 (4) :871–873. |
| [11] | 张铮, 王强. 三叶木通总DNA提取方法的比较[J]. 西北农业学报 , 2005, 14 (3) :141–144. |
| [12] | 王喆, 张铮, 褚会娟, 等. 三叶木通AFLP反应体系的建立及优化[J]. 中草药 , 2010, 41 (12) :2071–2078. |
| [13] | 李秀华, 肖娅萍, 谢娇. 三叶木通种质资源形态多样性研究[J]. 陕西师范大学学报:自然科学版 , 2007, 35 (4) :88–93. |
| [14] | Wróblewska A. Genetic Diversity and Spatial Genetic Structure of Chamaedaphne calyculata (Ericaceae) at the Western Periphery in Relation to its Main Continuous Range in Eurasia[J]. Folia Geobot , 2014, 49 (2) :193–208. DOI:10.1007/s12224-013-9165-1 |
| [15] | Slatkin M. Gene flow and geographic structure of natural populations[J]. Science , 1987, 236 :787–792. DOI:10.1126/science.3576198 |
| [16] | 李嘉瑞, 李金光, 税守岐. 三叶木通(Akebia trifoliate kiodz)的开花生物学研究[J]. 西北农业大学学报 , 1991, 19 (4) :33–37. |
| [17] | 吴永朋.三叶木通生物学特性研究[D].西安:陕西师范大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10718-2010193603.htm |
| [18] | Li T, Liu J, Xie Y, et al. Analysis of genetic diversity in Prunus mira Koehne ex Sargent populations using AFLP markers[J]. Plant Syst Evolut , 2014, 300 (3) :475–482. DOI:10.1007/s00606-013-0896-5 |
| [19] | 李巧明.龙脑香科两种濒危植物的保护遗传学研究[D].昆明:中国科学院昆明植物研究所, 2002. http://cdmd.cnki.com.cn/article/cdmd-80106-2005152771.htm |
| [20] | Zhou T H, Wu K X, Qian Z Q, et al. Genetic diversity of the threatened Chinese endemic plant, Sinowilsonia henryi Hemsi. (Hamamelidaceae), revealed by inter-simple sequence repeat (ISSR) markers[J]. Biochem Syst Ecol , 2014, 56 :171–177. DOI:10.1016/j.bse.2014.05.017 |
 2016, Vol. 47
2016, Vol. 47

