大枣JujubaeFructus为鼠李科(Rhamnaceae)枣属Ziziphus Mill.植物枣Ziziphus jujuba Mill.的干燥成熟果实,在中医临床中应用广泛,具有补中益气、养血安神之功效,常用于脾虚食少、乏力便溏、妇人脏躁等症。同时,大枣也是一种美味可口、营养极其丰富的食品。现代研究显示,大枣中主要含有糖类、三萜类、核苷及碱基类、氨基酸类等化学成分[1]。其中,大枣中含有的三萜类化学成分具有调节免疫、保肝、抑制肿瘤细胞增殖、抗炎、抗菌等生物活性[2-5],为其药用功效发挥的主要物质基础之一。研究显示,存在于大枣中的三萜类化学成分主要以羽扇豆烷型、齐墩果烷型、乌苏烷型为主,且种类较多[2]。本课题组前期分别采用HPLC-UV、HPLC-ELSD技术建立了大枣及枣属药用植物中多种三萜类化学成分的分析评价方法[6-7],但所测定指标的对照品分离制备难度大、分析成本高,作为大枣药材质量控制方法不易推广。截止目前,《中国药典》尚未见收载用于大枣药材分析评价的有效方法,不利于大枣药材及其制剂产品的质量控制。
近年来,基于只测定1个成分而实现对多个目标成分进行同步监控的一测多评法(QAMS)已应用于多种中药材及复方制剂的质量控制[8-15],为中药多组分质量控制方法的建立提供了技术支撑。本研究尝试采用QAMS[16-17],以目前较易得到的白桦脂酸为参照物,通过建立其与齐墩果酸、熊果酸、桦木酮酸、齐墩果酮酸、熊果酮酸的相对校正因子,计算出其他成分的量,并考察方法的耐用性及系统适用性,以探讨QAMS应用于大枣药材多指标质量控制的适用性及可行性。
1 仪器与试药Waters 2695 Alliance高效液相色谱系统(美国Waters公司);Waters 2424 ELSD检测器(美国Waters公司);EmpowerTM色谱工作站软件(Waters公司);Agilent 1100高效液相色谱仪(美国Agilent公司),Alltech2000es ELSD检测器(美国Alltech公司);BT125型电子天平(赛多利斯科学仪器有限公司);EPED超纯水系统(南京易普易达科技发展有限公司);Microfuge 16型台式微量离心机(美国Beckman Coulter公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司)。
对照品白桦脂酸(批号111802-201001)、齐墩果酸(批号110709-201201)、熊果酸(批号110742-200518)购自中国食品药品检定研究院,对照品桦木酮酸、齐墩果酮酸、熊果酮酸均为本实验室从酸枣果肉中分离自制,其化学结构经1H-NMR、13C-NMR及ESI-MS分析确认;纯度经面积归一化法计算,质量分数均大于98%。甲醇为色谱纯,购自德国Merck公司;去离子水为经易普易达超纯水制备系统自制;其他化学试剂均为分析纯,购自上海国药化学试剂公司。
定量测定的15批次大枣样品分别采自山东、河南、河北、山西、陕西、宁夏、新疆等地,经南京中医药大学段金廒教授鉴定为鼠李科植物枣Ziziphus jujuba Mill.的干燥成熟果实。
2 方法与结果 2.1 一测多评方法学考察 2.1.1 色谱条件Hypersil C18色谱柱(250 mm×4.6 mm,5 μm),以甲醇-0.5%乙酸铵(83:17)为流动相,体积流量0.6 mL/min,柱温25 ℃;ELSD漂移管温度80 ℃;氮气体积流量2.7 L/min。在上述色谱条件下,取混合对照品溶液及供试品溶液各20 μL进样,色谱图见图 1。
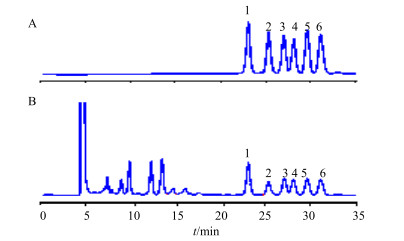
|
1-白桦脂酸2-齐墩果酸3-熊果酸4-桦木酮酸5-齐墩果酮酸6-熊果酮酸 1-betulinic acid 2-oleanolic acid 3-ursolic acid 4-betulonic acid 5-oleanonic acid 6-ursonic acid 图 1 混合对照品(A)和样品(B)的HPLC-ELSD图 Fig.1 HPLC-ELSD chromatograms of reference substances (A) and sample (B) |
2.1.2 混合对照品溶液的制备
取白桦脂酸、齐墩果酸、熊果酸、桦木酮酸、齐墩果酮酸、熊果酮酸对照品适量,精密称定,用甲醇溶解,制成质量浓度分别为224.1、200.2、215.9、187.0、212.8、167.1 μg/mL的混合对照品溶液,于4 ℃冰箱中避光保存,备用。
2.1.3 供试品溶液的制备取大枣药材,去核并切成小块后,50 ℃烘干并粉碎过40目筛。取上述粉末5.0 g,精密称定,置于100 mL具塞锥形瓶中,精密加入100 mL醋酸乙酯,密塞,称定质量,室温超声(40 kHz)提取60 min,再称定质量,加醋酸乙酯补足减失的质量,摇匀,滤过。取续滤液50 mL减压回收溶剂至干,残渣加甲醇转移至10 mL量瓶中,加甲醇至刻度,摇匀,经0.45 μm的微孔滤膜滤过后,取续滤液作为供试品溶液。
2.1.4 标准曲线的制备精密吸取“2.1.2”项混合对照品溶液0.5、1.0、2.0、4.0、6.0、8.0、10.0 mL至10 mL量瓶中,分别加甲醇至刻度,摇匀,经0.45 μm的微孔滤膜滤过后,分别取20 μL续滤液注入液相色谱仪,按上述色谱条件测定。以浓度(C)的对数值对峰面积(A)的对数值进行线性回归处理,得白桦脂酸、齐墩果酸、熊果酸、桦木酮酸、齐墩果酮酸、熊果酮酸的回归方程。结果表明,6种三萜酸成分在相应范围内线性关系良好,见表 1。
|
|
表 1 6种三萜酸类成分的线性关系和范围 Table 1 Linear relationship and ranges of six triterpene acids |
2.1.5 相对校正因子(fsi)计算
以白桦脂酸为内参物,在上述特定的范围内计算fsi:
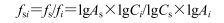
|
As为内参物白桦脂酸峰面积,Cs为白桦脂酸质量浓度,Ai为某待测成分i峰面积;Ci为某待测成分i质量浓度
结合“2.1.4”项下系列质量浓度对照品溶液所得峰面积数据,分别计算白桦脂酸对齐墩果酸、熊果酸、桦木酮酸、齐墩果酮酸、熊果酮酸的fsi,结果见表 2。
|
|
表 2 5种三萜酸的相对校正因子 Table 2 RCF of five triterpene acids |
2.1.6 精密度试验
精密吸取混合对照品溶液20 μL,按上述色谱条件连续进样6次,记录色谱峰的峰面积,结果白桦脂酸、齐墩果酸、熊果酸、桦木酮酸、齐墩果酮酸、熊果酮酸峰面积的RSD分别为1.68%、2.21%、2.58%、2.47%、1.54%、2.02%,结果表明,仪器精密度较好。
2.1.7 稳定性试验取陕西延安产大枣药材供试品溶液1份,分别于制备后0、2、4、8、12、24、48 h进样测定,结果白桦脂酸、齐墩果酸、熊果酸、桦木酮酸、齐墩果酮酸、熊果酮酸峰面积的RSD分别为2.05%、2.44%、2.92%、2.56%、2.01%、1.95%,结果表明供试品溶液稳定性良好。
2.1.8 重复性试验精密称取陕西延安产大枣药材粉末6份,按“2.1.3”项下供试品溶液制备方法制备,并测定质量分数,白桦脂酸、齐墩果酸、熊果酸、桦木酮酸、齐墩果酮酸、熊果酮酸质量分数的RSD值分别为2.31%、2.59%、2.77%、2.51%、2.38%、1.84%,表明本方法重复性良好。
2.1.9 加样回收率试验取已测定的大枣药材粉末约2.5 g,精密称定,平行6份,分别加入相当于药材中各指标成分量的对照品溶液,依“2.1.3”项下方法制备供试品溶液,进样测定,计算加样回收率。结果显示,白桦脂酸、齐墩果酸、熊果酸、桦木酮酸、齐墩果酮酸、熊果酮酸的加样回收率分别为98.25%、97.48%、99.67.31%、97.12%、100.58%、36.71%,RSD值分别为1.89%、2.57%、2.94%、1.83%、2.55%、2.71%。
2.2 QAMS耐用性和系统适应性评价 2.2.1 色谱柱和高效液相色谱仪考察取“2.1.2”项下配制的混合对照品溶液,分别进样1、2、4、6、10、20 μL测定,按“2.1.5”项下方法计算白桦脂酸对齐墩果酸、熊果酸、桦木酮酸、齐墩果酮酸、熊果酮酸的fsi,结果见表 2。
考察了Waters 2695-Waters 2424 ELSD、Agilent 1100-Alltech2000es ELSD 2种高效液相色谱及蒸发光散射检测器系统和Elite Hypersil ODS2(250 mm×4.6 mm,5 μm)、Thermo Hypersil ODS2(250 mm×4.6 mm,5 μm)2种色谱柱对fsi的影响,结果表明不同仪器及不同色谱柱所测得的各成分的相对校正因子无显著性差异,RSD < 2%,见表 3。
|
|
表 3 不同仪器及色谱柱对fsi的影响 Table 3 Effect of different instruments and columns on RCFs |
2.2.2 实验室考察
采用建立的一测多评实验方法在2个实验室经不同实验人员进行复核实验,在Waters 2695-2424 ELSD高效液相色谱仪上,使用Hypersil ODS2(250 mm×4.6 mm,5 μm)色谱柱进行实验,精密吸取混合对照品溶液1、2、4、6、10、20 μL注入液相色谱仪测定,结果表明(表 4),所建立的QAMS法在经2个实验室不同实验人员进行复核所得的fsi相对误差均小于3%,无明显差异。
|
|
表 4 不同实验室对fsi的影响 Table 4 Effect of different laboratories on RCFs |
2.2.3 待测组分色谱峰的定位
通过计算在不同色谱仪器或不同色谱柱中各待测成分色谱峰与白桦脂酸色谱峰的相对保留时间(rsi),对各待测成分进行定位,结果见表 5。结果显示,不同仪器和色谱柱测得的rsi相对误差均小于2%,表明利用rsi进行峰的定位是可行的。
|
|
表 5 不同仪器和色谱柱测得的rsi Table 5 Relative retention time (RRT) obtained by different instruments and columns |
2.2.4 QAMS与外标法测定结果的比较研究
取采自不同产地的大枣药材粉末,按供试品溶液制备方法制备供试品溶液,精密吸取20 μL注入液相色谱仪,按上述色谱条件测定。分别采用外标法和QAMS计算大枣药材中白桦脂酸、齐墩果酸、熊果酸、桦木酮酸、齐墩果酮酸、熊果酮酸的量,结果见表 6。结果显示,QAMS与外标法所计算的各指标成分量的相对误差均小于5%,表明2种测定方法得到的量之间无显著性差异,由此说明QAMS用于大枣药材中多种三萜酸类成分质量评价是可行的。
|
|
表 6 QAMS与外标法测定结果比较 Table 6 Comparison of result in Jujubae Fructus by QAMS and external standard method |
3 讨论
三萜酸类化学成分为大枣中含有的主要活性成分之一,与其功效发挥密切相关。本研究分别选取大枣药材中含量相对较高且具有代表性的羽扇豆烷型(白桦脂酸、桦木酮酸)、齐墩果烷型(齐墩果酸、齐墩果酮酸)和乌苏烷型(熊果酸、熊果酮酸)3类活性成分作为测定指标,可有效控制大枣药材的质量。所测定的6种成分中,以白桦脂酸相对量较高,且各样品中含量差异较小,对照品易得,故以其作为内参物,参照文献方法[14]建立了大枣药材的QAMS法。
本研究采用HPLC-ELSD建立QAMS测定方法时,分别比较了直接以峰面积和进样量计算rsi,以及取峰面积和进样量的对数进行计算的2种rsi计算方法。结果显示,若直接采用以峰面积和进样量的计算方法,所得不同进样量的校正因子RSD值较大,而当采用取峰面积和进样量的对数进行计算时,RSD值均小于3%,且与文献报道一致[15],表明该计算方法可行。
蒸发光散射检测器为通用型检测器,其理论响应值与样品的质量呈正比。因此,对于结构相似且相对分子质量相近的化合物,其响应值比应接近于1。本研究所测定的6种三萜酸类化合物均为五环三萜酸类,且白桦脂酸、齐墩果酸、熊果酸为同分异构体(相对分子质量为456),桦木酮酸、齐墩果酮酸、熊果酮酸为同分异构体(相对分子质量为454),实验研究也显示,白桦脂酸对齐墩果酸、熊果酸、桦木酮酸、齐墩果酮酸、熊果酮酸的fsi均接近于1。因此在制定标准时,在色谱及检测条件固定的情况下可将各成分的fsi均设定为1,以方便计算。
本实验分析过程所涉及的样品所含三萜酸类化学成分的化学结构、理化性质较为近似,在色谱分离过程中存在一定的难度。实验中分别比较了不同流动相系统及色谱柱对其分离效果的影响,结果显示以甲醇-0.5%乙酸铵水溶液系统较为适宜,且低流速、低柱温有利于目标化合物的有效分离。在该系统下,又以Hypersil C18色谱柱较为适宜。在比较不同色谱柱对待测色谱峰定位的影响时,也显示色谱柱型号对各色谱峰的相对保留值影响较大,差异显著。因此,为保证待测色谱峰的准确定位,在制定标准时应对实验所需色谱柱型号和规格进行规定,建议以Hypersil C18色谱柱为宜,并列入该品种的标准中。
本实验首次将QAMS应用于大枣药材的质量评价中,该法所得6种三萜酸含量的计算值与传统外标法所得实测值之间无显著性差异,表明本方法可在对照品缺失的情况下,以白桦脂酸为对照品,实现大枣药材及其制剂产品中多种三萜酸类化学成分的分析评价。
| [1] | 郭盛, 段金廒, 钱大玮, 等. 枣属植物化学成分研究进展[J]. 国际药学研究杂志 , 2013, 40 (6) :702–710. |
| [2] | Guo S, Duan J A, Tang Y P, et al. Triterpenoid acids from Ziziphus jujuba[J]. Chem Nat Comp , 2011, 47 (1) :138–139. DOI:10.1007/s10600-011-9859-7 |
| [3] | Su B N, Cuendet M, Farnsworth N R, et al. Activity-guided fractionation of the seeds of Ziziphus jujuba using a cyclooxygenase-2 inhibitory assy[J]. Planta Med , 2002, 68 (11) :1125–1128. |
| [4] | Lee S M, Park J G, Lee Y H, et al. Anti-complementary activity of triterpenoides from fruits of Zizyphus jujuba[J]. Biol Pharm Bull , 2004, 27 (11) :1883–1886. DOI:10.1248/bpb.27.1883 |
| [5] | Yu L, Jiang B, Luo D, et al. Bioactive components in the fruits of Ziziphus jujuba Mill. against the inflammatory irritant action of Euphorbia plants[J]. Phytomedicine , 2012, 19 (3/4) :239–244. |
| [6] | Guo S, Duan J A, Tang Y P, et al. High-performance liquid chromatography-two wavelength detection of triterpenoid acids from the fruits of Ziziphus jujuba containing various cultivars in different regions and classification using chemometric analysis[J]. J Pharm Biomed Anal , 2009, 49 (5) :1296–1302. DOI:10.1016/j.jpba.2009.03.006 |
| [7] | Guo S, Duan J A, Tang Y P, et al. Characterization of triterpenic acids in fruits of Ziziphus species by HPLC-ELSD-MS[J]. J Agric Food Chem , 2010, 58 (10) :6285–6289. DOI:10.1021/jf101022p |
| [8] | 朱晶晶, 王智民, 匡艳辉, 等. 一测多评法同步测定人参和三七药材中多种人参皂苷的含量[J]. 药学学报 , 2008, 43 (12) :1211–1216. |
| [9] | 卿大双, 罗维早, 孙建彬, 等. 一测多评法测定黄连及其炮制品中6种生物碱[J]. 中草药 , 2016, 47 (2) :324–329. |
| [10] | 匡艳辉, 朱晶晶, 王智民, 等. 一测多评法测定黄连中小檗碱、巴马汀、黄连碱、表小檗碱、药根碱含量[J]. 中国药学杂志 , 2009, 44 (5) :390–394. |
| [11] | 陈建维, 刘圆, 刘晨楠, 等. 一测多评法测定枳实中4种黄酮类成分[J]. 中草药 , 2015, 46 (9) :1374–1377. |
| [12] | 陆林玲, 钱大玮, 郭建明, 等. 一测多评法测定黄蜀葵花中7个黄酮类成分[J]. 药物分析杂志 , 2013, 33 (12) :2082–2087. |
| [13] | Hou J J, Wu W Y, Juan D, et al. Ruggedness and robustness conversion factors in method of simultaneous determination multi-components with single reference standard[J]. J Chromatogr A , 2011, 1218 :5618–5627. DOI:10.1016/j.chroma.2011.06.058 |
| [14] | 陈俊, 许浚, 张静雅, 等. 基于一测多评法对延胡索中生物碱类成分的质量控制研究[J]. 中草药 , 2016, 47 (3) :493–498. |
| [15] | 王俊俊, 张俐, 郭青, 等. 一测多评法测定8个银翘解毒系列制剂中的7种酚酸类成分的含量[J]. 药学学报 , 2015, 50 (4) :480–485. |
| [16] | 王智民, 钱忠直, 张启伟, 等. 一测多评法建立的技术指南[J]. 中国中药杂志 , 2011, 36 (6) :657–658. |
| [17] | 蔡雪萍, 李振华, 华俊磊, 等. 一测多评法测定枇杷叶有效部位中6种三萜酸成分的量[J]. 中草药 , 2013, 44 (21) :3057–3062. |
 2016, Vol. 47
2016, Vol. 47


