刺五加Eleutherococcus senticosus (Ruper.et Maxim.) Maxim.,为五加科(Araliaceae)灌木,分布于我国东北、华北,韩国、日本以及俄罗斯远东地区,其根、茎、叶均可入药,是传统珍贵药用植物。其具有抗疲劳、防止记忆力衰退以及提高机体免疫力等多种生理活性及药理作用,三萜皂苷类化合物为其主要活性成分之一[1]。由于过量开采、野生条件下繁殖能力差等原因,刺五加已被列为渐危物种,致使现有的刺五加资源难于满足市场需求[2]。因此,在阐明刺五加皂苷合成机制的基础上,通过基因表达调控等生物技术手段提高刺五加的皂苷量有望成为解决这一供需矛盾的有效措施。
已有的研究表明,在药用植物体内萜类化合物的生物合成中,甲羟戊酸焦磷酸脱羧酶(mevalonate diphosphate decarboxylase,MDD)催化ATP与甲羟戊酸焦磷酸反应生成C5化合物异戊烯基焦磷酸(isopentenyl pyrophosphate),是萜类化合物生物合成过程中的一个关键酶[3]。MDD的超量表达可加快药用植物体内萜类化合物的合成速率[4],而启动子决定着特定基因表达的时间、空间以及强度等[5]。因此,克隆并分析药用植物次生代谢相关功能基因的启动子,对深入了解药用植物药用成分的合成机理具有重要的意义。但目前尚未见有关刺五加功能基因启动子的相关报道。为此,本研究克隆并分析了刺五加MDD基因启动子的DNA序列,以期为刺五加MDD基因表达调控的研究提供理论依据。
1 材料 1.1 植物材料供试刺五加采自辽宁省桓仁满族自治县,经华北理工大学邢朝斌教授鉴定为五加科植物刺五加Eleutherococcus senticosus (Ruper.et Maxim.) Maxim.,并栽植于华北理工大学花园。于2015年4月釆其叶片,用去离子水冲洗干净,滤纸吸干水分后,作为刺五加基因组DNA的提取材料。
1.2 试剂X-Gal、IPTG、LB培养基、氨苄青霉素购自北京拜尔迪生物技术有限公司。天根生化科技(北京)有限公司提供大肠杆菌TOP-10感受态细胞、新型植物基因组DNA提取试剂盒、pGM-T cloning kit以及琼脂糖凝胶DNA回收试剂盒。Ex Taq DNA聚合酶购自TaKaRa公司。所需引物交由Thermo Fisher公司合成。
2 方法 2.1 基因组DNA的提取称取0.1 g刺五加叶片,参照新型植物基因组DNA提取试剂盒的说明书,提取基因组DNA,并将DNA溶解于30 μL(pH值为7.0)dd H2O中,-80 ℃冻存。
2.2 MDD基因5’端DNA序列的获得根据刺五加MDD基因的cDNA序列(GenBank登录号为JQ905594)[6],设计上、下游引物MDD-25S(5’-ATTCCAACTCTGTCTCTCTCTG-3’)和MDD-470X(5’-ATACCCTTCTTCTCATCCTCAA-3’)。以“2.1”项中提取的刺五加基因组DNA为模板,PCR扩增刺五加MDD基因5’端的DNA序列。总反应体系25.0 μL,其中1 μL模板,2.5 μL 10×Ex Taq Buffer(Mg2+ plus),上、下游引物各1 μL,4 μL dNTP mixture(2.5 mmol/L),0.2 μL Ex Taq DNA聚合酶,ddH2O 15.3 μL。PCR反应程序:94 ℃,2 min;94 ℃,30 s;54 ℃,30 s;72 ℃,5 min;共40个循环。72 ℃补充延伸10 min。用2 %的琼脂糖凝胶电泳PCR产物,并切下目的条带。按琼脂糖凝胶DNA回收试剂盒说明,回收目的条带。回收产物与pGM-T载体连接后,转化至大肠杆菌TOP-10感受态细胞。将验证转化成功的阳性菌种送往Thermo Fisher公司测序。
2.3 MDD基因启动子的克隆根据“2.2”项中获得的刺五加MDD基因5’端的DNA序列,应用Primer premier 5.0软件设计特异性TAIL-PCR的扩增引物MDD-BY2(5’-GCCGTAACCATCACCACCCATT-3’),MDD-BY3(5’-TTCATCCCTCTTTCCCCAGTAC-3’),MDD-BY4(5’-GGACTCACAGCAACAGTAGTAG-3’)以及随机简并引物AD-5[5’-AG(A/T)G(A/C/G/T)AG(A/T)A(A/C/G/T)CA(A/T)AGG-3’]。以“2.1”项中提取的刺五加基因组DNA为模板,经连续3轮TAIL-PCR扩增刺五加MDD基因的启动子序列。TAIL-PCR的反应条件和体系均参照Liu等[7]的方法进行。第1轮PCR扩增使用1 μL刺五加基因组DNA作为模板,所用引物为MDD-BY4、AD-5。第2轮PCR扩增使用1 μL稀释10倍的第1轮PCR产物,所用引物为MDD-BY3、AD-5。第3轮PCR扩增使用1 μL 100倍稀释的第2轮PCR产物,所用引物为MDD-BY2、AD-5。第3轮的PCR产物经2 %的琼脂糖凝胶电泳后,将目的条带纯化、连接、转化。将验证转化成功的菌种送往Thermo Fisher公司测序。
2.4 生物信息学分析将“2.2”项及“2.3”项中的测序结果进行拼接后,使用NCBI网站的Blast软件进行序列比对,确定是否为刺五加MDD基因的5’端DNA序列及启动子序列。
用NNPP软件(http://fruitfly.org:9005/seq-tools/promoter.html)对转录起始位点进行预测,并结合本实验室刺五加MDD基因cDNA 5’端RACE的结果进行分析,最终确定转录起始位点。将扩增所得启动子序列提交到启动子顺式作用元件预测网PLACE(http://www.dna.affrc.go.jp/PL-ACE/)以及PlantCARE软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)上进行分析[8]。从而明确转录起始位点上游所含调控元件类型、数目、位置及功能等信息。
3 结果与分析 3.1 刺五加MDD基因5’端DNA序列以及上游启动子序列的获取根据GenBank中注册的刺五加MDD基因cDNA序列,设计引物MDD-25S、MDD-470X,PCR扩增得到长度约为1 050 bp的条带(图 1),克隆测序得到1 024 bp的序列。使用Blast软件,将所得序列进行比对分析,证实为刺五加MDD基因5’端的DNA序列。
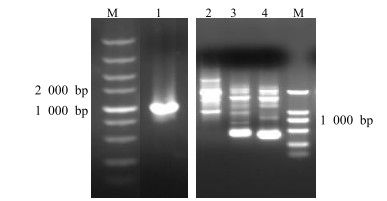
|
M-Marker 1-MDD基因5’端DNA序列2-第1轮PCR 3-第2轮PCR 4-第3轮PCR M-Marker 1-5'DNA sequence of MDD gene 2-The first PCR product 3-The second PCR product 4-The third PCR product 图 1 刺五加MDD基因5’端DNA及启动子序列的克隆 Fig.1 Gene cloning of MDD gene 5'DNA sequence and promoter sequence in E.senticosus |
根据“2.2”项中克隆的刺五加MDD基因5’端DNA序列,使用Primer premier 5.0软件设计引物MDD-BY2、MDD-BY3、MDD-BY4以及随机简并引物AD-5。使用套式PCR扩增得到长度约为1 600 bp的启动子序列(图 1)。纯化、连接、测序得到长度为1 629 bp的片段,该片段包含1 423 bp的启动子序列。
3.2 转录起始位点的预测将启动子序列提交到NNPP软件,预测转录起始位点,以预测值0.3为判断的cut-off值。共找到7种可能的转录起始位点,结合本实验室已克隆的刺五加MDD基因5’端RACE的结果,最终确定其转录起始位点位于起始密码子ATG上游172 bp处。
3.3 启动子序列所含顺式作用元件的名称、数目、位置及功能将转录起始位点上游启动子序列提交到在线软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)上进行分析,结果表明刺五加MDD基因启动子序列除包含TATA-box、CAAT增强子外(图 2),还含有Box 4、G-Box、G-box、GATA-motif、GT1-motif、I-box等多个光响应元件。以及1个脱落酸响应元件ABRE;2个茉莉酸甲酯响应元件CGTCA-motif、TGACG-motif(表 1)。此外,该启动子序列还含有干旱胁迫响应元件MBS,与种子形成有关的RY-element元件,胚乳表达调控元件Skn-1-motif。并且发现了2个MYBHv1结合位点、2个MYB转录因子结合位点(表 1)。

|
图 2 刺五加MDD基因启动子序列以及部分TATA-box、TCCA-box结合位点 Fig.2 Nucleotide sequence of E.senticosus MDD gene promoter and part of TATA-box and TCCA-box binding sites |
|
|
表 1 刺五加MDD基因启动子序列所含顺式作用元件 Table 1 Cis-acting elements in sequences of E.senticosus MDD gene promoter |
4 讨论
本实验首次成功克隆、分析刺五加MDD基因启动子序列。该序列包含GT1-motif、I-box等7种光响应元件,共14个调控位点,说明光照可能是调节刺五加MDD基因表达的重要因素之一。增强光照,是否会导致MDD基因的超量表达,进而增加植株体内萜类化合物的积累量,还有待进一步研究。
Jin等[9]的研究表明,适当浓度的茉莉酸甲酯(MeJA)处理刺五加的植株后,其皂苷类化合物产量有所上升。而本实验研究表明,刺五加MDD基因启动子序列含有CGTCA-motif、TGACG-motif 2种MeJA响应元件。同样,Shi等[10]对灵芝MDD基因的研究也表明,不同浓度的MeJA处理可不同程度地影响灵芝MDD基因的表达,并进而提高其皂苷量,但仅浓度为150 μmol/L MeJA处理时,MDD基因的活性增强,而浓度为100 μmol/L时,MDD基因的活性反而被抑制。有趣的是,灵芝MVD基因启动子序列同样含有2个MeJA响应元件[10]。
本研究还发现,刺五加MDD基因启动子序列中还含有与繁殖有关的响应元件,如胚乳表达必须顺式作用元件SKn-1-motif,与种子形成有关的RY-element元件。但Shi等[10]对灵芝MDD基因启动子的研究却未发现此类顺式作用元件。可能是由于刺五加与灵芝的亲缘关系较远的原因所致。
对不同性别植株刺五加皂苷生物合成关键酶基因表达的研究结果表明,MDD基因的最大表达量出现在雌性植株,且显著高于雄性植株中的表达量[11]。一般认为,高等植物的雌性植株一般对环境胁迫的耐受能力低于雄性植株[12],因此,初步推测刺五加MDD在不同性别植株中的差异表达可能与MDD基因启动子序列中的干旱胁迫等逆境胁迫响应元件有关。
| [1] | 樊如强, 傅宏征, 金学英, 等. 刺五加有效成分提取工艺考察及不同产地刺五加中有效成分量的比较[J]. 中草药 , 2014, 45 (2) :260–264. |
| [2] | 李志芬, 杨扬, 由香玲, 等. 通过体细胞胚发生快繁优良刺五加植株的技术[J]. 东北林业大学学报 , 2012, 40 (10) :19–21. |
| [3] | Abbassi S J, Vishwakarma R K, Patel P, et al. Bacopa monniera recombinant mevalonate diphosphate: Biochemical characterization[J]. Int J Biol Macromol , 2015, 79 :661–668. DOI:10.1016/j.ijbiomac.2015.05.041 |
| [4] | Rossoni L, Hall S J, Eatham G, et al. The putative mevalonate diphosphate decarboxylase from Picrophilus torridus is in reality a mevalonate-3-kinase with high potential for bioproduction of isobutene[J]. Appl Environ Microbiol , 2015, 81 (7) :2625–2634. DOI:10.1128/AEM.04033-14 |
| [5] | Chang W C, Lee T Y, Huang H D, et al. PlantPAN: Plant promoter analysis navigator, for identifying combinatorial cis-regulatory elements with distance constraint in plant gene groups [J]. BMC Genom, 2008, doi:10.1186/1471-2164-9-561. |
| [6] | 邢朝斌, 龙月红, 何闪, 等. 刺五加甲羟戊酸焦磷酸脱羧酶基因的克隆与表达分析[J]. 西北植物学报 , 2012, 32 (10) :1950–1956. |
| [7] | Liu Y G, Chen Y. High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J]. Biotechniques , 2007, 43 (5) :649–650. DOI:10.2144/000112601 |
| [8] | Dehqhan N F, Yarizade K. Bioinformatics study of delta-12 fatty acid desaturase 2 (FAD2) gene in oilseeds[J]. Mol Biol Rep , 2014, 41 (8) :5077–5087. DOI:10.1007/s11033-014-3373-5 |
| [9] | Jin K A, Youngki P, Wi Y L, et al. Increasement of eleutherosides and antioxidant activity in Eleutheroccus senticosus adventitious root by jasmonic acid[J]. J Korean Forset Soc , 2007, 96 (5) :539–542. |
| [10] | Shi L, Qin L, Xu Y, et al. Molecular cloning, characterization, and function analysis of a mevalonate pyrophosphate decarboxylase gene from Ganoderma lucidum[J]. Mol Biol Rep , 2012, 39 (5) :6149–6159. DOI:10.1007/s11033-011-1431-9 |
| [11] | 邢朝斌, 孟春燕, 修乐山, 等. 不同性别刺五加皂苷合成酶基因表达及其对皂苷含量的影响[J]. 经济林研究 , 2013, 31 (3) :81–85. |
| [12] | 胥晓, 杨帆, 尹春英, 等. 雌雄异株植物对环境胁迫响应的性别差异研究进展[J]. 应用生态学报 , 2007, 18 (11) :2626–2631. |
 2016, Vol. 47
2016, Vol. 47


