2. 延边大学药学院, 吉林 延吉 133000 ;
3. 沈阳药科大学, 基于靶点的药物设计与研究教育部重点实验室, 辽宁 沈阳 110016 ;
4. 沈阳药科大学功能食品与葡萄酒学院, 辽宁 沈阳 11016
2. School of Pharmaceutical, Yanbian University, Yanji 133000, China ;
3. Key Laboratory of Structure-based Drug Design and Discovery, Ministry of Education, Shenyang Pharmaceutical University, Shenyang 110016, China ;
4. School of Functional Food and Wine, Shenyang Pharmaceutical University, Shenyang 110016, China
心血管疾病(cardiovascular diseases)已成为全世界第一位致死、致残原因。根据世贸卫生组织(WTO)报道,心血管疾病多发生在不发达国家或发展中国家。日常生活中的不良习惯,如吸烟、不健康饮食、肥胖、缺乏运动及过度饮酒,都可能导致心血管疾病的发生。高血压、糖尿病、高脂血症等疾病患者会比正常人面临更大的患病风险。心血管疾病具有发病率高、致残率高、死亡率高、复发率高、并发症多的特点。其发病形式多样,包括外周血管病变、冠状动脉疾病、心脏衰竭、血脂异常和高血压等,给人类社会带来了极大的痛苦和死亡的威胁。近年来,国内外许多专家学者都在致力于发现预防和治疗心血管疾病的有效方法,而寻找高效低毒的防治心血管疾病的天然药物是科学工作者研究的热点课题之一。
人参Panax ginseng C. A. Meyer是一种传统的中药,药用历史超过2 000年,具有大补元气、回阳救逆的功效,是最有价值的天然药物之一。人参的临床应用广泛,能用于预防疾病、促进机体康复、益智健脑、增强体力、抗疲劳等方面,还有适应原样作用,可维持机体稳态[1-2],近年来,许多研究表明人参还具有抗癌、治疗糖尿病和改善心血管功能等作用[3-5]。
人参皂苷(ginsenoside,以下简写为G)对多种心血管疾病都有着显著的治疗作用,包括抗氧化作用、改善血流动力学、调节血管功能、抗血栓形成、保护心肌缺血再灌注等。根据6位碳上是否有羟基,把人参皂苷分为原人参二醇型类(PDS)和原人参三醇型类(PTS),PDS包括G-Rb1、G-Rb2、G-Rb3、G-Rc、G-Rd、G-Rg3、G-Rh2等,PTS包括G-Re、G-Rf、G-Rg1、G-Rg2、G-Rh1等。由于人参总皂苷中包含许多单体成分,而且各个成分的结构不同[6],作用也不尽相同[7]。为了更好地开发和利用人参中具有心血管活性的皂苷类成分,本文对近10年报道的有关人参单体皂苷的在心血管方面的药理作用、作用机制及构效关系进行综述。
1 抑制心肌细胞肥大研究发现G-Rb1和G-Rg1均能有效抑制乳鼠心肌细胞肥大[8],通过降低钙调神经磷酸酶(CaN)的mRNA和蛋白的表达和钙离子浓度[9-10],提高心肌细胞内抗心肌细胞肥大作用的一氧化氮(NO)的浓度[11],从而发挥心血管保护作用。Sabri等[12]通过探讨G-Rb1对心肌肥大信号传递的重要通路之一的蛋白激酶C(PKC)系统的影响,发现其能使心肌肥大乳鼠的PKC活性下降,PKC重要的下游信号c-fos和c-jun的表达也显著降低,但是与单一的PKC抑制剂的效果相比,G-Rb1抑制心肌肥大的效果更强[13]。研究发现,G-Rb3体外作用于血管紧张素处理过的大鼠血管平滑肌细胞,c-fos和c-jun的mRNA表达水平显著下降,提示G-Rb3可能有抑制心肌细胞肥大的作用[14]。
2 保护心肌缺血再灌注多种人参皂苷都能抑制缺血再灌注心肌的氧化损伤,大量实验表明,人参作用于再灌注心肌,能刺激内皮型一氧化氮合酶(eNOS),增加NO的产生,使机体免受活性氧(ROS)的损伤,乳酸脱氢酶(LDH)减少,超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)的量显著增加,而反映心肌氧化损伤程度的丙二醇(MDA)的量则有所下降[15]。关于人参皂苷的抗氧化作用与结构的关系,已有研究证明,无论是PDS或PTS,在C-20位上连接单个葡萄糖的皂苷,具有抗氧化活性,如G-Rg1、G-Rb1、G-Re、G-Rd和三七皂苷R1;C-20位上没有糖,则会表现出促氧化反应的作用,如G-Rg3、G-Rg2和G-Rh2;然而,在C-20位上没有糖,却在C-6位上连有1个葡萄糖的皂苷,依旧表现出抗氧化活性,如G-Rh1[16-17]。G-Rc的抗氧化能力大于G-Rb1,而G-Re则是三醇组中抗氧化能力最强的[18-19]。G-Re对内源性和外源性的氧化剂均有很好的抑制作用[20],能增加心肌细胞存活率,改善缺血再灌注心肌的收缩能力,减少中性粒细胞(PMNs)数,降低髓过氧化物酶活性,减少自由基产生,还能抑制缺血再灌注心肌细胞凋亡[21]。G-Rg1保护缺血心肌除了抗氧化损伤外,主要还通过维持心电图稳态,抑制心肌缺血时T波、ST段、ST/R值的变化;保护缺血心肌细胞的线粒体,作为细胞内的能量来源的线粒体不仅能为缺血心肌提供能量,还能抗氧化损伤;G-Rg1还有可能通过抑制炎症信号通路核转录因子-κB(NF-κB)通路,抑制炎症因子水平,保护缺血心肌[22-25]。
G-Rb1对缺血再灌注心肌的保护作用主要是通过3个方面(图 1):一是通过保护血管内皮细胞,促进血管再生。研究表明,通过建立H2O2体外诱导人脐静脉内皮细胞损伤模型,发现在H2O2损伤前加入G-Rb1,能保护线粒体,防止H2O2引起的内皮细胞结晶形成量的减少[26];通过进一步的研究发现,G-Rb1不仅能抑制内皮细胞的凋亡,而且还能促进正常内皮细胞增殖,通过双重机制保护血管内皮细胞[27]。二是减少Ca2+浓度,G-Rb1可以减弱钙离子通道基因的表达,抑制L型钙电流,减少细胞内Ca2+浓度,稳定细胞膜[28-29]。三是清除自由基,防止心肌细胞过氧化损伤[30-31]。对体外人脐静脉内皮细胞有积极的影响[32],能抑制ROS,通过刺激糖皮质激素受体(GR)、PI3K/Akt和eNOS通路,增加NO的产生[33]。最新研究表明,25-OH-PPT能通过激活PI3k/Akt通路发挥对缺血再灌注心肌的保护作用,与G-Rb1相似,其能清除自由基,防止氧化损伤,还能调节凋亡因子,抑制心肌细胞凋亡,保护H2O2诱导的心肌细胞损伤[34]。G-Rb3能激活PI3K/Akt信号通路,抗氧化损伤,还能抗炎、抗心肌细胞凋亡,对缺血再灌注心肌也有很强的保护作用[35-36]。G-Rg2能抑制缺血再灌注大鼠心肌细胞凋亡,减小心肌坏死面积[37-38]。
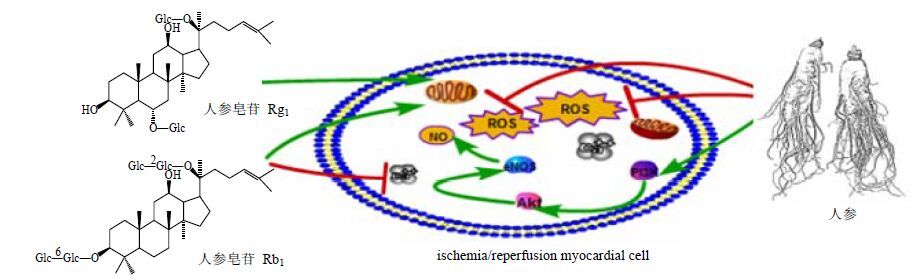
|
图 1 人参皂苷保护缺血再灌注心肌的主要作用机制 Fig.1 Main mechanisms of ginsenoside for protecting ischemia-reperfusion myocardium |
3 治疗心肌梗死
金岩等[39-41]通过实验研究表明,人参皂苷具有治疗心肌梗死的作用,人参皂苷治疗心肌梗死的主要方式是通过调节血管功能,促进血管再生。G-Rgl和G-Re具有显著的血管生成素样作用,将G-Rg1作用于心肌梗死大鼠,结果发现,G-Rg1可以促进组织再生[42],动员骨髓中的内皮干细胞以及其他多种干细胞归巢到心肌梗死灶及边缘区,防止梗死面积扩大,提高干细胞DNA、RNA和脂质水平,并促使干细胞分化成内皮细胞,促进血管再生[43];增加缺氧诱导因子-1α(HIF-1α)、血管内皮生长因子(VEGF)和血管内皮生长因子受体(Flk-1)的表达,刺激血管持续再生,免受心肌缺血的损伤,从而促进缺血心脏的恢复。研究发现,VEGF是HIF-1α主要的下游基因,但是当VEGF浓度降低时HIF-1α却仍在增加,梗死区的微血管密度也继续增加,说明HIF-1α除了产生VEGF,也会诱导其他的治疗心肌梗死因子的生成,但机制尚不明确。G-Rh2可以升高大鼠血清VEGF水平,提高内皮祖细胞数量,促进血管再生,起到内皮修复及保护受损心肌的作用[44]。
G-Rb1也能治疗急性心肌梗死(AMI)大鼠。由于心室重构是心肌梗死的主要病理基础,而肾素-血管紧张素(RAS)系统的激活,能导致左心室重构,造成心室损伤[45-46]。G-Rb1治疗心肌梗死的原因之一是其能抑制RAS系统,此外,G-Rb1还能改善血流动力学,升高左室内压(LVSP)和±dp/dtmax,降低左室舒张期末压(LVEDP),增强心肌收缩和舒张能力[47]。G-Rg2能提高LVSP和+dp/dtmax,增加心肌收缩力,改善心脏泵血功能增加心输出量,降低LVEDP和-dp/dtmax,提高舒张压,改善血流动力学状况,改善心肌的血液供应[48-50]。G-Rb3是三七茎叶的主要成分,能很好地抑制心室重构,实验表明,G-Rb3减少血清中MDA、血浆内皮素(ET)和血管紧张素II(Ang II)量,抑制RAS系统,改善左心的舒张和收缩功能,防止心肌梗死后的心室重构,还能降低肌酸激酶同工酶MB(CK-MB)及乳酸脱氢酶(LDH)活性,增加SOD、GSH-Px活性,起到抗氧化作用[51]。通过设计大鼠急性心肌梗塞实验,结果显示,三七中的G-Fc能有效的减少大鼠心肌梗塞的面积,还具有一定的抗心肌缺血的功效[52]。
4 抗心肌细胞凋亡心肌细胞的凋亡贯穿整个心血管疾病的发展过程,对心肌缺血和心肌梗死都有一定的影响,凋亡的过程受许多因子的共同作用,其中最主要的就是Bcl-2/Bax值[53],Bcl-2/Bax值越高则心肌细胞凋亡率降低,大量药理学实验研究发现,G-Rg1、G-Re、G-Rb1对心肌细胞的凋亡有抑制作用,人参皂苷抑制心肌细胞凋亡也与相关基因的调控有关[54]。三者作用心肌细胞后,Bcl-2的水平与对照组没有显著性差异[55],但Bax、Bad、Fas等细胞凋亡促进基因的表达明显降低,因此Bcl-2/Bax、Bcl-2/Bad、Bcl-2/Fas值升高,心肌细胞凋亡率下降。G-Rb1还能增加凋亡抑制蛋白survivin水平[56-57]。
许浩等[58]研究发现G-Rb1对H2O2诱导的新生大鼠心肌细胞凋亡有保护作用。氧自由基的增多和Ca2+内流都是诱导细胞凋亡的主要机制,线粒体对细胞凋亡也有重要的作用。G-Rb1可能通过降低细胞内MDA量,增加SOD活性,对抗H2O2的过氧化作用。此外,G-Rb1还可以对抗H2O2引起的Ca2+增多,从而发挥其抗细胞凋亡活性。G-Rb1可以使线粒体膜电位升高,保护线粒体的结构与功能,增加细胞活性。研究发现G-Rb1上调p-ERK1/2的表达水平,从而激活能调控细胞凋亡的细胞外信号调节激酶(EPK)通路,也可能是其抑制心肌细胞凋亡的机制之一[59]。
5 抗心律失常陈彩霞等[60]研究G-Re对异丙肾上腺素致心律失常家兔的影响,结果证实,G-Re能使异丙肾上腺素所致的家兔室性心律失常转为窦性心律,且G-Re的剂量越大,维持窦性节律的时间越长。该研究认为G-Re可能是通过多个靶点共同作用,首先,G-Re是钙离子拮抗剂,Ca2+内流增多会引发心律失常;其次是对KATP通道的开放调节作用;此外还有清除氧自由基,增加NO产生以及膜稳定剂等作用,而且各个机制之间相互促进、相互关联,共同作用。研究发现,G-Re能抑制异丙肾上腺素诱导的高儿茶酚胺模型大鼠L型钙离子电流[61-63]。除了对钙、钾离子通道有影响外,G-Re对钠通道电流也有抑制作用,抑制程度与G-Re浓度呈正相关[64]。G-Rb1、G-Rb3、G-Rd也可能通过对血管平滑肌的钙离子通道的调节,起到抗心律失常的作用,G-Rg1对钙通道没有抑制作用[65-67]。
6 结语与展望随着生活水平的提高,心血管疾病的发病率也逐渐增高,寻找治疗心血管疾病的有效药物是科研工作者刻不容缓的任务。人参作为一种名贵的中草药,临床应用十分广泛,药理作用显著,毒副作用较少。近10年来许多专家学者对人参皂苷的心血管作用进行了大量而深入的研究和探讨。结果表明,人参皂苷在治疗心血管疾病方面有着显著的生物活性,对心血管的多个方面起到重要保护作用。通过对国内外文献的查阅和总结后发现:(1)近10年对G-Rb1的研究报道最多,对其治疗心血管的作用机制较为明确,但研究都是采用离体细胞或动物模型,其对人体的作用尚不明确。所以,对于G-Rb1是否可以作为单体药物用于心血管疾病的防治,值得深究。(2)国内外对于人参皂苷在调节血脂方面的研究较少,但是含有人参皂苷的三七和红参,都有治疗高胆固醇血症的作用,而具体有效成分和作用机制不明,仍需探讨。(3)目前关于人参皂苷治疗心血管的单体中,G-Rb1、G-Rg1的研究最为深入,其他人参皂苷如G-Re、G-Rg3、G-Rd、G-Rb3等,也表现出类似的活性,但有待于进一步研究和探索,为临床应用提供更多理论和数据支持。
| [1] | 郭优勤, 魏桂林, 钟秋明, 等. 浅谈人参的临床应用[J]. 中国现代药物应用 , 2011, 5 (7) :128–129. |
| [2] | 王琼, 王逸, 韩春勇, 等. 人参皂苷Rg1、Rb1及其代谢产物益智作用的研究进展[J]. 中草药 , 2014, 45 (13) :1960–1965. |
| [3] | Zhang L H, Jia Y L, Lin X X, et al. AD-1, a novel ginsenoside derivative, shows anti-lung cancer activity via activation of p38 MAPK pathway and generation of reactive oxygen species[J]. Biochim Biophys Acta , 2013, 1830 (8) :4148–4159. DOI:10.1016/j.bbagen.2013.04.008 |
| [4] | Yang N, Zhang S N, Yang S L, et al. The inhibition of α-glycosidase and protein tyrosine phosphatase 1B (PTP1B) activities by ginsenosides from Panax ginseng C. A. Meyer and simultaneous determination by HPLC-ELSD[J]. J Funct Foods , 2016, 23 :188–197. DOI:10.1016/j.jff.2015.12.018 |
| [5] | 赵琛, 苏光悦, 赵余庆. 人参皂苷及其衍生物抗结肠癌作用及机制的研究进展[J]. 中草药 , 2015, 46 (16) :2477–2483. |
| [6] | 杨秀伟. 人参中三萜类化学成分的研究[J]. 中国现代中药 , 2016, 18 (1) :7–15. |
| [7] | 杨秀伟, 富力. 人参中三萜类化学成分的生物学活性和药理学作用[J]. 中国现代中药 , 2016, 18 (1) :36–55. |
| [8] | 王英婷, 黄燮南, 王风安. 人参皂苷Rg1抑制PGF2α诱导心肌细胞肥大[J]. 中国药理学通报 , 2008, 24 (5) :611–615. |
| [9] | Fiedler B, Wollert K C. Interference of antihypertrophic molecules and signaling pathways with the Ca2+-calcineurin-NFAT cascade in cardiac myocytes[J]. Cardiovasec Res , 2004, 63 (3) :450–457. DOI:10.1016/j.cardiores.2004.04.002 |
| [10] | Jiang Q S, Huang X N, Dai Z K, et a1. Inhibitory effect of ginsenoside Rb1 on cardiac hypertrophy induced by monocrotaline in rat[J]. J Ethnopharmacol , 2007, 111 (3) :567–572. DOI:10.1016/j.jep.2007.01.006 |
| [11] | 孔宏亮, 李占全, 袁龙, 等. 一氧化氮合酶/一氧化氮介导人参皂苷Rb1对心肌细胞肥大的抑制效应[J]. 广东医学 , 2012, 33 (2) :167–169. |
| [12] | Sabri A, Steinberg S F. Protein kinase C isoform-selective signals that lead to cardiac hypertrophy and the progression of heart failure[J]. Mol Cell Biochem , 2003, 251 (1/2) :97–101. DOI:10.1023/A:1025490017780 |
| [13] | 孔宏亮, 黄带发, 王聿杰, 等. 人参皂甙Rb1通过PKC途径抑制ET-1诱发的乳鼠心肌肥大[J]. 心血管康复医学杂志 , 2015, 24 (1) :10–15. |
| [14] | Wang T, Yu X F, Qu S C, et al. Ginsenoside Rb3 inhibits angiotensin Ⅱ-induced vascular smooth muscle cells proliferation[J]. Basic Clin Pharmacol Toxicol , 2010, 107 (2) :685–689. DOI:10.1111/pto.2010.107.issue-2 |
| [15] | Venardos K M, Perkins A, Headrick J, et al. Myocardial ischemia-reperfusion injury, antioxidant enzyme systems, and selenium:a review[J]. Curr Med Chem , 2007, 14 (14) :1539–1549. DOI:10.2174/092986707780831078 |
| [16] | 李智, 于晓风, 曲绍春, 等. 西洋参叶20S-原人参三醇组皂苷对大鼠心肌缺血再灌注损伤的保护作用[J]. 吉林大学学报:医学版 , 2009, 35 (1) :51–54. |
| [17] | 曲绍春, 睢诚, 于晓风, 等. 人参Rb组皂苷对大鼠实验性心肌缺血再灌注损伤的保护作用[J]. 吉林大学学报:医学版 , 2007, 33 (5) :849–852. |
| [18] | Liu Z Q, Luo X Y, Liu G Z, et al. In vitro study of the relationship between the structure of ginsenoside and its antioxidative or prooxidative activity in free radical induced hemolysis of human erythrocytes[J]. J Agric Food Chem , 2003, 51 (9) :2555–2558. DOI:10.1021/jf026228i |
| [19] | Li G X, Liu Z Q. The protective effects of ginsenosides on human erythrocytes against hemin-induced hemolysis[J]. Food Chem Toxicol , 2008, 46 (3) :886–892. DOI:10.1016/j.fct.2007.10.020 |
| [20] | Xie J T, Shao Z H T, Chang WT, et al. Antioxidant effects of ginsenoside Re in cardiomyocytes[J]. Eur J Pharmacol , 2006, 532 (3) :201–207. DOI:10.1016/j.ejphar.2006.01.001 |
| [21] | 郑振中, 刘正湘, 刘晓春, 等. 人参皂苷Re抑制心肌缺血再灌注损伤中性粒细胞浸润和髓过氧化物酶活性的研究[J]. 临床心血管病杂志 , 2004, 20 (12) :736–738. |
| [22] | 来方远, 潘永明, 艾秀峰, 等. 人参皂苷Rg1对豚鼠急性心肌缺血的保护作用[J]. 中药新药与临床药理 , 2011, 22 (4) :390–393. |
| [23] | 包金风, 张晓文, 卢新政, 等. 参三七皂甙Rb1、Rg1预适应对肥厚心肌细胞缺氧复氧损伤细胞凋亡的影响[J]. 甘肃医药 , 2010, 29 (2) :121–124. |
| [24] | 张庆勇, 陈燕萍, 刘芬, 等. 人参皂苷Rg1对大鼠急性心肌缺血抗氧化损伤指标及超微结构的影响[J]. 中国循环杂志 , 2015, 30 (2) :164–167. |
| [25] | 贺欣, 张英杰. 人参皂苷Rg1通过NF-κB通路减轻大鼠心肌缺血再灌注损伤[J]. 中药药理与临床 , 2015, 31 (4) :16–19. |
| [26] | 何胜虎, 张晶. 过氧化氢体外诱导人血管内皮细胞损伤与人参皂苷Rb1的保护效应[J]. 中国组织工程研究与临床康复 , 2008, 12 (2) :254–257. |
| [27] | 刘咏芳, 刘少文, 刘正湘. 人参皂甙Rb1对大鼠心肌缺血再灌注后血管再生的影响[J]. 中国组织化学与细胞化学杂志 , 2008, 17 (1) :39–44. |
| [28] | 张文杰, 李丽, 赵春燕, 等. 人参皂苷单体Rb1对缺血心室肌细胞动作电位及L-型钙离子通道的影响[J]. 吉林大学学报:医学版 , 2007, 33 (6) :978–981. |
| [29] | 裴娟慧, 张银辉, 陈敬洲, 等. 人参皂苷Rb1对大鼠心室肌细胞L型钙电流和瞬时外向钾电流的调控作用[J]. 中国分子心脏学杂志 , 2011, 11 (4) :230–234. |
| [30] | 陈红霞. 人参皂苷Rb1对大鼠实验性心肌缺血再灌注损伤的保护作用[J]. 湖北科技学院学报:医学版 , 2012, 26 (6) :465–467. |
| [31] | Kong H L, Li Z Q, Zhao Y J, et al. Ginsenoside Rb1 protects cardiomyocytes against CoCl2-induced apoptosis in neonatal rats by inhibiting mitochondria permeability transition pore opening[J]. Acta Pharmacol Sin , 2010, 31 (6) :687–695. DOI:10.1038/aps.2010.52 |
| [32] | He F, Guo R S, Sun M, et al. Protective effects of ginsenoside Rb1 on human umbilical vein endothelial cells in vitro[J]. J Cardiovasc Pharmacol , 2007, 50 (3) :314–320. DOI:10.1097/FJC.0b013e3180cab12e |
| [33] | Leung K W, Cheng Y K, Mak N K, et al. Signaling pathway of ginsenoside-Rg1 leading to nitric oxide production in endothelial cells[J]. Febs Lett , 2006, 580 (13) :3211–3216. DOI:10.1016/j.febslet.2006.04.080 |
| [34] | 王智昊. 25-羟基-原人参三醇对大鼠实验性心肌缺血/再灌注损伤的保护作用及机制的研究[D]. 长春:吉林大学, 2015. |
| [35] | 刘晓敏. 人参皂苷Rb3及Rb2组合物对大鼠心肌缺血再灌注损伤的保护作用及机制研究[D]. 长春:吉林大学, 2015. |
| [36] | 孙伟伦, 李凤, 刘一鸣, 等. 人参皂苷Rb3对实验性心肌缺血的保护作用[J]. 人参研究 , 2012, 24 (3) :2–4. |
| [37] | 田建明, 郑淑秋, 郭伟芳, 等. 人参皂苷Rg2对大鼠心肌缺血再灌注损伤诱发心肌细胞凋亡的保护作用[J]. 中国药理学通报 , 2004, 20 (4) :480–480. |
| [38] | 田建明, 李浩, 叶金梅, 等. 人参皂苷Rg2对大鼠化学性心肌缺血的影响[J]. 中国中药杂志 , 2003, 28 (12) :1191–1192. |
| [39] | 金岩, 刘闺男, 朱鲜阳. 人参皂苷Rg1对急性心肌梗死后VEGF和HIF-1α的作用[J]. 解放军医学杂志 , 2006, 31 (11) :1079–1081. |
| [40] | Leung K W, Pon Y L, Wong R N, et al. Ginsenoside-Rg1 induces vascular endothelial growth factor expression through the glucocorticoid receptor-related phosphatidylinositol 3-kinase/Akt and beta-catenin/T-cell factor-dependent pathway in human endothelial cells[J]. J Biol Chem , 2006, 281 (47) :36280–36288. DOI:10.1074/jbc.M606698200 |
| [41] | 杨敏, 陈广玲, 陈畅, 等. 人参皂苷Rg1对心肌梗死大鼠心脏的促血管生成作用研究[J]. 中国中医急症 , 2009, 18 (3) :403–405. |
| [42] | Liang H C, Chen C Y, Chang Y C, et al. Loading of a novel angiogenic agent, ginsenoside Rg1 in an acellular biological tissue for tissue regeneration[J]. Tissue Eng , 2005, 11 (5/6) :835–846. |
| [43] | 金岩, 刘闺男. 人参皂苷Rg1对急性心肌梗死大鼠血管新生的作用[J]. 中国医科大学学报 , 2007, 36 (5) :517–519. |
| [44] | 周芹, 王晞, 王龙. 人参皂苷Rh2对高脂膳食大鼠心肌缺血再灌注时内皮祖细胞的影响[J]. 实用药物与临床 , 2016, 19 (1) :1–6. |
| [45] | Anavekar N S, Solomon S D. Angiotensin Ⅱ receptor blockade and ventricular remodelling[J]. J Renin Angiotensin Aldosterone Syst , 2005, 6 (1) :43–48. DOI:10.3317/jraas.2005.006 |
| [46] | 王薇娜, 赵良平, 王丽, 等. 人参皂苷Rb1对大鼠急性心肌梗死后左室重构的影响[J]. 中国微循环 , 2006, 10 (4) :256–258. |
| [47] | 李朋, 刘正湘. 人参皂苷Rb1对急性心肌梗死大鼠心室重构的影响[J]. 实用心脑肺血管病杂志 , 2006, 14 (2) :118–121. |
| [48] | 孙文娟, 刘洁, 曲少春, 等. 人参皂甙Rg2对兔戊巴比妥钠心力衰竭的影响[J]. 中国现代应用药学杂志 , 2004, 21 (6) :447–450. |
| [49] | 孙文娟, 刘洁, 曲少春, 等. 人参皂甙Rg2对犬戊巴比妥钠心力衰竭的影响[J]. 中国药理学通报 , 2003, 19 (6) :671–674. |
| [50] | 吕文伟, 刘洁, 赵丽娟, 等. 人参皂苷Rg2对麻醉犬急性心源性休克血流动力学和氧代谢的影响[J]. 吉林大学学报:医学版 , 2004, 30 (4) :534–537. |
| [51] | 石耀辉. 人参皂苷Rb3对大鼠心肌缺血再灌注损伤的保护作用及其对大鼠心肌梗死不同阶段基质金属酶的影响[D]. 长春:吉林大学药学院, 2012. |
| [52] | 王峥涛, 高波, 杨莉, 等. 三七皂苷Fc的医药用途:中国, CN 103536610A[P]. 2014-01-29. |
| [53] | Pasupathy S, Homer-Vanniasinkam S. Ischaemic preconditioning protects against ischaemia/reperfusion injury:emerging concepts[J]. Eur J Endovasc Surg , 2005, 29 (2) :106–115. DOI:10.1016/j.ejvs.2004.11.005 |
| [54] | 曾和松, 刘正湘, 刘晓春. 人参皂甙Rb1与Re抗大鼠实验性缺血再灌注心肌细胞凋亡及相关基因蛋白表达[J]. 中华物理医学与康复杂志 , 2003, 25 (7) :402–405. |
| [55] | Shroff E H, Colleen S, Chandel N S. Role of Bcl-2 family members in anoxia induced cell death[J]. Cell Cycle , 2007, 6 (7) :807–809. DOI:10.4161/cc.6.7.4044 |
| [56] | 吴红金, 刘宇娜. 人参皂甙Rg1抑制-(60)Co照射诱导心肌细胞凋亡[J]. 医学综述 , 2008, 14 (21) :3332–3334. |
| [57] | 吴红金, 刘宇娜. 人参皂甙Re对60Co照射诱导心肌细胞凋亡的保护作用[J]. 中西医结合心脑血管病杂志 , 2008, 6 (8) :923–924. |
| [58] | 许浩, 葛亚坤, 邓同乐, 等. 人参皂苷Rb1对H2O2诱导新生大鼠心肌细胞凋亡的保护作用[J]. 中国药理学通报 , 2005, 21 (7) :803–806. |
| [59] | 杨翠, 任建勋, 吴红金, 等. 人参皂苷Rb1经ERK1/2对H2O2诱导的乳鼠心肌细胞损伤的保护作用[J]. 中西医结合心脑血管病杂志 , 2014, 12 (2) :207–209. |
| [60] | 陈彩霞, 张宏艳. 人参皂甙Re对异丙肾上腺素致家兔室性心律失常的保护作用[J]. 中国当代儿科杂志 , 2009, 11 (5) :384–388. |
| [61] | Namit G, Yoram R, Livia H. Contributions of ion channel currents to ven-tricular action potential changes and induction of early afterdepolarizations during acute hypoxia[J]. Circ Res , 2009, 105 (12) :1196–1203. DOI:10.1161/CIRCRESAHA.109.202267 |
| [62] | 李亭亭, 张宏艳. 人参皂甙Re对高儿茶酚胺大鼠心肌损伤的保护作用[J]. 实用儿科临床杂志 , 2010, 25 (19) :1511–1513. |
| [63] | Bai C X, Sumami A, Namiki T, et al. Electrophysiological effects of ginseng and ginsenoside Re in guinea pig ventricular myocytes[J]. Eur J Pharmacol , 2003, 476 (1/2) :35–44. |
| [64] | 孟红旭, 姚明江, 刘建勋, 等. 人参皂苷Re对大鼠心室肌细胞钠、钾离子通道的影响[J]. 世界中医药 , 2013, 8 (10) :1147–1149. |
| [65] | Guan Y Y, Zhou J G, Zhang Z, et al. Ginsenoside-Rd from Panax notoginseng blocks Ca2+ influx through receptor-and store-operated Ca2+ channels in vascular smooth muscle cells[J]. Eur J Pharmacol , 2006, 548 (1/3) :129–136. |
| [66] | 董唏, 赵世萍, 刘岩, 等. 人参皂苷Rb1和Re对乌头碱所致心肌细胞损伤的保护作用[J]. 中国中医药信息杂志 , 2007, 17 (9) :33–35. |
| [67] | Kang Y J, Sohn J T, Chang K C. Relaxation of canine corporal smooth muscle relaxation by ginsenoside saponin Rg3 is independent from eNOS activation[J]. Life Sci , 2005, 77 (1) :74–84. DOI:10.1016/j.lfs.2004.12.016 |
 2016, Vol. 47
2016, Vol. 47


