2. 新疆医科大学附属中医医院 药学部, 新疆 乌鲁木齐 830000
2. Traditional Chinese Medicine Hospital Affiliated to Xinjiang Medical University, Urumqi 830000, China
乌头属Aconitum L.植物是毛茛科(Ranunculaceae)中的一类重要植物,全世界有300余种,广泛分布于北半球温带地区,主要分布于亚洲,我国记录的有200多种[1],其中76种可供药用[2]。我国西南横断山区南部(西藏东部、四川西部和云南西北部)是乌头属植物的重要分布区域。乌头属植物是一类重要的中药药源植物,其中川乌、附子、草乌等为常用中药品种。乌头属药用植物大多以根入药,多具有祛风除湿、温经止痛之功效,其中生物碱是主要有效成分,具有抗炎、镇痛、镇静、解热、免疫抑制、抗肿瘤及强心、降血压、扩张血管等作用,具有较高的药理活性和药用价值[3]。其主要的活性成分,同时也是毒性成分,为双酯型二萜类生物碱,毒性很大,通过水解生成单酯型二萜类生物碱,可以有效地降低其毒性。研究水解产物和水解规律,可以很好地为乌头碱的检测提供保障。
中药炮制是我国中医药所特有的一种制药技术,中药经过炮制之后可以改变其性味、归经,升降浮沉以及毒性强弱,大多数乌头属药材必须经过炮制才能入药。中药炮制工艺直接关系到中药的质量和临床疗效,只有更好地阐述和了解中药的炮制机制,才能更好地对中药饮片的生产质量控制进行指导,才能建立起更规范和更标准的炮制工艺流程。长期以来,中药的炮制作用机制一直得不到系统的研究和阐述,在工艺上缺少硬指标作为指导,一直都是以传统经验作为规范,这种以自主感官和经验作为质控的标准难以确保中药饮片的质量稳定。
近年来,中药炮制研究取得了很大进展,但由于中药成分的复杂性,要完全揭示中药炮制机制,制定科学的炮制工艺和明确中药炮制的发展方向,还需要用现代科学方法进行研究和探索[4]。随着大量学者对中药炮制的临床合理运用和规范化进行深入的研究,为炮制研究的方法和思路指出了一条新的路线[5]。付智慧等[6]采用高效液相色谱(HPLC)法测定炮制前后骆驼蓬中骆驼蓬碱量的变化,发现骆驼蓬经红酒煮制后,骆驼蓬碱的量可显著降低。江迎春等[7]以蜜制金樱子总皂苷、总酚酸量为评价指标,采用Box-Behnken响应面设计对加蜜量、烘制温度、烘制时间、闷润时间等参数进行优化,筛选出最优炮制工艺参数,并且最终筛选出的参数对蜜制金樱子的炮制工艺提供了参考依据。张慧星[4]以地黄为例,指出了炮制前后地黄的药性和用途都有很大的差异,说明在炮制过程中,地黄的化学成分发生了重大的转变。
现代中药炮制研究的主要内容包括中药炮制理论、工艺、规格标准、历史沿革及其发展方向。在中药现代化发展中遇到较多的问题。阐明有毒中药炮制机制是规范炮制工艺、提高饮片质量标准、减少临床不良反应的核心和难点问题,也是有毒中药饮片能否从经验范畴走向科学化和现代化的关键。曹玉[8]将马钱子不同的炮制方法进行整理分析,得出其共同点在于显著降低毒性大且药效低的马钱子碱的量,并且降低部分士的宁的量,通过在炮制过程中利用不同的原理将士的宁和马钱子碱进行开环和断裂反应,形成异马钱子碱和异士的宁,异马钱子碱及异士的宁的毒性分别是炮制前的1/5和1/10,在降低马钱子碱的毒性基础上达到保障疗效的目的。目前还有大量中药炮制的机制未能阐明,还需要进一步深入去挖掘探索。
1 中药模拟炮制研究现状中药模拟炮制是指将中药中的主要药效、毒性成分或组分,模拟药材的炮制条件进行炮制,研究炮制前后的成分变化,结合药理毒理实验研究,为阐明饮片炮制机制提供依据。
中药炮制机制研究是中药炮制研究的基础,只有明确炮制机制,才能有效指导炮制工艺的改进和饮片质量标准的制定,进而保证临床用药的安全和有效。中药发挥作用的药效成分复杂,在炮制过程中发生成分的水解、分解、结合等反应,而且非主要药效毒性成分也会与药效毒性成分之间发生反应或者影响其反应的过程,通过单体成分或成分群在模拟饮片的炮制条件下炮制,可以将复杂问题简单化,研究简单环境下的反应规律后,逐步扩展到饮片的整体炮制,明确炮制过程中成分变化规律,为明晰饮片炮制机制提供依据。
目前国内已经有文献报道中药的模拟炮制研究,主要分为2个方面:成分模拟炮制研究和组分模拟炮制研究。进行成分模拟炮制研究的中药材主要有淫羊藿[9]、党参[10]、白术[11]以及莱菔子[12]等。而组分模拟炮制研究是以“空白饮片”为载体,组分填充,再模拟进行炮制,如大黄[13]等。
川乌、草乌和附子为毛茛科乌头属药用植物,均有很强的毒性,临床均需要炮制后使用,其毒性成分主要是乌头碱等生物碱类成分,在炮制过程中,这些生物碱类成分发生水解反应,毒性大大降低,而其镇痛和抗炎等活性有一定的增强,从而达到炮制减毒增效的目的[14]。目前,已有大量文献对乌头碱类成分进行模拟炮制研究,并探索其水解机制。陆浩伟等[15]模拟川乌炮制方法,以乌头碱、新乌头碱、次乌头碱为例,在水中加热处理后,分别建立其水解产物的量计算及定量方法,为阐明乌头类双酯型生物碱水解转化规律,优化含乌头碱类生物碱的中药材炮制方法及定量测定方法、安全用药提供实验依据。
谭鹏[16]模拟炮制了乌头碱及次乌头碱在水和甲醇中分别加热不同时间的变化情况以及乌头碱和中乌头碱在稀乙醇(先加1 mL无水乙醇使之溶解,再加入19 mL水)中分别加热不同时间的变化情况,并用HPLC法进行检测,结果发现乌头碱在水和稀乙醇中加热后迅速分解,产生了新的色谱峰,而在甲醇中加热后30 min样品开始分解,产生了新的色谱峰,而次乌头碱在水中加热后分解较慢,峰面积逐渐减少,也产生了新的色谱峰,在甲醇中加热后10 min样品开始分解,30 min样品出现明显新的特征产物;中乌头碱在稀乙醇中加热后分解速度较快,但峰面积逐渐增加,产生了新的色谱峰;然后采用液质联用方法对其产物进行了研究,结果表明乌头碱在有水和加热的条件下,易水解为乌头次碱,乌头次碱再分解为乌头原碱。乌头碱在稀乙醇中通过加热可发生水解、醇解、分解等多种反应,生成乌头次碱、乌头原碱2种水解产物和8-乙氧基-14-苯甲酰基乌头原碱和8-乙酰基-14-乙氧基乌头原碱2种醇解产物,以及焦乌头碱1种分解产物。乌头碱在甲醇中加热后产生新的成分,但需要一定的反应时间,在加热300 min后依然不能够反应完全,说明反应过程中存在反应平衡。对比乌头碱在水和稀乙醇中的模拟炮制结果,可见在甲醇中乌头碱的变化速率明显减慢,水是乌头碱水解的重要条件。次乌头碱在有水和加热的条件下,易水解为次乌头次碱,次乌头次碱再水解为次乌头原碱,同时可热分解为焦乌头碱。
刘帅等[17]采用高效液相色谱(HPLC)法测定诃子制草乌在人工胃肠液中孵育不同时间后其降解产物乌头碱、苯甲酰乌头原碱和苯甲酸的量,从体外模拟炮制层面上分析了诃子制草乌炮制减毒原理、进一步优化饮片炮制工艺,为制定饮片质量标准提供科学依据,保证临床用药安全有效。
通过模拟炮制研究成分的变化规律,结合饮片炮制的成分变化规律,可以更好地阐释中药炮制的机制,是中药炮制机制研究的有效途径之一。
2 乌头属药用植物的生物碱类成分从化学成分上看,乌头属植物中主要的化学成分是生物碱,研究最多的是二萜生物碱。其结构复杂,生理活性明显,迄今报道的天然二萜生物碱近千个。二萜生物碱是一类结构复杂的生物碱化合物,通常认为其源于四环二萜或五环二萜的氨基化而形成含β-氨基乙醇、甲胺或乙胺氮原子的杂环体系。二萜生物碱根据其骨架碳原子数目及其结构上的差异,可以分为4大类:C20-二萜生物碱、C19-二萜生物碱、C18-二萜生物碱和双二萜生物碱[18]。
C18-二萜生物碱中绝大部分存在于乌头属植物中,主要是高乌宁碱型(lappaconine type)和冉乌宁碱型(ranaconine type)[19](图 1)。根据C-7上含氧基团的有无以及骨架的差异,C19-二萜生物碱大致分为以下6类(图 2):乌头碱型(aconitine type)、牛扁碱型(lycoctonines type)、7, 17-次裂型(7, 17-secotype)、内酯型(lactone-type)、热裂解型(pyro-type)以及重排型(rearranged-type)[20]。C20-二萜生物碱是指碳骨架为20个碳原子组成的四环二萜,并具有跨A环的、连接C-19与C-20的氮乙基或氮-β-羟乙基的生物碱,与C18和C19-二萜生物碱类相比,绝大多数都具有环外双键结构,共分为7类(图 3):阿替生型(afisine type)、光翠雀碱型(denudafine type)、海替定型(hetidine type)、海替生型(hetisine type)、维特钦型(veatchine type)、纳哌啉型(napelline type)、阿诺特啉型(anopterine type)[21]。双二萜生物碱可认为由2分子C20-二萜生物碱或1分子C19-二萜生物碱和1分子C20-二萜生物碱缩合而成[22]。其主要存在于翠雀属植物中,但目前也有不少报道从乌头属植物中分离得到了双二萜生物碱[23]。
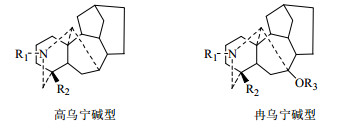
|
图 1 C18-二萜生物碱的母核结构 Fig.1 Nuclear structure of C18-diterpenoid alkaloids |
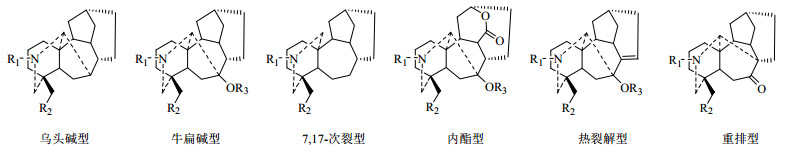
|
图 2 C19-二萜生物碱的母核结构 Fig.2 Nuclear structures of C19-diterpenoid alkaloids |
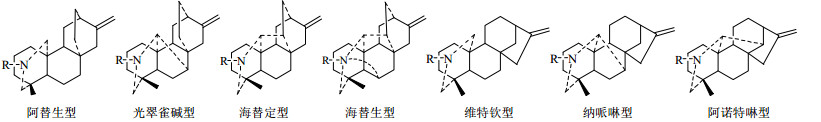
|
图 3 C20-二萜生物碱的母核结构 Fig.3 Nuclear structure of C20-diterpenoid alkaloids |
乌头总生物碱包括双酯型生物碱、单酯型生物碱、氨醇型生物碱和其他类生物碱,这几种生物碱的毒性差异极大, 单酯型生物碱为双酯型生物碱的1/5~1/10,氨醇型生物碱为双酯型生物碱的1/2 000~1/4 000,同样含量的总生物碱,若这几种生物碱的比例不同,总生物碱的毒性也不相同。因此,乌头的毒性应以双酯型生物碱量为指标。张国红等[24]认为,在控制乌头的毒性时,也应考虑单酯型生物碱的毒性,以双酯型生物碱量加1/5的单酯型生物碱量作为控制乌头毒性的指标似乎更为准确。
乌头中双酯型生物碱有麻辣味,亲脂性强,毒性大,它们是乌头的主要毒性成分,也是起杀虫作用的主要成分。双酯型生物碱的测定主要有反相高效液相色谱法、双波长薄层扫描法和高效毛细管电泳法3种方法,其中双波长薄层扫描法操作简便、快速,不需要特殊仪器,而反相高效液相法和高效毛细管电泳法则以用样品量少、快速、适合微量分析见长[24]。总生物碱的测定方法主要有中和法、酸性染料显色分光光度法和色谱法等,其中酸性染料显色分光光度法最为简便、实用,且所用仪器分光光度计为常备仪器,因此,此法在测定乌头总生物碱的量中被广泛应用;色谱法中的高效液相色谱法是一种较新的分析、分离技术,具有高效、高灵敏度、高速、定量准确、应用范围广等特点,是分离分析乌头类中药及其制剂的一种有效手段[25]。
3 水解机制研究乌头碱型生物碱中双酯型乌头碱毒性最强,苯甲酰单酯型乌头碱毒性较小,乌头原碱类毒性很弱或几乎无毒性。脂碱型乌头碱毒性比双酯型乌头碱小,但还有相当的毒性。双酯型乌头碱的水解过程是通过加水、加热处理,使极毒的双酯型乌头碱C-8位上的乙酸基水解(或分解),失去1分子醋酸,得到相应的苯甲酰单酯型生物碱,其毒性为双酯型乌头碱的1/50~1/100;再进一步将C-14位上的苯甲酰基水解(或分解),失去1分子苯甲酸,得到亲水性氨基醇类乌头原碱,其毒性仅为双酯型乌头碱的1/2 000~1/4 000[26]。另一个过程可能是由于在炮制过程中脂肪酰基取代了C8-OH上的乙酰基,生成脂碱,从而降低了毒性。《中药化学》中的论述是乌头碱在100 ℃时水解生成乌头次碱,再在160~170 ℃生成原碱。
张毅等[27]采用HPLC法测定乌头碱在不同pH值的缓冲溶液和不同温度下的水解动力学参数,研究水溶液中乌头碱的水解动力学特征。随着pH值的增加,乌头碱水解速率明显加快;同一缓冲液里,随着温度升高,乌头碱水解速率加快;乌头碱的表观活化能随溶液中缓冲液pH值升高而降低。说明乌头碱在碱性条件下不稳定,其水解属于一级水解反应,水解速率与溶液pH值及温度有关。
王勇等[28]利用电喷雾质谱分析研究四逆汤中乌头类生物碱的溶出平衡和水解平衡规律。比较了制附子、四逆汤、四逆汤药渣和含有3种双酯型生物碱的混台对照品体系中的乌头碱类二萜生物碱。结果在煎煮过程中双酯型生物碱溶解并发生水解反应,而脂类生物碱则难溶于水。乌头碱、中乌头碱、次乌头碱水溶性相近,但是次乌头碱在水中的热稳定性更高,C19二萜骨架上C-3取代基(-OH或-H)的变化影响生物碱的稳定性。
李文东[29]考察5种条件下的乌头碱水解情况,即乌头碱水溶液加酸与不加酸,乌头碱甲醇溶液加酸与不加酸90 ℃水浴3 h及乌头碱溶液(先用少量甲醇溶解,然后加水定容)37 ℃水浴1.5 h。结果显示乌头碱水溶液不加酸的条件下,水解很完全,几乎检测不到原药峰,主要水解产物为乌头胺;在加酸的条件下,抑制其水解,只水解产生了少量的C-8位酯键水解产物。乌头碱甲醇溶液不加酸的条件下,反应完全后,乌头碱和以上2种水解产物都存在并且达到一种水解平衡的状态,3种物质的量很接近;在加酸的条件下,乌头碱主要水解为C-8位酯键的水解产物,仅产生少量的乌头胺。在模拟温孵条件的水解条件下及乌头碱甲醇溶液室温放置1周条件下,没有观测到乌头碱的主要水解产物,而是其次要水解产物,可见其主要水解产物的生成要求的条件较剧烈,而在较温和的条件下,次要水解产物较易生成。
王瑞等[30]建立体外血浆温孵法测定乌头碱、中乌头碱和次乌头碱水解规律的方法。将不同浓度的3种生物碱混合对照品溶液加入到空白兔血浆,通过对温孵不同时间血浆样品的预处理(沉淀蛋白、除杂)、分离和检测等过程实现复杂生物样品中待测成分的分离分析。结果乌头碱、中乌头碱和次乌头碱的浓度在血浆中均随温孵时间的延长逐渐降低,水解速率依次是中乌头碱>乌头碱>次乌头碱。与附子饮片在炮制过程中3种双酯型生物碱的水解规律一致。王勇等[31]对草乌花及其煎煮液中的二萜生物碱进行定性分析,研究煎煮前后化学成分发生的变化。在生草乌花中发现新生物碱,草乌花煎煮后其中的双酯型生物碱和三酯型生物碱都发生水解,前者水解为苯甲酰乌头原碱和乌头原碱类生物碱,后者水解为乙酰乌头原碱类生物碱,为乌头属植物煎煮液中生物碱的分析提供了新途径。
近年来的一些研究成果也进一步证明了上述反应过程。有研究将乌头碱单体置纯水中,密封加热8、12、16、20、24 h,结果主要水解成分为苯甲酰乌头原碱和乌头原碱,水解20 h,苯甲酰乌头原碱的转化率最高[32]。图雅等[33]对草乌的炮制原理进行了研究,结果草乌炮制品中双酯生物碱类成分的相对峰度降低,脂类生物碱的相对峰度明显增加。王勇等[34]研究发现在草乌花煎煮过程中,双酯型和三酯型乌头生物碱除发生水解反应外,还发生C-8位乙酰基被各种长链脂肪酰基取代的酯交换反应生成双酯型和三酯型脂类生物碱。图雅等[35]报道草乌叶加热煎煮过程中三酯型生物碱水解产物为3-乙酰乌头原碱类生物碱。
但是,也有相关文献指出乌头碱型生物碱水解可能还存在其他反应途径,陈学国等[36]研究发现,乌头碱在100 ℃水解时,在生成乌头次碱和乌头原碱的同时,还生成准分子离子为482和586的未知化合物。乌头碱在模拟炮制的过程中可能与鞣质反应生成络合物,导致游离乌头碱的量减少[37-38]。酸性条件可抑制乌头碱水解[39-40],因此模拟炮制品中少量的游离乌头碱在人工胃液中缓慢水解,导致乌头碱的量进一步降低,同时水解产物苯甲酰乌头原碱和苯甲酸的量有所增加。碱性条件可以促进鞣质与乌头碱生成的络合物解离,因此乌头碱的量在人工肠液中急剧回升,5 h达最高;随着反应发生肠液的pH降低(水解产物呈酸性),游离乌头碱水解受到抑制,因此人工肠液孵育6~8 h时乌头碱的量相对稳定。苯甲酸在人工胃肠液中量的变化呈先递增再递减的趋势。由于苯甲酸与氨基醇型生物碱均为苯甲酰乌头原碱的水解产物,二者物质的量之比为1:1,所以氨基醇型生物碱的量变化趋势与苯甲酸一致;在人工胃液中量较低,肠液中先升高再降低,最后维持稳定。诃子制草乌炮制减毒的原理与药典法制草乌不同,并不是通过促进双酯型生物碱水解达到减毒目的。蒙医“诃子可解草乌毒”的原因可能是诃子中的鞣质与草乌中生物碱成分在炮制过程中生成难溶性络合物,使得游离乌头碱的量降低,难溶性络合物在小肠液中缓慢解离并发生水解,使得草乌中双酯型生物碱、单酯型生物碱、氨基醇型生物碱在较高浓度下维持动态平衡。这一方面避免了生物碱的量突然升高导致中毒,另一方面可保证持续发挥药效。
目前乌头属药用植物生物碱水解作用机制研究主要集中于乌头碱,而中药是多成分、多靶点的综合作用,且炮制过程中乌头碱也会水解产生新成分,通过研究其他乌头碱型生物碱的毒性和药理,将为深入阐释减毒存效的炮制机制提供更多依据。李志勇等[41]采用Bliss法和序贯法对不同炮制时间附子饮片进行了安全性评价,将乌头碱、中乌头碱、次乌头碱量的变化与饮片进行关联性分析,结果表明乌头碱干扰了附子回阳救逆功效的显现(负相关),次乌头碱与附子的毒性和回阳救逆功效均呈正相关,中乌头碱、次乌头碱在饮片中的适当配比是保证附子回阳救逆及安全性的关键。可见,深入研究此类中药中的不同成分及其不同水解产物的比例与药效毒性的相关性,才能真正阐明减毒存效的炮制机制。
4 液质联用法用于乌头属药用植物生物碱的测定液质联用(HPLC-MS)技术以液相色谱作为分离系统,质谱为检测系统。液质联用体现了色谱和质谱优势的互补,将色谱对复杂样品的高分离能力,与MS的高选择性、高灵敏度及能够提供相对分子质量与结构信息的优点结合起来,在药物分析、食品分析和环境分析等领域得到了广泛的应用。目前此方法应用于乌头属植物来测定其水解产物的研究已有不少,大部分集中于草乌、川乌等中药。雪上一支蒿与草乌、川乌、附子同属乌头属植物,为民间常用中药,其中乌头生物碱的研究已有报道[42]。王勇等[43]利用电喷雾串联质谱对雪上一支蒿的乙醇提取液进行了直接分析,方法简便、直观、用样量少。可以给出相对分子质量信息,从复杂体系中获得结构信息。从雪上一支蒿中发现了乌头碱、去氧乌头碱及其水解产物和脂类生物碱等共19种二萜生物碱类,其中脂类生物碱为首次在该植物中发现。
二萜生物碱是一类化学结构复杂、生理活性较强的天然产物,主要存在于毛茛科乌头属、翠雀属和飞燕草属植物中[44],对该类天然产物的分离和表征一直是一个活跃的领域[45]。传统的色谱分离和波谱表征手段虽然可以得到化合物完全的结构信息,但用样量较大、实验周期较长,在中药的传统用药形式水煎液有效成分的分析中应用也较少。色谱法、质谱法和液质联用技术可克服传统方法的不足,被广泛用于药用植物成分分析和和药物代谢研究[46-47]。
中乌头碱与次乌头碱为C-19二萜类双酯型生物碱,是乌头属药用植物的主要毒性成分和有效成分,并且此二者在乌头中的量较高,毒性较强[48]。关于中乌头碱在水中的化学反应产物的报道集中在中乌头次碱和中乌头原碱[49]。刘永刚等[50]用高效液相色谱-电喷雾-质谱/质谱(HPLC-ESI-MSn)方法研究中乌头碱在水中发生的化学反应,结果在水解液中发现了5种水解产物,其准分子离子[M+H]+分别为590、486、514、618、572;通过对水解产物的准分子离子和碎片离子的初步分析,可以推测其水解产物为中乌头次碱、中乌头原碱和3个初步确定结构的化合物,并推测在水中可以发生脱乙酰基反应同时发生脱水反应。
郗瑞云等[51]采用HPLC-ESI-MSn方法研究次乌头碱在水中发生的化学反应,液相用梯度洗脱,质谱用正离子模式。结果在水解液中发现了4种水解产物,其准分子离子[M+H]+分别为574、470、498、556。通过对水解产物的准分子离子和碎片离子的分析,鉴定其水解产物为次乌头次碱、次乌头原碱、N-去甲基乙酰基次乌头原碱和焦次乌头次碱,并推测在水中发生脱乙酰基反应、脱乙酰基同时脱苯甲酰基反应、脱苯甲酰基同时脱N上的甲基反应、脱乙酰基同时脱水反应。王勇等[52]利用电喷雾串联质谱对吉林省白山市地产草乌的乙醇提取液进行了直接分析,方法简便、直观、用样量少。ESI-MS可以给出相对分子质量信息,MS2方法则可以从复杂体系中获得结构信息,从该植物中发现中乌头碱、次乌头碱、乌头碱及中乌头碱的水解产物和脂类生物碱等9种二萜生物碱。
王俊伟等[53]利用LC-MS仪的单离子扫描方式进行定量,不仅保证了数据不受杂质或其他乌头生物碱的干扰,克服了液相色谱定量的缺点,还可提高检测灵敏度。李萌等[54]建立LC-MS/MS测定乌头属药用植物中8种生物碱的测定方法。以甲醇-水(水相含0.1%甲酸和2.5 mmol/L醋酸铵溶液)为流动相,C18柱分离,采用ESI+源,MRM监测,对制川乌、制草乌、制附子药材饮片中的双酯型生物碱(乌头碱、新乌头碱、次乌头碱)、单酯型生物碱(苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱)、胺醇型生物碱(乌头原碱、新乌头原碱)进行定量测定。
谭鹏[16]采用液质联用检测了双酯型生物碱在水、稀乙醇、甲醇等不同溶剂中的反应产物,分析了不同产物的结构和变化规律,找到了多种与乙醇、甲醇反应生成的新特征产物,对比了附子炮制前后的成分变化,证实炮制产生了多种成分,采用量子化学计算的方法进一步确定了模拟炮制产物的结构,计算了乌头碱的2步水解反应历程,为深入阐明乌头属药用植物的炮制机制提供了依据,可指导乌头类有毒中药的炮制工艺优化和质量标准提高。并将实验和理论计算2种方法相结合并相互验证,成分模拟炮制与饮片炮制相结合进行验证,为中药炮制机制研究提供了思路和方法。
5 结语乌头属药用植物的炮制机制研究应首先进行乌头碱型生物碱的模拟炮制,分析单体成分的水解变化规律,结合药理毒理实验,明确成分及其水解产物的相互作用,为药用植物的炮制机制研究打下良好的基础。其次应对药效部位进行模拟炮制研究,探讨乌头碱型生物碱在共同炮制条件下的相互作用,以及脂肪酸、多糖等其他成分的影响,结合药理毒理实验,更加明确炮制机制。并结合整体动物的药理毒理研究,综合分析最终阐明减毒存效的炮制机制。
乌头属中药减毒存效的炮制机制复杂,需要化学、分析、药理、毒理等多个方面研究的密切配合,且附子、川乌、草乌的功效不尽相同,具体品种的炮制机制可能存在差异,应充分利用新方法、新技术,借鉴其他学科的研究方法,以深入阐释乌头属药用植物减毒存效的炮制机制,才能进一步提高此类中药饮片的质量,保证临床的安全和有效。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1979 . |
| [2] | 傅国立. 中国高等植物[M]. 青岛: 青岛出版社, 2005 . |
| [3] | 艾嫦, 朱妍妍, 赵长琦. 乌头属植物化学成分、药理作用及其内生菌的研究进展[J]. 天然产物研究与开发 , 2012, 24 (2) :248–259. |
| [4] | 张慧星. 中药炮制研究的思路与方法——以地黄的炮制研究为例[J]. 世界最新医学信息文摘 , 2015, 15 (37) :116. |
| [5] | 陈斌, 许慧琳, 贾晓斌. 三七炮制的研究进展与研究思路[J]. 中草药 , 2013, 44 (4) :482–487. |
| [6] | 付智慧, 陆锦锐, 李淑军, 等. 骆驼蓬炮制前后骆驼蓬碱含量变化研究[J]. 中国药业 , 2015, 16 (16) :52–53. |
| [7] | 江迎春, 邓翀, 李景丽. Box-Behnken响应面法优选蜜制金樱子炮制工艺[J]. 中南药学 , 2015, 13 (9) :938–942. |
| [8] | 曹玉. 马钱子炮制及毒性分析[J]. 中国继续医学教育 , 2015, 7 (25) :189–191. |
| [9] | 金晓勇, 贾晓斌, 孙娥, 等. 炙淫羊藿炮制过程中5种黄酮类成分变化规律研究[J]. 中国中药杂志 , 2009, 34 (21) :2738–2742. |
| [10] | 李伟, 文红梅, 崔小兵, 等. 白术的炮制机理及其倍半萜成分转化的研究[J]. 中国中药杂志 , 2006, 31 (19) :1600–1603. |
| [11] | 周玥, 雷海民, 李飞, 等. 党参炮制原理探讨[J]. 世界中医药 , 2009, 4 (3) :161–163. |
| [12] | 吕文海, 任涛, 苏永汶, 等. 炮制抑制莱菔子中萝卜苷酶解转化的初步研究[J]. 中国中药杂志 , 2011, 36 (8) :980–983. |
| [13] | 李丽, 张村, 肖永庆, 等. 大黄饮片模拟炮制研究[J]. 中华中医药杂志 , 2011, 26 (8) :1777–1780. |
| [14] | Singhuher J, Zhu M, Prinz S, et al. Aconitum in traditional chinese medicine:a valuable drug or an unpredictable risk?[J]. J Ethnopharmacol , 2009, 126 (1) :18–30. DOI:10.1016/j.jep.2009.07.031 |
| [15] | 陆浩伟, 郑琴, 郝伟伟, 等.乌头类双酯型生物碱水解转化规律研究[A]//2010年全国中药学术研讨会论文集[C].武汉:中国中西医结合学会, 2010. |
| [16] | 谭鹏.乌头碱型生物碱的模拟炮制研究[D].北京.北京中医药大学, 2012. http://cdmd.cnki.com.cn/article/cdmd-10026-1012348800.htm |
| [17] | 刘帅, 刘晓艳, 林森, 等. 诃子制草乌模拟炮制品在人工胃液与肠液中的水解行为研究[J]. 中国药房 , 2015, 26 (13) :1752–1754. |
| [18] | Hao D C, Gu X J, Xiao P G, et al. Recent advances in the chemical and biological studies of Aconitum pharmaceutical resources[J]. J Chin Pharm Sci , 2013, 22 (3) :209–221. |
| [19] | Sherstha B B, Dallacqua S, Gewali M B, et al. New flavonoid glycosides from Aconitum naviculare (Brilh1) Stapf, a medicinal herb from thetrans-Himalayan region of Nepal[J]. CarbohydrRes , 2006, 341 (12) :2161–2165. |
| [20] | Wang F P, Chen Q H, Liu X Y. Diterpenoid alkaloids[J]. Nat Prod Rep , 2010, 27 (4) :529–570. DOI:10.1039/b916679c |
| [21] | Wang F P, Liang X T.C20-Diterpenoid alkaloids[A]//The Alkaloids Chemistry and Biology (59)[M].San Diega:San Diega Academic Press, 2002. |
| [22] | 王锋鹏. 生物碱化学[M]. 北京: 化学工业出版社, 2008 . |
| [23] | Lin L, Chen D L, Liu X Y, et al. Bis-diterpenoid alkaloids from Aeonitum tangutieum var.trichocarpum[J]. Nat Prod Commun , 2009, 4 (7) :897–901. |
| [24] | 张国红, 由会玲, 刘云肖. 乌头生物碱含量测定方法现况[J]. 河北中医药学报 , 2000, 15 (1) :45–47. |
| [25] | 顾少华, 汪庚先. 乌头及其制剂中乌头生物碱的测定方法进展[J]. 洛阳医专学报 , 1994, 13 (2) :122–123. |
| [26] | Yue H, Pi Z F, Song F R, et al. Studies on the aeonitine-type alkaloids in the roots of Aconitum carmichaeli Debx.By HPLC/ESI MS/MSn[J]. Talanta , 2009, 77 (5) :1800–1807. DOI:10.1016/j.talanta.2008.10.022 |
| [27] | 张毅, 翁代群, 王海军, 等. 乌头碱的水解动力学研究[J]. 中草药 , 2009, 40 (增刊) :126–128. |
| [28] | 王勇, 石磊, 金东明, 等. 四逆汤煎煮过程中乌头类生物碱的溶出和水解平衡[J]. 中草药 , 2003, 34 (4) :311–314. |
| [29] | 李文东.乌头碱体内代谢产物分析方法研究[D].北京:中国协和医科大学, 2000. http://d.wanfangdata.com.cn/Thesis/Y521851 |
| [30] | 王瑞, 展晓日, 乔延江, 等. 附子中3种双酯型生物碱在体外血浆中的水解规律研究[J]. 中国实验方剂学杂志 , 2009, 15 (6) :29–32. |
| [31] | 王勇, 刘志强, 宋凤瑞, 等. 草乌花及其煎煮液中二萜生物碱的电喷雾串联质谱研究[J]. 药学学报 , 2003, 38 (4) :290–293. |
| [32] | 黄勤安, 张聿梅, 何轶, 等. 乌头碱水解转化规律的研究[J]. 中国中药杂志 , 2007, 32 (20) :2143–2145. |
| [33] | 图雅, 张贵君, 刘志强, 等. 传统蒙药草乌炮制原理的电喷雾质谱研究[J]. 中药材 , 2008, 31 (2) :204–206. |
| [34] | 王勇, 宋风瑞, 刘志强, 等. 草乌花煎煮过程中三酯型乌头生物碱的酯交换反应[J]. 中草药 , 2006, 37 (8) :1156–1158. |
| [35] | 图雅, 张贵君, 王淑敏, 等. 草乌叶及其煎煮液中生物碱类药效组分的电喷雾串联质谱研究[J]. 中国中药杂志 , 2008, 33 (7) :789–790. |
| [36] | 陈学国, 赖永权, 蔡宗苇. 液相色谱-电喷雾离子阱质谱分析乌头碱及其代谢物[J]. 质谱学报 , 2012, 33 (2) :65–73. |
| [37] | 周玲. 乌头类中药化学成分及其生物碱含量测定方法的研究概况[J]. 中国中医药现代远程教育 , 2011, 9 (2) :223. |
| [38] | 刘帅, 李飞, 侯跃飞, 等. 诃子中的鞣质成分对诃子汤制草乌的影响:诃子制草乌炮制原理探讨I[J]. 中国实验方剂学杂志 , 2013, 19 (5) :158–160. |
| [39] | 王勇, 刘志强, 宋凤瑞, 等. 附子配伍原则的电喷雾质谱研究[J]. 药学学报 , 2003, 38 (6) :451–454. |
| [40] | 徐建东, 王洪泉, 张文英, 等. 大黄附子汤中诸药的不同组合及煎法对乌头碱含量的影响[J]. 中国药房 , 2003, 14 (10) :634–635. |
| [41] | 李志勇, 张硕峰, 畅洪昇, 等. 不同炮制时间附子饮片双酯型生物碱含量变化与饮片安全的相关性研究[J]. 中国中药杂志 , 2009, 34 (9) :1086–1089. |
| [42] | 刘力敏, 王洪诚, 朱元龙. 中国乌头之研究XIX.四川雪上一枝蒿中生物碱及其结构[J]. 药学学报 , 1983, 18 (1) :39–44. |
| [43] | 王勇, 刘淑莹, 刘志强, 等. 雪上一支蒿中乌头碱类生物碱的电喷雾串联质谱分析[J]. 分析化学 , 2003, 31 (2) :139–142. |
| [44] | Deasi H K, Hart D B, Caldwell R W, et al. Certain norditerpenoid alkaloids and their cardiovascular action[J]. J Nat Prod , 1998, 61 (6) :743–748. DOI:10.1021/np970499j |
| [45] | 彭崇胜, 王锋鹏. 天然去甲二萜生物碱的研究进展[J]. 药学学报 , 2000, 35 (12) :932–938. |
| [46] | Stefanowicz P, Prasain J K, Yeboah K F, et al. Detection and partial structure elucidation of basic taxoids from Taxus wallichiana by electrospry ionization tandem mass spectrometry[J]. Anal Chem , 2001, 73 (15) :3583–3589. DOI:10.1021/ac010254i |
| [47] | 陈笑艳, 杨汉煜, 钟大放, 等. 固相萃取-液相色谱-串联质谱法快速分析血浆中特布他林[J]. 药学学报 , 2001, 36 (9) :686–689. |
| [48] | 张聿梅, 鲁静, 蒋渝, 等. 川乌和制川乌中单酯及双酯型生物碱成分的含量测定[J]. 药物分析杂志 , 2005, 25 (10) :807–812. |
| [49] | 匡海学. 中药化学[M]. 北京: 中国中医药出版社, 2003 . |
| [50] | 刘永刚, 于达亮, 陈玉娟, 等. HPLC-ESI-MSn法研究中乌头碱在水中的化学反应[J]. 中国新药杂志 , 2008, 17 (2) :153–156. |
| [51] | 郗瑞云, 刘永刚, 张宏桂, 等. HPLC-MSn法研究次乌头碱在水中的化学反应[J]. 北京中医药大学学报 , 2007, 30 (8) :539–542. |
| [52] | 王勇, 刘志强, 宋风瑞, 等. 白山草乌中二萜生物碱的电喷雾串联质谱分析[J]. 质谱学报 , 2002, 23 (3) :161–163. |
| [53] | 王俊伟, 郭亚飞, 陈丽涛, 等. 乌头碱的LC-MS定量分析[J]. 分析测试学报 , 2004, 9 (23) :57–61. |
| [54] | 李萌, 张根衍, 潘桂湘. LC-MS/MS测定乌头属中药中8个生物碱含量[J]. 辽宁中医药大学学报 , 2014, 16 (2) :51–53. |
 2016, Vol. 47
2016, Vol. 47


