2. 成都市新都区中医医院, 四川 成都 610500
2. The Traditional Chinese Medicine Hospital of Xindu District, Chengdu 610500, China
美洲大蠊Periplaneta americana L.俗称“蟑螂”,始载于《神农本草经》,至今已有1 000多年的药用历史,具有活血化瘀、解毒消疳等功效[1-3]。现代研究表明,其体内富含肽类、氨基酸、黏多糖等多种药效成分组,临床上常用于肿瘤、心血管疾病、组织修复等方面的治疗[3-8]。本课题组在前期研究的基础上,发现多肽等生物活性物质为其抗肿瘤的主要药效组分,因其安全无毒、疗效显著,现已成为国内外广大医药工作者研究的热点。美洲大蠊属于动物药,含有大量的构材物质和无效成分,为了进一步筛选药效物质基础、富集有效组分,增强药物疗效及利于后续制剂的研究,有必要对其提取液进行纯化处理[9]。文献研究表明,大孔树脂在分离纯化多肽、蛋白质等生物活性物质时具有选择性好、条件温和、操作方便和成本较低的优点,近年来被广泛应用于中药大生产[10-13]。大孔树脂根据极性大小分为极性、弱极性和非极性几种类型,不同类型的大孔树脂对活性肽的吸附能力不同。因此,本课题组拟采用大孔树脂对美洲大蠊提取液中多肽进行分离纯化,筛选出最佳树脂型号,并系统考察各因素对其吸附解吸的影响,以期得到最佳纯化工艺参数,为分离纯化动物类药材中活性肽及其工业化大生产提供一定的参考和依据[14-16]。
1 仪器与材料LGJ-18C型冷冻干燥机,北京四环科学仪器厂有限公司;UV1700PC紫外分光光度仪,上海凤凰仪器有限公司;WJ-2型CO2培养箱,上海跃进医疗器械厂;CKX41-OLYMPUS倒置显微镜,日本SANYO.Electric.Co.Ltd.;BUCHI组合旋转蒸发仪,瑞士Buchi公司;日立全自动氨基酸分析仪L-8900,日本Hitachi公司。
美洲大蠊干燥成虫,经泸州医学院药学院生药教研室税丕先教授鉴定为昆虫纲蜚蠊目蜚蠊科昆虫美洲大蠊Periplaneta americana L.的干燥全体,四川好医生药业集团有限公司,打成粗粉,于60 ℃下干燥备用;对照品牛血清白蛋白(BSA),批号140619-200401,购于中国食品药品检定研究院;顺铂注射液(DDP),批号120701,云南个旧生物药业有限公司;RPMI 1640培养基(批号NYH0953)、胎牛血清(批号NYM1035),购自Gibco公司;CCK-8(cell counting kit-8),碧云天生物技术研究所;AB-8、D-101、DA-201型大孔吸附树脂,沧州宝恩吸附材料科技有限公司;HP20,北京绿百草科技发展有限公司;NKA-9、DM-301型大孔吸附树脂,天津市海光化工有限公司;福林酚试剂(批号PRLB09050),上海尚谊化工科技有限公司;硫酸铜、磷酸二氢钾等试剂均为分析纯。
人结肠癌细胞株HCT116和红白血病细胞株K562,均来自四川大学华西医学中心;人肝癌SMMC-7721细胞株,中国科学院上海药物研究所。
2 方法与结果 2.1 美洲大蠊上柱液的制备取美洲大蠊饮片粗粉1 kg,石油醚脱脂,加10倍量90%乙醇浸泡48 h,渗漉提取,以3 mL/(min·kg)的滴速进行渗漉,在50 ℃减压浓缩为0.2 g/mL的供试品液(以原生药计算)。
2.2 多肽定量的测定 2.2.1 对照品溶液的制备精密称取BSA对照品51.80 mg,加水溶解配制成含BSA 518.0 μg/mL的对照品溶液。
2.2.2 供试品溶液的制备根据每次实验中多肽的质量浓度,精密量取一定量的美洲大蠊上柱液,加水稀释至适量,定容至10 mL,摇匀,即得供试品溶液。
2.2.3 线性范围的考察精密吸取0(空白)、0.2、0.4、0.6、0.8、1.0 mL BSA对照品溶液,加蒸馏水补足至1.0 mL。加5.0 mL碱性铜试剂,混匀,快速加入0.5 mL酚试剂,混匀,55 ℃水浴15 min,取出冷却至室温,在740 nm处测定吸光度(A)值,以A值对多肽质量浓度(C)进行线性回归,得回归方程为A=0.007 1 C+0.087,r=0.999 3,表明BSA在15.938~79.692 μg/mL质量浓度与A值呈良好的线性关系。
2.3 对3种肿瘤细胞增殖的影响 2.3.1 阳性对照样品制备将DDP用培养液配制为3个质量浓度(0.1、1.0、10.0 μg/mL)。
2.3.2 供试样品的制备将样品冷冻干燥得冻干粉20 mg,加水5 mL溶解,配得母液质量浓度为4 mg/mL,0.22 μm一次性过滤器滤过,再倍比稀释为4 000、2 000、1 000、500、250、125 μg/mL共6个质量浓度。
2.3.3 细胞培养将上述3种肿瘤细胞用含10%胎牛血清的RPMI 1640培养基于37 ℃、5% CO2培养箱内常规培养。
2.3.4 样品对肿瘤细胞增殖的影响将肿瘤细胞以每孔90 μL接种入培养板(5×104个/mL)中,置培养箱中(37 ℃、5% CO2)培养24 h,空白对照孔仅加培养基,受试组分别加10 μL上述不同质量浓度的样品,终质量浓度为12.5、25、50、100、200、400 μg/mL,每组各3个复孔。加药后继续培养48 h,每孔加CCK-8(10 μL),置培养箱中继续培养2 h,测定各孔的A值,重复3次。半数抑制浓度(IC50)采用LOGIT法计算。
2.4 工艺参数考察与优化 2.4.1 树脂的静态吸附、解吸性能考察分别称取2 g已处理好的净品级6种大孔树脂,分别加入30 mL生药质量浓度为0.2 g/mL的美洲大蠊上柱液,以150 r/min恒温振荡12 h(25 ℃),收集滤液,测定多肽质量分数,计算不同树脂静态吸附率;将吸附饱和的美洲大蠊上柱液树脂抽干,加入70%乙醇30 mL,以150 r/min恒温振荡12 h(25 ℃)解吸,滤过,测定多肽质量分数,计算解吸率,结果见表 1。由表 1可知,AB-8、D-101、DA-201、HP20型大孔树脂的吸附率相差不大,但HP20解吸率较大,故选择HP20树脂。
|
|
表 1 不同大孔树脂的吸附及解吸情况(n=3) Table 1 Adsorption and desorption rate of on various macroporous resins (n=3) |
2.4.2 树脂的动态吸附性能考察
取0.2 g/mL美洲大蠊上柱液适量,缓慢加入预处理好的HP20树脂中(30 cm×2 cm,30 g树脂),以2 BV/h体积流量通过树脂,每20 mL(即0.5倍BV)收集1个流分,共20个流分。以多肽质量浓度为纵坐标,流出液体积为横坐标,绘制动态吸附曲线,见图 1。从图 1可知,在开始流出液中的多肽质量浓度很低,表明树脂的吸附量大,随着流份数的增加,多肽质量浓度不断上升,从第2.5 BV时,多肽质量浓度急剧增加,出现大量泄漏,故确定上样体积为2 BV。
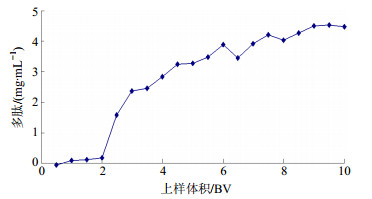
|
图 1 HP20树脂动态吸附曲线 Fig.1 Figure of dynamic adsorption curve of HP20 |
2.4.3 上柱液质量浓度考察
分别量取2 BV生药质量浓度为0.1、0.2、0.3、0.4、0.5、0.6 g/mL美洲大蠊上柱液上树脂柱,体积流量为2 BV/h,收集流出液,测定多肽质量分数,计算不同质量浓度样品液的吸附率,结果吸附率分别为98.07%、97.28%、97.19%、76.84%、62.53%、56.19%。由结果可知,上柱液质量浓度越低,吸附效果越好,多肽吸附率越大,这可能是因为当上样体积一定的情况下,上柱液质量浓度越低,多肽与树脂接触越充分,吸附较完全,但样品质量浓度越稀,耗时越长,考虑到生产的可行性,故上柱液以质量浓度0.3 g/mL上样。
2.4.4 上柱液体积流量对吸附的影响取2 BV生药质量浓度为0.3 g/mL的美洲大蠊上柱液,分别以不同体积流量(1、2、3 BV/h)通过树脂柱,收集流出液,测定多肽质量浓度,考察上样液不同体积流量对树脂吸附率的影响,结果测得吸附率分别为97.26%、97.13%、90.28%。由结果可知,体积流量由1 BV/h增加到3 BV/h,吸附效果减弱,而上样体积流量为1、2 BV/h时对树脂的吸附率差异不大,为提高效率,故上样体积流量为2 BV/h。
2.4.5 洗脱溶媒种类对解吸效果的影响取生药质量浓度为0.3 g/mL美洲大蠊上柱液通过树脂柱(2 BV/h,2 BV),静置1 h,分别以30%、50%、70%、90%乙醇洗脱(2 BV/h,4 BV),收集不同体积分数乙醇的洗脱液,测定多肽质量浓度,考察不同体积分数乙醇的解吸效果,结果解吸率分别为58.94%、91.14%、91.38%、71.53%。不同体积分数的乙醇,溶解性能不同,洗脱的物质基础也有所差异,因而对其药理效应也会存在一定的影响,为尽可能保证疗效,故将不同体积分数的乙醇洗脱液制备成冻干粉末,照“2.3.2”项下方法制备供试样品,按“2.3.4”项下方法测试其对肿瘤细胞增殖的影响,结果见图 2~4和表 2。由解吸率测定结果可知,以50%和70%乙醇洗脱时解吸率较高,但两者相差不明显,结合图 2~4和表 2可知,50%、70%及90%乙醇洗脱得到的冻干粉均可抑制肿瘤细胞的增殖,以70%乙醇洗脱的抑制率最强,IC50最小,故洗脱溶媒选定为70%乙醇。
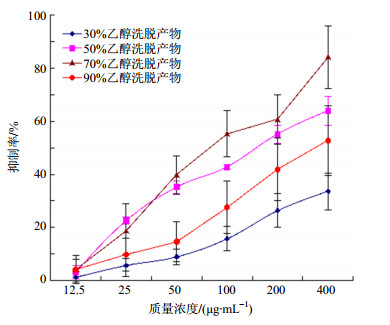
|
图 2 不同种类溶媒洗脱产物对K562细胞增殖的抑制作用(x±s, n=3) Fig.2 Inhibition of product eluted by various solvents on K562 cell proliferation (x±s, n=3) |
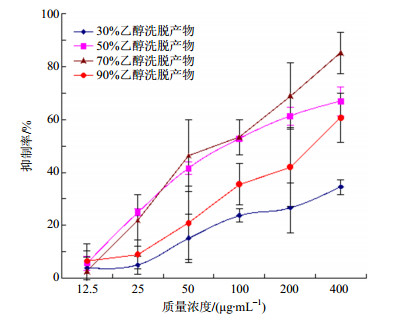
|
图 3 不同种类溶媒洗脱产物对SMMC-7721细胞增殖的抑制作用(x±s, n=3) Fig.3 Inhibition of products eluted by various solvents on SMMC-7721 cell proliferation (x±s, n=3) |
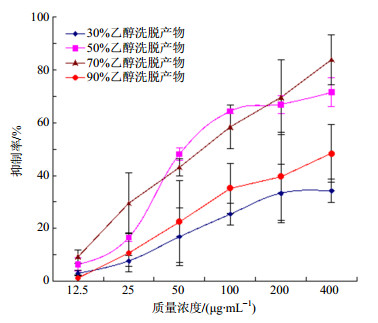
|
图 4 不同种类溶媒洗脱产物对HCT116细胞增殖的抑制作用(x±s, n=3) Fig.4 Inhibition of products eluted by various solvents on HCT116 cell proliferation (x±s, n=3) |
|
|
表 2 不同种类溶媒洗脱产物抑制3种肿瘤细胞的IC50 (n=3) Table 2 IC50 of three kinds of cancer cells inhibited by different menstruums eluted products (n=3) |
2.4.6 洗脱剂用量对解吸效果的影响
取2 BV生药浓度为0.3 g/mL美洲大蠊上柱液,以2 BV/h上样,静置1 h,用70%乙醇洗脱(2 BV/h,5 BV),每20 mL收集1个流分(即0.5倍BV),共10个流分,测定洗脱流分中多肽质量浓度,绘制多肽洗脱曲线,见图 5。由图 5可知,用70%乙醇洗脱,随洗脱体积的增加,多肽质量浓度先增大后逐渐减少,至2 BV后,洗脱液中几乎已无多肽,故洗脱剂用量为2 BV。
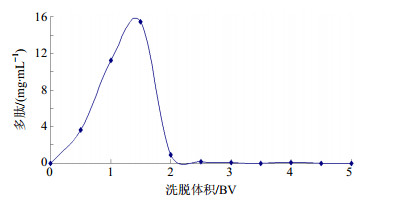
|
图 5 洗脱曲线图 Fig.5 Elution curve |
2.4.7 洗脱剂体积流量对解吸效果的影响
取2 BV生药质量浓度为0.3 g/mL美洲大蠊上柱液,以2 BV/h上样,静置1 h,再用70%乙醇2 BV以不同洗脱体积流量(1、2、3 BV/h)洗脱,结果解吸率为91.86%、91.57%、85.72%。由结果可知,当固定洗脱剂用量时,洗脱剂体积流量越小,与树脂接触时间较长,洗脱效果越好,可见体积流量低有利于多肽解吸,但体积流量过小效率太低,故选择洗脱剂体积流量为2 BV/h。
2.4.8 验证试验根据上述实验结果,按照最佳条件操作,即取生药质量浓度为0.3 g/mL美洲大蠊上柱液2 BV,以2 BV/h上样,静置1 h,用70%乙醇洗脱(2 BV/h,2 BV),收集洗脱液,测定多肽质量分数,计算回收率,平行3次试验,多肽平均回收率为88.53%,RSD为0.74%,说明HP20大孔树脂对美洲大蠊多肽有较好分离纯化效果,该工艺合理可行,重现性好。
2.5 氨基酸组成分析及质量分数检测用氨基酸自动分析仪测定美洲大蠊70%乙醇洗脱液冻干粉中游离氨基酸和构成多肽的氨基酸的种类和质量分数。
2.5.1 测定条件离子交换柱(60 mm×4.6 mm,3 μm);流动相为柠檬酸-柠檬酸纳缓冲液;波长:频道1(570 nm),频道2(440 nm,脯氨酸,proline);柱温57 ℃;体积流量:柱泵1、泵2分别为0.4、0.35 mL/min,进样体积20 μL。
2.5.2 对照品溶液的制备精密吸取氨基酸混合对照品0.2 mL于5 mL量瓶中,用pH 2.2缓冲液稀释至刻度,滤过(0.2 μm),取续滤液,即得。
2.5.3 供试品溶液的制备称取0.2 g冻干粉,加50 ml 70%乙醇溶解,取续滤液,加盐酸(6 mo1/L),充入氮气,110 ℃干燥箱中酸水解24 h,冷却,用盐酸(6 mol/L)稀释至25 ml量瓶中,蒸去盐酸,加入盐酸(0.02 mo1/L)溶解,滤过(0.2 μm),取续滤液,即得。
2.5.4 供试品溶液的检测以外标法测定供试品溶液中氨基酸质量分数,结果见图 6(因脯氨酸是通过频道2所测,色氨酸通过碱水解所测,故在图 6中没有这2个色谱峰)和表 3。可知美洲大蠊有效部位含有18种水解氨基酸(其中色氨酸通过碱水解),质量分数为59.40%;17种游离氨基酸,质量分数为3.76%,故含结合型氨基酸即多肽约55.64%。
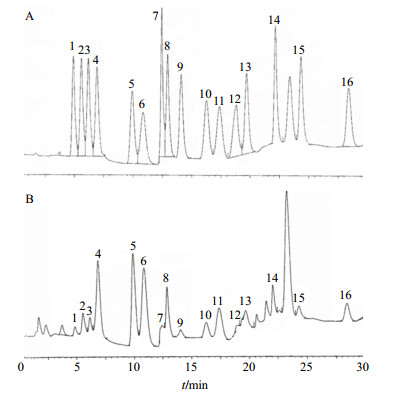
|
1-天门冬氨酸2-苏氨酸3-丝氨酸4-谷氨酸5-甘氨酸6-丙氨酸7-胱氨酸8-缬氨酸9-蛋氨酸10-异亮氨酸11-亮氨酸12-络氨酸13-苯丙氨酸14-赖氨酸15-组氨酸16-精氨酸 1-aspartic acid 2-threonine 3-serine 4-glutamate 5-glycine 6-alamine 7-cystine 8-valine 9-methionine 10-isoleucine 11-leucine 12-tyrosine 13-phenylalanine 14-lysine 15-histidine 16-arginine 图 6 混合对照品(A)和样品(B) HPLC图 Fig.6 HPLC of mixed reference substances (A) and sample (B) |
|
|
表 3 美洲大蠊冻干粉中氨基酸的种类与质量分数 Table 3 Amino acid species and content of lyophilized powder in P. americana |
3 讨论
美洲大蠊是世界上最古老、生命力最顽强的昆虫种类之一,在地球上已经生存了3.2亿年之久,随着对其研究的深入,医药工作者逐渐开发出一系列疗效确切的新制剂,如“消症益肝片”“康复新”等。近年来实验研究表明,美洲大蠊提取物能抑制S180小鼠肉瘤生长,提高荷瘤小鼠血清中肿瘤坏死因子-α(TNF-α)的水平[17]。采取新工艺提取的美洲大蠊抗癌活性组分主要由一系列小分子多肽组成,具有体外抗氧化作用[18]。
据文献报道[18]美洲大蠊中的多肽类成分为抗肿瘤主要有效部位,目前分离纯化该类成分的方法有:凝胶过滤法、盐析法、色谱法、等电点沉淀法、超滤法等。而大孔树脂再生处理方便、吸附容量大、对于多肽类化合物的分离纯化具有较好的效果。大孔吸附树脂是一种不溶于有机溶剂、酸、碱的高分子聚合物,其颗粒总表面积较大,具有较大的吸附能力,因带有一定极性基团,可以通过调整化合物的性质和体系亲水疏水平衡,引起所需成分的吸附或解吸。本实验根据吸附和解吸结果,对不同极性的大孔树脂进行考察,选择非极性的HP20树脂分离纯化美洲大蠊抗肿瘤多肽。HP20树脂是通过非极性吸附剂和化合物的疏水基团间的范德华引力进行吸附,实验发现HP20树脂对美洲大蠊提取液中多肽具有较好的吸附特性;而随着洗脱剂极性降低,洗脱能力增加,本实验通过调整乙醇-水的比例来改变洗脱剂的极性,从而对提取液中抗肿瘤活性成分进行富集和纯化。
在洗脱剂的选择中,将指标成分定量检测与体外肿瘤细胞抑制试验有机的结合,能高效准确地筛选到合适的洗脱剂。采用较高体积分数的乙醇进行洗脱,多肽的解吸率和抑制肿瘤细胞的增殖方面效果显著,表明美洲大蠊洗提取中大部分小分子肽段能被HP20吸附,又能被70%乙醇充分地将其有效地分离出来,以达到富集的目的。经大孔树脂纯化后的抗肿瘤多肽还不是单一组分,还需要进一步采取葡聚糖凝胶、反相高效制备液相等手段分离纯化具有抗肿瘤的活性多肽。
| [1] | 孙星衍. 神农本草经[M]. 北京: 商务印书馆, 1955 . |
| [2] | 张臻, 傅超美, 胡慧玲, 等. D-最优混料设计优化美洲大蠊乳膏的基质配方研究[J]. 中草药 , 2013, 44 (12) :1574–1578. |
| [3] | 史未名. 美洲大蠊的药用研究进展[J]. 中国民族民间医药 , 2012, 21 (3) :50–51. |
| [4] | He Z C, Peng F, Song L Y, et al. Review on investigations related to chemical constituents and biological activities of periplanetaamericana[J]. Chin J Chin Mater Med , 2007, 32 (21) :2326–2331. |
| [5] | 何正春, 彭芳, 宋丽艳, 等. 美洲大蠊化学成分及药理作用研究进展[J]. 中国中药杂志 , 2007, 32 (21) :2326–2331. |
| [6] | 汤雁利, 李罡, 李启艳. 康复新药理作用的研究进展[J]. 西北药学杂志 , 2014, 29 (1) :103–106. |
| [7] | 罗廷顺, 高孟婷, 马芳芳, 等. 美洲大蠊药理作用及临床应用研究进展[J]. 安徽农业科学 , 2013 (10) :5933–5935. |
| [8] | 胡艳芬, 吕小满, 刘光明, 等. 美洲大蠊提取物对两株人肺癌细胞的影响[J]. 药物分析杂志 , 2011, 31 (7) :1245–1249. |
| [9] | 谭承佳, 马家骅, 蒋巧梅, 等. 蜣螂中间体的大孔树脂纯化工艺优选及检测[J]. 中国实验方剂学杂志 , 2013, 19 (11) :8–10. |
| [10] | 张东方, 信颖. 中药现代分离技术[M]. 沈阳: 辽宁大学出版社, 2006 . |
| [11] | 王瑞海, 柏冬, 刘寨华, 等. 秦皮总香豆素大孔树脂纯化工艺研究[J]. 中草药 , 2015, 46 (22) :3344–3351. |
| [12] | Nie S P, Xie M Y. A review on the isolation and structure of tea polysaccharides and their bioactivities[J]. Food Hydrocolloids , 2011, 25 (2) :144–149. DOI:10.1016/j.foodhyd.2010.04.010 |
| [13] | 张旭, 王锦玉, 仝燕, 等. 大孔树脂技术在中药提取纯化中的应用及展望[J]. 中国实验方剂学杂志 , 2012, 18 (6) :286–290. |
| [14] | 刘志东.乳抗氧化肽的分离、纯化及生物活性研究[D].上海:上海海洋大学, 2008. http://www.cnki.com.cn/article/cjfdtotal-trcw201005002.htm |
| [15] | 陈飞平, 周家华, 曾凡坤. 苋籽ACE抑制肽的大孔树脂分离纯化[J]. 食品工业科技 , 2013, 34 (11) :271–276. |
| [16] | 刘艳, 田吉, 何兵. 大孔吸附树脂纯化楤木总皂苷的工艺研究[J]. 中草药 , 2011, 42 (4) :694–697. |
| [17] | 何旭, 普小菲, 李娇, 等. 美洲大蠊提取物对S180荷瘤小鼠肿瘤抑制作用及免疫功能的影响[J]. 中国实验方剂学杂志 , 2012, 18 (15) :180–182. |
| [18] | 张成桂, 何正春, 焦春香, 等. 美洲大蠊抗癌活性成分体外抗氧化活性分析[J]. 时珍国医国药 , 2010, 21 (9) :2249–2250. |
 2016, Vol. 47
2016, Vol. 47


