2. 贵州医科大学药学院, 贵州 贵阳 550004 ;
3. 国家苗药工程技术研究中心, 贵州 贵阳 550004
2. School of Pharmacy, Guizhou Medical University, Guiyang 550004, China ;
3. National Engineering Research Center of Miao's Medicines, Guiyang 550004, China
头花蓼为蓼科(Polygonaceae)蓼属Polygonum L.多年生草本植物头花蓼Polygonum capitatum Buch. -Ham. ex D. Don的全草,是贵州省别具特色的苗药资源之一。目前,头花蓼已成为贵州省中药现代化重点培育发展的“十大苗药”和“十大中药产业链”品种之一,收载于《贵州省中药材、民族药材质量标准》2003年版[1]。其具有清热解毒、利尿通淋之效,临床上主要用于肾盂肾炎、尿路结石、尿道感染、疮疡湿疹等症的治疗[2]。以头花蓼为原料的单方制剂热淋清颗粒收载于《中国药典》2015年版,在治疗尿路感染的中成药中,自2009年开始至今其销量一直排名第一[3-5]。近年来,虽然对头花蓼提取物的吸收特性有相关研究[6],但尚未见头花蓼有效组分体内代谢研究的报道。本课题组前期通过研究发现,头花蓼经水煮、乙醇沉淀、正丁醇萃取后的部位为有效组分,主要为黄酮及酚酸类化合物。因此,本实验以头花蓼有效组分为实验对象,通过收集健康SD大鼠给药后的粪便及胆汁,利用超高效液相色谱串联电喷雾四极杆飞行时间质谱(UPLC-ESI-Q-TOF-MS/MS)对各生物样品进行检测,结合代谢产物预测、筛查技术Metabolite ToolsTM、SmartFormula及质量亏损过滤(MDF),对经大鼠ig头花蓼有效组分后的代谢产物进行快速分析,研究头花蓼有效组分在大鼠体内的生物转化规律,推测药物中活性或潜在的活性成分可能的代谢途径,为头花蓼及其制剂的临床应用及深度开发奠定实验基础。
1 材料 1.1 仪器与试药Agilent Technologies 1290 Infinity液相色谱系统(包括1290 Infinity二元泵,高性能自动进样器,二级管阵列检测器,柱温箱);UPLC-ESI-Q-TOF-MS/MS(布鲁克道尔顿超高压液相色谱电喷雾四极杆飞行时间质谱仪,包括代谢分析软件Metabolite ToolsTM、MDF软件等);Allegra 64R低温高速离心机(美国Beckman Coulter公司);CQ 250A-TS超声波清洗机(上海跃进医用光学器械厂);MTN-2800D氮吹浓缩装置(天津奥特塞恩斯仪器有限公司);EL204电子天平(梅特勒-托利多仪器有限公司)。没食子酸、原儿茶酸、槲皮素、槲皮苷、金丝桃苷对照品均由贵州医科大学贵州省药物制剂重点实验室天然活性产物研究室制备,经HPLC检测质量分数≥98%;头花蓼药材购自贵州施秉头花蓼GAP种植基地,由贵州医科大学药学院生药学教研室龙庆德副教授鉴定为头花蓼Polygonum capitatum Buch. -Ham. ex D. Don的全草;头花蓼有效组分(自制,批号20140307);代谢笼(意大利Tecniplast公司);乙腈为色谱纯(德国Merck公司);甲酸为色谱纯;水为纯净水;其他试剂均为分析纯。
1.2 动物健康SD大鼠,雌雄兼用,体质量为(220±20)g,由贵州医科大学动物中心提供,许可证号SCXK(黔)2002-0001。
2 方法 2.1 头花蓼有效组分的制备取头花蓼药材,加10倍量水煎煮3次,每次1 h,滤过,合并滤液,减压浓缩至相对密度1.05~1.07(50 ℃),加乙醇至含醇量为65%,搅拌均匀,静置12 h,抽滤,滤液减压回收乙醇并浓缩至相对密度1.04~1.06(50 ℃),用1/2倍量水饱和正丁醇提取3次,合并正丁醇液,减压回收正丁醇,残留物微波真空干燥,得头花蓼有效组分,收膏率为2.3%。头花蓼有效组分中没食子酸、原儿茶酸、槲皮素、槲皮苷、金丝桃苷的质量分数分别为1.45%、0.04%、1.67%、0.21%、0.06%。
2.2 生物样品的采集SD大鼠6只,雌雄各半,饲养于代谢笼中,给药前禁食12 h,自由饮水。分别收集空白粪样,以87 g/kg(生药量)的剂量ig给予头花蓼有效组分,连续给药3 d,每天2次,分别收集末次给药后12、24、48、72 h时间段的粪便,并记录各时间段烘干后粪便的质量。-20 ℃冰箱保存,待测。
SD大鼠4只,手术前禁食12 h,自由饮水。乌拉坦麻醉状态下实施胆管插管手术,1只大鼠ig给予蒸馏水,收集胆汁作为对照,另外3只大鼠按87 g/kg剂量ig头花蓼有效组分,分别收集给药后0~4、4~12、12~24 h时段的胆汁样品。-20 ℃冰箱保存,待测。
2.3 生物样品处理取胆汁0.5 mL,补加4 mL甲醇,涡旋震荡2 min后,超声5 min,15 000 r/min离心10 min,取上清液于37 ℃氮气吹干,加入1 mL甲醇于吹干的样品中,按上述处理方法2次沉淀蛋白,加入50%甲醇水溶液300 μL溶解残留物,UPLC-Q-TOF-MS/MS进样分析。
取烘干后大鼠粪便0.5 g,用生理盐水制成25%匀浆,超声5 min后,5 000 r/min离心10 min,分离上层液取500 μL匀浆液,补加甲醇1 mL,涡混1 min,超声5 min,15 000 r/min离心10 min,上清液于37 ℃氮气吹干,加入0.5 mL甲醇于吹干的样品中,按上述处理方法2次沉淀蛋白,残留物用50%甲醇水溶液300 μL溶解,UPLC-Q-TOF-MS/MS进样分析。
2.4 色谱和质谱条件 2.4.1 色谱条件色谱柱为Agilent Eclipse Plus C18 RRHD(100 mm×2.1 mm,1.8 μm),柱温45 ℃,流动相0.1%甲酸水(A)-0.1%甲酸乙腈(B),采用梯度程序洗脱:0~10 min,5%~45% B;10~14 min,45%~95% B;14~15 min,95%~100% B;15~16 min,100%~15% B;进样体积为2 μL。
2.4.2 质谱条件电喷雾离子源,扫描方式为负离子扫描(ESI-,m/z 50~1 000),毛细管电压3 kV,锥孔电压80 V,离子源温度110 ℃,雾化气(N2)压力120 kPa,体积流量8.0 L/min,温度200 ℃,脱溶剂气温度300 ℃,气体体积流量50 L/h,脱溶剂气体积流量550 L/h,准确质量测定采用甲酸钠校正标准液,校正模式选用Enhanced Quadratic.数据分析,Data Analysis软件、Metabolite ToolsTM(包括Metabolite Predict及Metabolite Detect)软件、MDF软件。
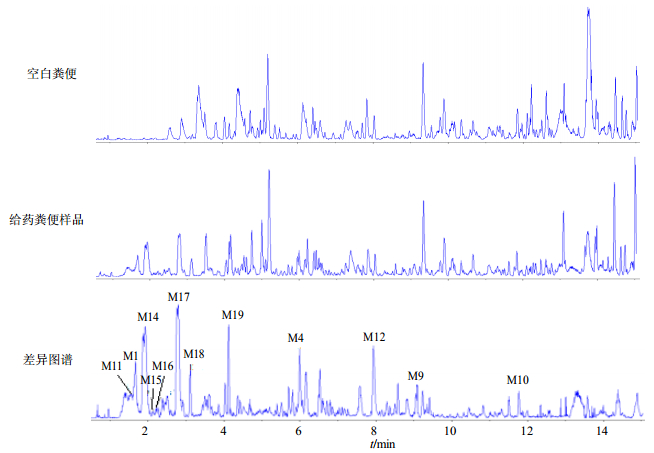
3 结果 3.1 头花蓼有效组分在大鼠粪便中的代谢产物鉴定分析运用Metabolite Tools软件将UPLC-Q-TOF-MS/MS采集的图谱进行处理,以MDF数据处理技术为基础,用于复杂生物机制中快速检测药物代谢产物[7]。通过Metabolite Detect软件得到空白粪便、含药粪便及两者差异图谱,初步推测出3个原型成分和9个代谢产物。图谱见图 1,各成分在ESI-模式下得到较好的响应信号。
|
图 1 头花蓼有效组分在大鼠粪便中的代谢产物ESI-总离子流图 Fig.1 ESI- total ion-current chromatograms of metabolites of P. capitatum extract in rats feces sample |
由Metabolite Detect软件得到的差异图谱中可知,在1.6 min处存在m/z 169.014 9 [M-H]-峰的化合物,显示125.024 4 [M-H-COO]-的主要碎片离子峰,与没食子酸对照品相同,由此确定tR 1.6 min的M1为原型成分没食子酸。在6.1 min处存在m/z 447.093 7 [M-H]-峰的化合物,显示301.034 9 [M-H-C6H10O4]-的主要碎片离子峰,与槲皮苷对照品相同,由此确定tR 6.1 min的M4为原型成分槲皮苷。在8.0 min处存在m/z 301.035 1 [M-H]-峰的化合物,与槲皮素对照品相同,由此确定tR 8.0 min的M12为原型成分槲皮素。在1.5 min处存在248.969 4 [M-H]-峰的化合物,显示125.024 0 [M-H-SO3-COO]-的主要碎片离子峰,由Smart Formula预测两者的化学式均为C7H5O8S,且其保留时间较没食子酸缩短,亲水性增加,推测tR 1.5 min的M11为没食子酸硫酸化代谢产物。根据同样的方法,推测代谢产物M9、M10、M14、M15~M16、M17、M18、M19分别为槲皮素二甲基化、槲皮素三甲基化、没食子酸甲基化、没食子酸二甲基化、原儿茶酸甲基化、原儿茶酸二甲基化、槲皮素O-C2键开环裂解代谢产物。粪便中的原型成分及代谢产物鉴定结果见表 1。
|
|
表 1 UPLC-ESI-Q-TOF-MS检测大鼠ig头花蓼有效组分后在粪便和胆汁中主要代谢产物 Table 1 Identification of metabolites of feces and bile in rats after ig administration with P. capitatum using UPLC-ESI-Q-TOF MS |
3.2 头花蓼有效组分在大鼠胆汁中的代谢产物鉴定分析
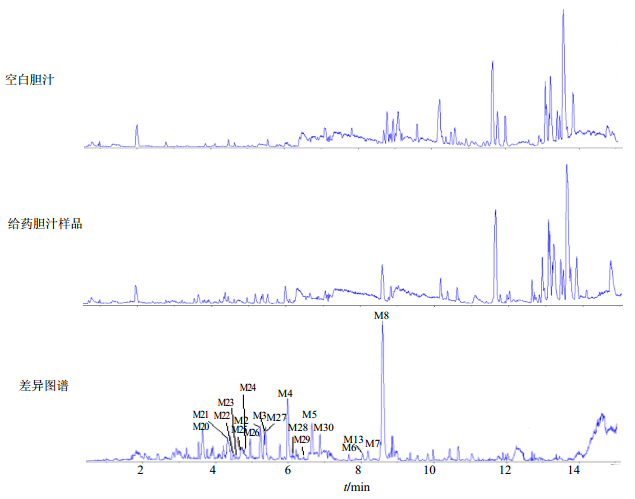
Metabolite Detect软件得到空白胆汁、含药胆汁及两者差异图谱,初步推测出2个原型成分和17个代谢产物。图谱见图 2,各成分在ESI+模式下得到较好的响应信号。
|
图 2 头花蓼有效组分在大鼠胆汁中的代谢产物ESI+总离子流图 Fig.2 ESI+ total ion-current chromatograms of metabolites of P. capitatum extract in rats bile sample |
由Metabolite Detect软件得到的差异图谱中可知,在5.4 min处存在m/z 463.087 2 [M-H]-峰的化合物,显示301.035 3 [M-H-C6H10O5]-的主要碎片离子峰,与金丝桃苷对照品相同,由此确定tR 5.4 min的M3为原型成分金丝桃苷。原型成分M4分析见“3.1”项。其中检测到槲皮苷葡萄糖醛酸化、槲皮素葡萄糖醛酸化、槲皮苷甲基葡萄糖醛酸化、槲皮素甲基葡萄糖醛酸化、槲皮素双葡萄糖醛酸化、槲皮素二甲基二葡萄糖醛酸化、槲皮素二甲基葡萄糖醛酸硫酸化、槲皮苷甲基化、槲皮素二硫酸化、槲皮素三甲基葡萄糖醛酸化和槲皮素二甲基葡萄糖醛酸化代谢产物共17个。代谢产物鉴定结果见表 1。
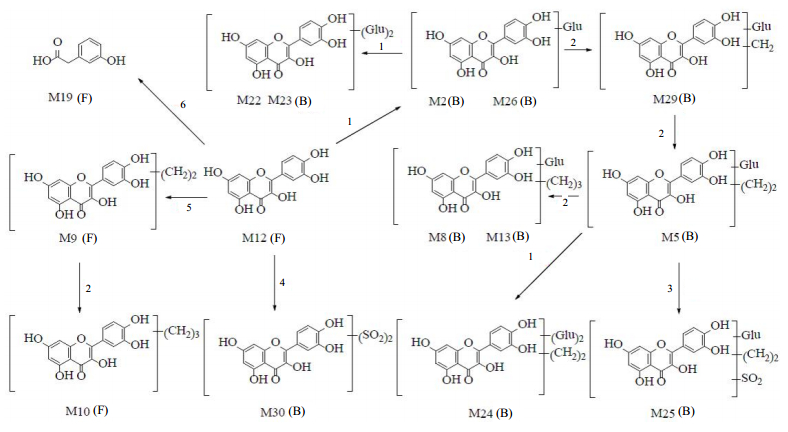
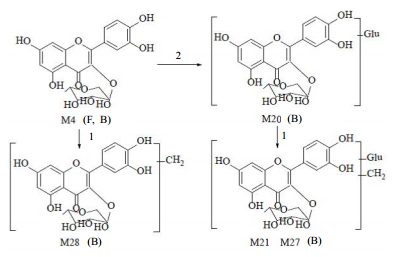
3.3 头花蓼有效组分在大鼠粪便及胆汁中的主要代谢产物结构及可能的代谢途径头花蓼有效组分中含有的原型成分槲皮素、槲皮苷、金丝桃苷、没食子酸及原儿茶酸推测的主要代谢途径见图 3~7。
|
1-葡萄糖醛酸化2-甲基化3-硫酸化4-二硫酸化5-二甲基化6-O-C2键开环裂解F-粪便B-胆汁 1-glucuronide conjugation 2-methylation 3-sulfate conjugation 4-2-sulfate conjugation 5-2-methylation 6-cleavage of O-C2 F-feces B-bile 图 3 头花蓼有效组分中槲皮素的主要代谢产物及可能代谢途径 Fig.3 Major metabolites of quercetin and possible biotransformation pathways in effective fractions of P. capitatum |
|
图 4 头花蓼有效组分中槲皮苷的主要代谢产物及可能的代谢途径 Fig.4 Major metabolites of quercitrin in effectine fractions of and possible P. capitatum biotransformation pathways |
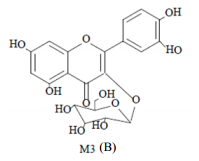
|
B-胆汁 B-bile 图 5 头花蓼有效组分中原型成分金丝桃苷 Fig.5 Prototype components hyperoside in effective fractions of P. capitatum |
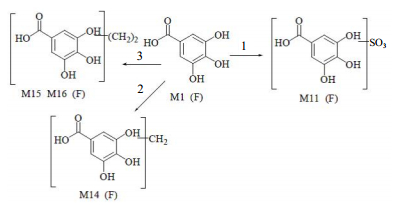
|
1-硫酸化2-甲基化3-二甲基化F-粪便 1-sulfate conjugation 2-methylation 3-2-methylation F-feces 图 6 头花蓼有效组分中没食子酸的主要代谢产物及可能的代谢途径 Fig.6 Major metabolites of gallic acid in effectine fractions of P. capitatum and possiblebiotransformation pathways |
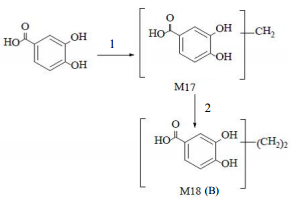
|
1-甲基化2-二甲基化F-粪便 1-methylation 2-2-methylation F-feces 图 7 头花蓼有效组分中原儿茶酸的主要代谢产物及可能的代谢途径 Fig.7 Major metabolites of protocatechuic acid in effectine fractions of P. capitatum and possible biotransformation pathways |
4 讨论
本实验分别采用正离子模式、负离子模式对样品进行检测,结果发现,生物样品在负离子模式下各色谱峰响应较好,这可能与所检测到的色谱峰中含有多个羟基,且大量代谢峰中连有葡萄糖醛酸基团、硫酸基团等有关。头花蓼有效组分在大鼠体内共检出30个代谢产物峰,其中粪便、胆汁分别有12、19个成分(含交叉成分),粪便样品中检测到大量酚酸类成分的甲基化产物及槲皮素O-C2键开环裂解产物,同时也存在大量的槲皮素、槲皮苷原型成分。胆汁样品中检测到大量槲皮素三甲基葡萄糖醛酸化产物及槲皮苷原型成分,其次主要以槲皮素甲基化及葡萄糖醛酸化、槲皮苷甲基化及葡萄糖醛酸化产物为主。槲皮素结构中含有多个酚羟基,在体内尿苷二磷酸葡萄糖基转移酶(UGT)、磺基转移酶(SULTs)及儿茶酚胺O-甲基转移酶(COMTs)等作用下易发生葡萄糖醛酸、硫酸及甲基化代谢反应。以上结果表明头花蓼有效组分槲皮素口服吸收后可发生葡萄糖醛酸化、甲基葡萄糖醛酸化、硫酸化等代谢,相应代谢产物可在粪便和胆汁中检出。
UPLC-ESI-Q-TOF-MS和相应的处理软件结合使用,能够更好的提高效率,获得更加丰富的信息,能作为中药代谢研究的实用模式,也被认为是代谢研究的“第一线”方法[8-10]。本研究建立UPLC-ESI-Q-TOF-MS对粪便、胆汁的检测方法,其具有离子传输效率高、传输离子质量范围宽、灵敏度高、错误率低、重现性高等优点,并结合超高压液相(UPLC)的高灵敏度和基线稳定性为研究带来了优良的分析能力。借助UPLC-ESI-Q-TOF-MS,可在16 min内完成胆汁等复杂生物样品中的头花蓼有效组分的代谢轮廓分析。此法可对检测样品色谱信息进行全采集,且各色谱峰分离较好,为后期分析处理海量的代谢数据奠定基础。
| [1] | 贵州省中药材、民族药材质量标准[S]. 2003. |
| [2] | 王洪平, 曹芳, 杨秀伟. 头花蓼地上部分的化学成分研究[J]. 中草药 , 2013, 44 (1) :24–30. |
| [3] | 梁秀芳. 热淋清颗粒治疗泌尿系感染30例临床观察[J]. 医学信息 , 2010, 9 (5) :2505–2506. |
| [4] | 王中洋, 潘舒, 吴亚利, 等. 热淋清颗粒药理作用实验研究[J]. 实用中医内科杂志 , 2012, 26 (3) :12–14. |
| [5] | 王祥培, 钱海兵, 吴红梅, 等. 热淋清颗粒含药血浆的高效液相色谱分析[J]. 安徽农业科学 , 2009, 37 (13) :5826–5827. |
| [6] | 唐丽, 刘跃, 黄勇, 等. 离体外翻肠囊法研究头花蓼提取物中5个成分的肠吸收特性[J]. 中国药理学通报 , 2014, 30 (7) :1031–1032. |
| [7] | Lv A J, Yang Z X, Liu H R, et al. Isolation of intestinal bacteria from zebrafish(Danio rerio) and their physiological and biochemical characteristics[J]. Chin Agric Sci Bull , 2010, 26 (24) :412–415. |
| [8] | Russell J, Desmond O, Jose M, et al. Accelerated throughput metabolic route screening in early drug discovery using high-resolution liquid chromatography/quadrupole time-of-flight mass spectrometry and automated data analysis[J]. Rapid Commun Mass Spectrom , 2005, 19 (18) :2659–2670. DOI:10.1002/(ISSN)1097-0231 |
| [9] | Tiller P R, Yu S, Bateman K P, et al. Fractional mass filtering as a means to assess circulating metabolites in early human clinical studies[J]. Rapid Commun Mass Spectrom , 2008, 22 (22) :3510–3516. DOI:10.1002/rcm.3758 |
| [10] | Lekha S. The use of mass defect in modern mass spectrometry[J]. J Mass Spectrom , 2012, 47 (2) :226–236. DOI:10.1002/jms.2953 |
 2016, Vol. 47
2016, Vol. 47


