药对是中医临床遣药组方常用的配伍形式,是历代医家积累临床用药经验的升华。药对是连接单味中药与若干方剂之间的桥梁,是方剂配伍的精华与核心所在,具备了方剂的基本主治功能,体现了方剂的整体疗效[1]。丹参-红花Salviae Miltiorrhizae Radix(Danshen)-Carthami Flos(Honghua)是著名的活血药对,丹参通血络,散郁结;红花通经络、化瘀血。二药皆入心、肝经,两药合用共奏活血化瘀、通脉疏络、安神宁心之功[2]。丹参与红花配伍后的提取物在临床上被广泛用于治疗心脑血管疾病[3],已被开发成20多种中成药,其中丹参-红花注射液年销售额已超40亿。张荣等[4]考察了含丹参-红花药对的复方2 477方,丹参、红花配伍比例1:1者占20.8%,2:1者占45.8%,3:1者占31.2%,其他占2.2%。
药对化学成分规律的研究对于揭示方剂配伍规律及其临床应用的合理性提供了科学依据[5]。丹参为唇形科(Labiatae)鼠尾草属Salvia L.植物丹参Salvia miltrorrhiza Bge.的干燥根及根茎,其有效成分有2类,以丹酚酸B为代表的丹酚酸类成分以及以丹参酮ⅡA为代表的丹参酮类成分[6]。红花为菊科(Compositae)植物红花Carthamus tinctorius L.的干燥花,其活性成分主要为以羟基红花黄色素A为代表的查耳酮类成分和黄酮类成分[7]。目前,对丹参-红花配伍研究主要在于检测配伍后丹酚酸类成分量变化[8-9],以及相关药理[10-11]和临床应用[12]的研究,对其配伍后全面的化学成分变化规律研究较少涉及。一直以来对药对配伍前后化学成分的定性、定量分析是中药药效物质基础研究的首要环节[13-14]。因此,丹参-红花配伍化学成分相互作用研究是揭示其配伍机制的重要前提。然而,由于中药物质的复杂性及多味中药的配伍应用,准确与完整鉴定中药化学物质成为一项繁重的任务。尽管已有学者通过查阅文献数据以及对照品比对,鉴定出某些中药及其复方的化学成分[15]。对照品的稀缺性及中药成分结构的难确定性却一直困扰着研究人员。近来,LC-MS通过碰撞能量的差异、特征离子过滤以及能量中性丢失等分析策略鉴定了更多的化学成分[16-17],但是对照品的严重紧缺、检测成本昂贵等,这些方法都还不能广泛及准确地用于鉴定中药的复杂成分。
本研究采用HPLC-PDA法探索性地建立一种中药复杂成分配伍相互作用变化规律研究的思路与方法。丹参与红花中的活性成分都能按照化学结构类型进行分类,每一类化合物具有相同或相似的结构母核,因而具有相似的紫外吸收光谱。运用HPLC-PDA技术,通过建立化学物质库,并引入化学模糊识别策略,将色谱图上分离的色谱峰按照特征紫外吸收谱进行成分结构分类鉴定。本实验以丹参-红花药对为研究对象,并通过对称配比设计,研究其不同制法、不同配比下,不同类型化学成分的动态变化规律,为探索丹参与红花临床配伍应用的科学内涵提供科学依据,也为中药配伍的药效物质基础研究提供新的思路与方法。
1 仪器与试剂美国Waters 2695高效液相色谱系统,Waters 2998 PDA检测器,Empower数据管理系统,Microfuge®16台式离心机(美国Beckman Coulter公司),FW80型高速万能离心机(天津市泰斯特仪器有限公司),YRE-301旋转蒸发仪(巩义市予华仪器有限责任公司),BT125电子天平(德国赛多利斯科学仪器有限公司),EPED超纯水系统(南京易普达易科技发展有限公司)。
丹参样品(批号141201)为唇形科植物丹参Salvia miltrorrhiza Bge.的干燥根及根茎,产自山东地区;红花样品(批号121220)为菊科植物红花Carthamus tinctorius L.的干燥花,产自新疆地区,均由南京中医药大学严辉副教授鉴定。乙腈(Scharlab公司)为色谱纯试剂,甲醇(南京化学试剂有限公司)、甲酸(德国Merck公司)均为分析纯,超纯水(自制)。对照品丹酚酸B(批号111562)、丹参酮ⅡA(批号110766)均购自中国食品药品检定研究院;羟基红花黄色素A,购自四川维克奇有限公司;6-羟基山柰酚-3, 6, 7-三-O-β-D-葡萄糖苷(实验室自制),4个化合物经峰面积归一化处理,质量分数皆大于98%。
2 方法与结果 2.1 对照品溶液的制备分别精密称取干燥至恒定质量的对照品适量,加80%甲醇制成质量浓度分别为172.20 μg/mL丹酚酸B、42.75 μg/mL丹参酮ⅡA、102.52 μg/mL羟基红花黄色素A和85.51 μg/mL 6-羟基山柰酚-3, 6, 7-三-O-β-D-葡萄糖苷的混合对照品储备液,以此作为1号混合对照品溶液。精密吸取1号混合对照品溶液1 mL置2 mL量瓶中,加80%甲醇至刻度,摇匀得2号混合对照品溶液,同法采用逐级稀释法制得3~8号混合对照品溶液,即将对照品母液依次稀释到2、4、8、16、32、64、128倍。各对照品溶液在进样前经12 000 r/min离心10 min。所有的对照品溶液均在4 ℃条件下储藏。
2.2 供试品溶液的制备精密称取不同比例的丹参-红花药材(1:0、5:1、5:2、2:1、1:1、1:2、2:5、1:5、0:1)干燥粉末(过40目筛)1.0 g。对丹参-红花药对不同配比混合药材分别进行热回流水提取、热回流50%甲醇提取和热回流甲醇提取。加30 mL提取溶剂,回流提取1 h,放冷,补足质量。精密取上清液20 mL于圆底烧瓶中,浓缩至10 mL。取浓缩液,经12 000 r/min离心10 min,取离心后的上清液作为供试品溶液。各供试品溶液平行制备6份,得各供试液A系列。由于丹参-红花中同一类成分量相差甚大,基于线性考虑,故将各供试液A系列稀释10倍,得各供试液B系列,以保证其在线性范围内。
2.3 色谱条件采用Apollo C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-0.5%甲酸水溶液(B);体积流量1 mL/min;柱温为35 ℃;丹酚酸类、丹参酮类、查耳酮类以及黄酮类成分的检测波长依次为280、270、350、403 nm;梯度洗脱条件为0~15 min,2%~10% A;15~20 min,10%~17% A;20~52 min,17%~28% A;52~58 min,28%~30% A;58~63 min,30%~40% A;63~70 min,40%~90% A;70~78 min,90% A;78~80 min,90%~2% A;进样量为10 μL。
2.4 峰的选择与数据处理在本实验中,具有一定响应强度的丹酚酸类、丹参酮类、醌式查耳酮类、黄酮类成分的峰被选择作为检测对象用来检测并分析化合物间相互作用。丹参中,被检测化合物峰的峰面积应大于33 000;红花中,被检测化合物峰的峰面积应大于26 000。
2.5 定量分析丹参、红花中4类化合物的定量分析选择HPLC-PDA联用方法,采用紫外定量分析。以相应类型化合物对照品做标准曲线,同一类型化合物的定量均用同一个对照品的标准曲线进行定量分析。
2.6 方法学考察2.6.1线性关系、检测限(LOD)与定量限(LOQ)考察配制丹酚酸B、丹参酮ⅡA、羟基红花黄色素A、6-羟基山柰酚-3, 6, 7-三-O-b-D-葡萄糖苷质量浓度分别为172.24、42.75、102.52、85.51 μg/mL的混合对照品溶液,逐级稀释为2、4、8、16、32、64、128倍,配制成系列对照品溶液。分别精密吸取各混合对照品溶液10 μL注入HPLC,按“2.3”项下色谱条件测定相应峰面积。以峰面积为纵坐标(Y),以待测成分质量浓度为横坐标(X),进行线性回归,得到4个对照品的标准曲线,丹酚酸B的回归方程为Y=23 248 371.58 X+7 137.65,R2=0.999 9,线性范围1.34~172.00 μg;丹参酮ⅡA的回归方程为Y=112 609 539.40 X+5 905.14,R2=0.999 4,线性范围0.33~42.75 μg;羟基红花黄色素A的回归方程为Y=55 016 130.27 X+1 298.02,R2=0.999 9,线性范围为0.40~102.50 μg;6-羟基山柰酚-3, 6, 7-三-O-b-D-葡萄糖苷的回归方程为Y=78 346 457.78 X+6 213.36,R2=0.999 5,线性范围0.33~85.55 μg。4个对照品的色谱图见图 1。
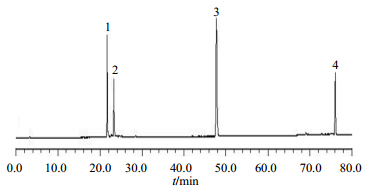
|
1-羟基红花黄色素A 2-6-羟基山柰酚-3, 6, 7-三-O-β-D-葡萄糖苷3-丹酚酸B 4-丹参酮ⅡA 1-hydroxysafflor yellow A 2-6-hydroxykaempferol-3, 6, 7-tri-O-β-D-glucoside 3-salvianolic acid B 4-tanshinone ⅡA 图 1 对照品的色谱图 Fig.1 Chromatogram of four reference substances |
2.6.2 精密度试验
取1号混合对照品溶液,按“2.3”项下色谱条件检测,分别于1 d内重复进样6次和连续3 d内重复进样3次,每次进样10 μL,测定各对照品的峰面积,以各峰面积计算日内及日间精密度。日内精密度评价中,丹酚酸B、丹参酮ⅡA、羟基红花黄色素A和6-羟基山柰酚-3, 6, 7-三-O-β-D-葡萄糖苷峰面积的RSD分别为0.56%、1.81%、0.89%和0.44%;日间精密度评价中,丹酚酸B、丹参酮ⅡA、羟基红花黄色素A和6-羟基山柰酚-3, 6, 7-三-O-β-D-葡萄糖苷峰面积的RSD依次为3.77%、4.54%、5.44%和5.07%。日内精密度和日间精密度的实验结果表明,仪器的精密度良好。
2.6.3 重复性试验取丹参-红花(1:1)样品制备50%甲醇水的供试品溶液按照“2.2”项制备方法下平行制备6份供试品,分别进样10 μL,在相同的色谱条件下检测,以样品中各对照品成分的量来计算其重复性。丹酚酸B、丹参酮ⅡA、羟基红花黄色素A和6-羟基山柰酚-3, 6, 7-三-O-β-D-葡萄糖苷质量分数的RSD分别为0.79%、1.88%、2.99%和2.85%,表明该方法的重复性良好。
2.6.4 稳定性试验取丹参-红花(1:1)的水提、50%甲醇水提、甲醇提的供试溶液分别于0、2、4、6、8、12、16、20 h时进样,以4个对照品的峰面积考察其稳定性,以其RSD来表示其变异。丹酚酸B在不同制法(水提、甲醇-水提和甲醇提)中峰面积的RSD分别为3.75%、0.12%和1.07%;丹参酮ⅡA在甲醇-水提和甲醇提制法下峰面积的RSD分别为0.38%和3.66%;羟基红花黄色素A在不同制法下(水提、甲醇-水提和甲醇提)峰面积的RSD分别为4.01%、0.91%和1.57%;6-羟基山柰酚-3, 6, 7-三-O-β-D-葡萄糖苷在不同制法下(水提、甲醇-水提和甲醇提)峰面积的RSD分别为3.27%、1.90%和2.98%。结果表明不同制法下的供试品溶液在20 h内皆稳定。
2.6.5 加样回收率试验取已测定的丹参-红花(1:1)的样品粉末9份,约1 g,精密称定,分别按已测成分量的50%、100%、150% 3个水平加入丹酚酸B、丹参酮ⅡA、羟基红花黄色素A、6-羟基山柰酚-3, 6, 7-三-O-b-D-葡萄糖苷对照品。按“2.2”项下操作,在“2.3”项下色谱条件进样测定,计算其回收率。结果显示,丹酚酸B、丹参酮ⅡA、羟基红花黄色素A和6-羟基山柰酚-3, 6, 7-三-O-β-D-葡萄糖苷的平均回收率分别为98.01%、94.89%、95.63%和97.06%,RSD分别为0.77%、1.65%、1.34%和2.56%。
2.7 样品测定精密吸取样品溶液10 μL,注入高效液相色谱仪,结合4类化合物的特征紫外光谱,采用化学模糊识别策略对丹参-红花中4类成分进行半定量分析,见图 2。由于丹参经水提后,丹参酮类成分响应很低,故在丹参的水提物中,丹参酮类成分的溶出度不作考虑。如图 2-A所示,在丹参-红花(1:1)水提物中,经化学模糊识别[16]鉴定出47个成分。其中,丹酚酸类成分15个(化合物3、5、9、17、22、29、31、35、36、37、42、43、44、45和47),醌式查耳酮类成分20个(化合物1、4、6、11、14、15、18、21、23、24、25、27、30、33、34、38、39、40、41和46),黄酮类成分12个(化合物2、7、8、10、12、13、16、19、20、26、28和32)。丹参-红花经50%甲醇水提后,所测的4类物质在HPLC-PDA上皆有较好的响应值。如图 2-B所示,在丹参-红花(1:1)50%甲醇水提物中,共鉴定出57个成分。其中,丹酚酸类成分16个(化合物3、5、10、18、28、33、34、39、40、41、42、43、44、45、47、49,丹参酮类成分8个(化合物50、51、52、53、54、55、56、57),醌式查耳酮类成分22个(化合物1、4、6、8、9、12、14、17、20、22、23、25、27、29、31、32、35、36、37、38、46和48),黄酮类成分11个(化合物2、7、11、13、15、16、19、21、24、26和30)。由于甲醇具有较好的溶解能力,4类物质在分析液相上都有较高的响应。如图 2-C所示,在丹参-红花(1:1)的甲醇提取物中,共鉴定出43个成分。其中,丹酚酸类成分12个(1、6、11、20、25、26、28、29、30、31、32和35),丹参酮类成分8个(化合物36、37、38、39、40、41、42和43),醌式查耳酮类成分14个(化合物3、4、5、14、15、16、17、19、21、23、24、27、33和34),黄酮类成分9个(化合物2、7、8、9、10、12、13、18和22)。
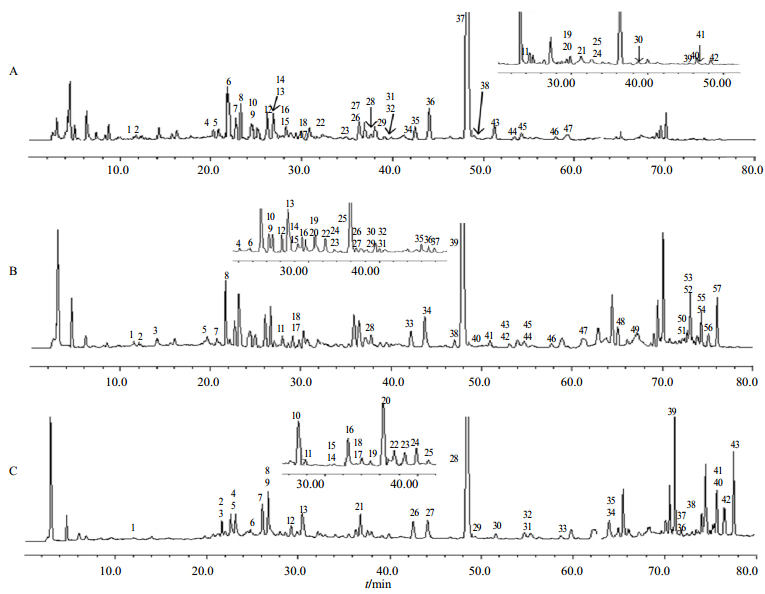
|
A: 6-羟基红花黄色素A 9-6-羟基山柰酚-3, 6, 7-三-O-β-D-葡萄糖苷37-丹酚酸B;B: 8-羟基红花黄色素A 11-6-羟基山柰酚-3, 6, 7-三-O-β-D-葡萄糖苷39-丹酚酸B 57-丹参酮ⅡA;C: 4-羟基红花黄色素A 7-6-羟基山柰酚-3, 6, 7-三-O-β-D-葡萄糖苷28-丹酚酸B 43-丹参酮ⅡA A: 6-hydroxysafflor yellow A 9-6-hydroxykaempferol-3, 6, 7-tri-O-β-D-glucoside 37-salvianolic acid B; B: 8-hydroxysafflor yellow A 11-6-hydroxykaempferol-3, 6, 7-tri-O-β-D-glucoside 39-salvianolic acid B 57-tanshinone ⅡA; C: 4-hydroxysafflor yellow A 7-6-hydroxykaempferol-3, 6, 7-tri-O-β-D-glucoside 28-salvianolic acid B 43-tanshinone ⅡA 图 2 丹参与红花(1:1)配伍水提液(A)、甲醇水提液(B)和甲醇提液(C)的色谱图 Fig.2 Chromatograms of mixed extracts of Danshen-Honghua (1:1) in preparation of water (A), methanol-water (B), and methanol (C) |
2.8 丹参-红花不同比例、不同制法提取物的相对溶出度的比较 2.8.1 不同比例丹参-红花水提物的相对溶出度
丹酚酸类、醌式查耳酮类以及黄酮类成分的相对溶出度的顺序依次为5:1>5:2>2:1>1:0>2:5>1:1>1:5>1:2;1:5>5:2>0:1>2:5>2:1>5:1>1:2>1:1;5:2>1:5>0:1>2:5>1:2>1:1>2:1>5:1,3类成分相对溶出度的最优比例依次为5:1、1:5和5:2。所测3类物质总的相对溶出度最高的比例为5:2,而总的相对溶出度最低的比例为1:2。
2.8.2 不同比例丹参-红花50%甲醇水提物的相对溶出度丹酚酸类、丹参酮类、醌式查耳酮类和黄酮类成分的相对溶出度顺序依次为5:1>5:2>1:0>1:1>2:1>2:5>1:5>1:2>0:1;5:1>1:0>5:2>2:5>2:1>1:5>1:1>1:2>0:1;5:2>1:5>0:1>2:5>2:1>5:1>1:1>1:2>1:0;5:2>1:5>0:1>2:5>5:1>2:1≈1:2>1>1:0:1,4类成分相对溶出度的最优比例依次为5:1、5:1、5:2和5:2。所测4类物质总的相对溶出度最高的比例为5:2,而总的相对溶出度最低的比例为1:2。
2.8.3 不同比例丹参-红花甲醇提物的相对溶出度丹酚酸类、丹参酮类、醌式查耳酮类和黄酮类成分的相对溶出度顺序依次为5:1>5:2≈1:0>2:1>2:5>1:1>1:5>1:2>0:1;1:2>5:1>1:0>2:5>5:2≈1:1>2:1>1:5>0:1;1:5>0:1>2:5>1:1>5:2≈1:2>2:1>5:1>1:0;1:5>0:1>2:5>1:2>1:1>5:2>2:1>5:1>1:0,4类成分相对溶出度的最优比例依次为5:1、1:2、1:5和1:5。所测4类物质总的相对溶出度最高的比例为5:2,而相对溶出度最低的比例为1:2。
2.8.4 丹参-红花不同制法提取物的相对溶出度的比较在同一比例下,丹酚酸类、丹参酮类、醌式查耳酮类、黄酮类成分在不同制法中的相对溶出度顺序分别为50%甲醇水提>水提>甲醇提;甲醇提>50%甲醇水提;50%甲醇水提>水提>甲醇提;50%甲醇水提>水提>甲醇提。丹参-红花不同制法下,除了丹参酮类成分,其他3类成分在50%甲醇-水制法下的相对溶出度,均明显高于相同丹参-红花比例下水提与甲醇提的相对溶出度。丹参-红花水提液、丹参-红花50%甲醇水提液以及甲醇提液中,所测成分总的相对溶出度的优化范围皆为5:1~5:2,总的相对溶出度的最高比例皆为5:2。
3 讨论 3.1 化学模糊识别策略本研究所提出的化学模糊识别策略包括3个步骤。首先,根据相关文献建立丹参中丹酚酸类、丹参酮类以及红花中的醌式查耳酮类、黄酮类的化学物质库。该化学物质库包含化合物名称、结构式、分子式、相对分子质量和紫外信息。在该实验中,分别建立了丹参和红花中的4类物质的化学物质库。其次,选择丹参、红花单味药及等比配伍药材提取液进样,在全波长扫描图谱中根据保留时间下相对应的紫外信息找到对照品峰。对照品的选择是根据其在药材中的相应量,选择药材中不同类型化合物中量较高的已知化合物作为对照品。由于同一类物质的紫外光谱特征相似,这些对照品的紫外信息将为其他化合物的归类提供依据。第三,根据建立的丹参、红花化学库,在全波长扫描图谱中按照保留时间,将化合物的紫外信息与对照品的紫外信息比较,可将化合物的基本母核而非确切的化合物结构确定,并归为不同类化合物,每一类都具有相同的母核。
3.2 实验设计 3.2.1 采用半对称多配比设计制备配伍样品本研究以丹参-红花作为研究对象,结合《中国药典》2015年版规定剂量范围(丹参10~15 g;红花3~10 g)趋于半对称配比设计,共设置了9个不同丹参-红花配比(1:0、5:1、5:2、2:1、1:1、1:2、2:5、1:5、0:1)。与单一配伍相比,更能全面地反映丹参、红花配伍后,其成分相互作用的变化规律,从而为中医临床用药的合理性与科学性提供参考依据。
3.2.2 基于化学物质库对样品中化学成分采用化学模糊识别策略进行结构分类归属通过查阅相关文献资料并结合实验室已分离得到的化合物结构信息,对丹参和红花中主要化学成分的名称、结构、分子式、相对分子质量、光谱信息进行了整理,形成了化学物质库,HPLC-PDA获得的色谱峰的光谱信息基于化学物质库分别进行了化学归类识别。这种基于化学模糊识别策略的成分归类鉴别避免了中药复杂成分鉴定中对照品稀缺、鉴定步骤复杂、难以全面而准确鉴定结构等缺点,同时又能满足中药复杂成分配伍相互作用变化规律研究的要求,体现了中医药的模糊与整体观。
3.3 提取方法的优化在本实验中,为获得较好的提取方法以研究丹参与红花复杂成分配伍相互作用,分别对不同制法下的提取方法、提取时间及溶剂用量进行了考察。对于提取方法,考察了回流和超声2种提取方法,结果显示2种提取方法峰的数量上相似,而回流提取的药液中所含成分整体较高,因此选择回流提取。为优化提取过程,进一步对提取溶剂用量、回流提取时间进行了考察。结果显示,加30 mL溶剂回流提取1 h为最佳提取程序。
3.4 色谱条件的优化为了在较短时间内使相邻色谱峰得到较好的分离,对色谱条件进行了优化。首先对Apollo C18色谱柱(250 mm×4.6 mm,5 μm)和Hypersil ODS2色谱柱(250 mm×4.6 mm,5 μm)进行了选择与优化。经过比较,发现前者具有较好的分离能力,且峰型更好。因而实验中选用了Apollo C18色谱柱(250 mm×4.6 mm,5 μm)。鉴于丹参-红花中同一类物质的化学性质相似,选择了分离能力强的乙腈-水作为溶剂系统。由于4类物质都偏酸性,故需在水相中加入一定量甲酸,进一步考察了甲酸的加入量,柱温和体积流量。结果显示,Thermo C18色谱柱,乙腈-0.5%酸水为流动相,柱温35 ℃,体积流量1 mL/min时,样品在80 min内能得到很好的分离。
3.5 PDA检测条件的优化基于4类物质均具有较好的紫外响应强度,故选择PDA检测,同时优化了4类物质的检测波长。在190~500 nm内,丹酚酸类、丹参酮类、查耳酮类和黄酮类物质依次在280、270、350、403 nm分别有较好的响应强度。故选择280、270、350、403 nm依次做为4类物质的检测波长。
3.6 化学库的建立实验前期,根据1934年至今的文献,分别建立了丹参、红花中4类物质的化学物质库。化学库包括以下信息:化合物名称、结构、相对分子质量、分子式和紫外信息。在化学物质库中,化合物按照基本结构类型归类。丹参化学物质库中收集了27个丹酚酸类化合物,42个丹参酮类化合物;红花化学物质库中收集了17个查耳酮类化合物和23个黄酮类物质。
3.7 化合物归属基于已建化学物质库,丹酚酸类成分在203、280、310和330 nm附近有特征吸收;丹参酮类成分在220、250、270、350、450 nm附近有特征吸收;查耳酮类成分在240、340、403 nm附近有特征吸收;黄酮类成分在240、270、350 nm附近有特征吸收。这些化合物紫外光谱的特征吸收是配伍后丹参-红花中4类化合物的鉴别依据,将不同制法、不同配比下的丹参-红花中4类物质分别进行了化合物结构归属。
| [1] | 唐于平, 束晓云, 李伟霞, 等. 药对研究(I)——药对的形成与发展[J]. 中国中药杂志 , 2013, 38 (24) :4185–4190. |
| [2] | 高丽娜, 崔元璐, 延阔, 等. 丹参红花配伍研究进展[J]. 中草药 , 2016, 47 (4) :671–679. |
| [3] | 中国药典[S].一部. 2015. |
| [4] | 张荣, 王涛, 陈建龙. HPLC法研究不同配伍比例下红花丹参药材中丹参素钠溶出度的影响[J]. 世界中西医结合杂志 , 2009, 4 (5) :324–326. |
| [5] | 李伟霞, 唐于平, 刘立, 等. 药对研究(Ⅲ)——药对的功效物质基础[J]. 中国中药杂志 , 2013, 38 (24) :4196–4202. |
| [6] | Su C Y, Ming Q L, Rahman K, et al. Salvia miltiorrhiza:Traditional medicinal uses, chemistry, and pharmacology[J]. Chin J Nat Med , 2015, 13 (3) :163–182. |
| [7] | Asgarpanah J, Kazemivash N. Phytochemistry, pharmacology and medicinal properties of Carthamus tinctorius L[J]. Chin J Integr Med , 2013, 19 (2) :153–159. DOI:10.1007/s11655-013-1354-5 |
| [8] | 沈飞, 宿树兰, 江曙, 等. 丹红注射液生产过程中丹参固体废弃物的资源性成分分析及其转化机制研究[J]. 中草药 , 2015, 46 (16) :2471–2476. |
| [9] | Liu X S, Wu Z Z, Yang K, et al. Quantitative analysis combined with chromatographic fingerprint for comprehensive evaluation of Danhong injection using HPLC-DAD[J]. J Pharma Biomed , 2013, 76 :70–74. DOI:10.1016/j.jpba.2012.12.013 |
| [10] | He Y, Wan H T, Du Y G, et al. Protective effect of Danhong injection on cerebral ischemia-reperfusion injury in rats[J]. J Ethnopharmacol , 2012, 144 (2) :387–394. DOI:10.1016/j.jep.2012.09.025 |
| [11] | 刘剑刚, 张大武, 李婕, 等. 丹参、红花水溶性组分及配伍对大鼠心肌缺血/再灌注损伤作用的实验研究[J]. 中国中药杂志 , 2011, 36 (2) :189–194. |
| [12] | Sun M, Zhang J J, Shan J Z, et al. Clinical observation of Danhong Injection(herbal TCM product from Radix Salviae miltiorrhizae and Flos Carthami tinctorii) in the treatment of traumatic intracranial hematoma[J]. Phytomedicine , 2009, 16 (8) :683–689. DOI:10.1016/j.phymed.2009.03.020 |
| [13] | 齐瑶, 皮子凤, 宋凤瑞, 等. 制川乌与川贝母、浙贝母配伍前后化学成分的变化研究[J]. 中草药 , 2011, 42 (12) :2438–2441. |
| [14] | 董欣, 王淑敏, 祝恩智, 等. 乌头属中药及其炮制品与浙贝母、川贝母配伍的化学研究[J]. 中草药 , 2012, 43 (2) :265–269. |
| [15] | Guo J M, Shang E X, Duan J A, et al. Fast and automated characterization of major constituents in rat biofluid after oral administration of Abelmoschus manihot extract using ultra-performance liquid chromatography/quadrupole time-of-flight mass spectrometry and metaboLynx[J]. Rapid Commun Mass Spectrom , 2010, 24 (4) :443–453. DOI:10.1002/rcm.v24:4 |
| [16] | Shen J, Mo X, Tang Y P, et al. Analysis of herb-herb interaction when decocting together by using ultra-high-performance-liquid chromatography-tandem mass spectrometry and fuzzy chemical identification strategy with poly-proportion design[J]. J Chromatogr A , 2013, 1297 :168–178. DOI:10.1016/j.chroma.2013.05.001 |
| [17] | 周思思, 马增春, 梁乾德, 等. 基于UPLC/Q-TOF-MS分析附子半夏配伍相反的物质基础[J]. 化学学报 , 2012, 70 (3) :284–290. |
 2016, Vol. 47
2016, Vol. 47


