2. 黑龙江中医药大学 中药资源与开发教研室, 黑龙江 哈尔滨 150040 ;
3. 黑龙江食品药品检验检测所, 黑龙江 哈尔滨 150001
2. Department of Resources and Development of Chinese Materia Medica, Heilongjiang University of Chinese Medicine, Harbin 150040, China ;
3. Heilongjiang Institute for Food and Drug Control, Harbin 150001, China
东北岩高兰Empetrum nigrum L. var. japonicumK. Koch为岩高兰科(Empetraceae)岩高兰属Empetrum L.植物。全科有3属9种,本属共6种,分布于北温带及北极地区。在中国仅有1变种,数量极少,仅分布于中国的大兴安岭亚高山地带,是国家重点保护的珍稀植物。黑龙江省东北岩高兰资源分布面积达13 000 hm2,年生长量32 t [1-5]。据记载其有利尿、抗坏血病、预防和治疗酒精性肝病、治疗冠心病及心肌炎等功效[6]。关于东北岩高兰的各方面报道很罕见,张玉莲等[7]对东北岩高兰化学成分进行研究,从东北岩高兰95%乙醇提取物中分离得到12个化合物。为了合理开发及保护该药用资源,明确其药效物质基础,本课题组前期对东北岩高兰进行了生药学、药理学相关研究,结果表明东北岩高兰中所含主要化学成分为黄酮类、酚醛树脂类和酚类,并对大鼠酒精性脂肪肝(ALF)有良好的抑制作用[8-9]。本实验在此基础上对东北岩高兰醋酸乙酯部位化学成分和其对大鼠ALF的作用进行研究,从东北岩高兰70%乙醇提取物的醋酸乙酯部位中分离得到8个化合物,分别鉴定为β-谷甾醇(β-sitosterol,1)、熊果酸(ursolic acid,2)、乌苏醇(uvaol,3)、2′, 4′-二羟基二氢查耳酮(2′, 4′-dihydroxy dihydrochalcone,4)、2′, 4′-二羟基查耳酮(2′, 4′-dihydroxy chalcone,5)、7-羟基二氢黄酮(7-hydroxy flavone,6)、4′-甲氧基-2′-羟基二氢查耳酮(4′-methoxy-2′-hydroxyl-dihydroxy chalcone,7)、4, 2′, 4′-三羟基查耳酮(isoliquiritigenin,8)。其中化合物1~4、6~8为首次从东北岩高兰中分离得到。药理研究表明东北岩高兰醋酸乙酯部位能够减轻ALF的损伤程度,具有保肝作用。
1 仪器与材料INOVA-600型超导核磁共振光谱(美国Variran公司);60型薄层色谱硅胶G(青岛海洋化工厂),柱色谱硅胶(200~300目、80~100目,青岛海洋化工厂分厂),GE Sephadex-LH20(General Electric公司);化学试剂为分析纯(天津市富宇精细化工股份有限公司)。60°红星二锅头酒(北京红星股份有限公司),生理盐水(哈药三联药业有限公司),乌拉坦(上海山浦化工有限公司),甲醛溶液(哈尔滨市新春化工产品有限公司),三酰甘油(TG)、总胆固醇(TC)、总蛋白(TP)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(中生北控生物科技股份有限公司、南京建成生物工程研究所);SECOMAN BASIC半自动生化分析仪(法国SECOMAN公司)。
东北岩高兰药材采集于大兴安岭地区。经黑龙江中医药大学中药资源与开发教研室王振月教授鉴定为东北岩高兰Empetrum nigrum L. var. japonicum K. Koch。
实验动物为健康雄性的SD大鼠,动物许可证号SCXK黑2013004,体质量(200±20)g,由黑龙江中医药大学GLP实验中心提供。
2 提取与分离干燥的东北岩高兰地上部分3.5 kg,粉碎,用12倍的70%乙醇回流提取3次,每次2.5 h,减压回收溶剂,得浸膏1.45 kg。浸膏加适量蒸馏水水分散,依次用醋酸乙酯、水饱和正丁醇萃取。
取醋酸乙酯部分300 g,经硅胶柱色谱,二氯甲烷-甲醇(100:0,100:1,50:1,30:1,10:1,5:1,1:1,0:1)梯度洗脱,得到7个流分Fr. 1~7。Fr. 5(13.4 g)、Fr. 6(5 g)分别经过硅胶柱色谱得到化合物1(325 mg)、2(200 mg)。Fr. 4(47 g)经硅胶柱色谱,以二氯甲烷-甲醇(50:1,30:1,20:1,10:1)梯度洗脱得到4个流分(Fr. 4.1~4.4),其中Fr. 4.1经反复硅胶柱色谱得到化合物5(75 mg),Fr. 4.2再经反复硅胶柱色谱、以及凝胶Sephadex LH-20色谱分离纯化得化合物3(300 mg)、7(140 mg)、8(20 mg),Fr. 4.3经反复硅胶柱色谱得到化合物6(150 mg)。Fr. 2经过正相硅胶柱色谱,并利用ODS、制备型HPLC纯化得到化合物4(425 mg)。
3 结构鉴定化合物1:白色粉末(CHCl3),mp 137~139 ℃。1H-NMR (600 MHz, CDCl3) δ: 3.55 (1H, brs, H-3), 5.36 (1H, d, J=5.4 Hz, H-6), 0.74 (3H, s, H-18), 1.11 (3H, s, H-21), 1.03 (3H, d, J=4.8 Hz, H-29);13C-NMR (150 MHz, CDCl3) δ: 39.9 (C-1), 32.1 (C-2), 72.0 (C-3), 42.5 (C-4), 140.9 (C-5), 121.9 (C-6), 32.1 (C-7), 32.1 (C-8), 51.1 (C-9), 37.4 (C-10), 21.2 (C-11), 39.9 (C-12), 42.5 (C-13), 56.9 (C-14), 24.5 (C-15), 28.4 (C-16), 56.9 (C-17), 12.0 (C-18), 20.0 (C-19), 37.4 (C-20), 19.2 (C-21), 34.1 (C-22), 24.5 (C-23), 42.9 (C-24), 29.3 (C-25), 20.0 (C-26), 19.2 (C-27), 23.2 (C-28), 12.0 (C-29)。以上数据与文献报道一致[10],故鉴定化合物1为β-谷甾醇。
化合物2:白色粉末(MeOH),mp 260~262 ℃。1H-NMR (600 MHz, CDCl3) δ: 5.12 (1H, m, H-12), 3.21 (1H, m, H-3), 0.92 (3H, d, J=7.8 Hz, H-30), 0.79 (3H, d, J=6.5 Hz, H-29), 0.97, 0.92, 0.86, 0.79, 0.71 (15H, s, CH3×5);13C-NMR (150 MHz, CDCl3) δ: 38.9 (C-1), 28.4 (C-2), 77.9 (C-3), 39.1 (C-4), 55.6 (C-5), 18.6 (C-6), 33.3 (C-7), 39.7 (C-8), 47.8 (C-9), 37.1 (C-10), 23.7 (C-11), 125.4 (C-12), 139.0 (C-13), 42.3 (C-14), 28.6 (C-15), 24.7 (C-16), 47.8 (C-17), 53.3 (C-18), 39.3 (C-19), 39.2 (C-20), 30.8 (C-21), 37.2 (C-22), 28.6 (C-23), 16.3 (C-24), 15.4 (C-25), 17.3 (C-26), 23.4 (C-27), 179.7 (C-28), 17.2 (C-29), 21.2 (C-30)。以上数据与文献报道一致[11],故鉴定化合物2为熊果酸。
化合物3:白色粉末(MeOH),mp 230~232 ℃。1H-NMR (600 MHz, CDCl3) δ: 5.13 (1H, brs, H-12), 3.52 (1H, d, J=10.0 Hz, H-3), 3.19 (1H, d, J=10.0 Hz, H-3), 0.97, 0.92, 0.86, 0.79, 0.71 (15H, s, CH3×5);13C-NMR (150 MHz, CDCl3) δ: 38.9 (C-1), 26.2 (C-2), 79.2 (C-3), 38.1 (C-4), 55.3 (C-5), 18.5 (C-6), 32.9 (C-7), 40.1 (C-8), 47.8 (C-9), 38.9 (C-10), 23.5 (C-11), 125.2 (C-12), 138.8 (C-13), 42.2 (C-14), 28.3 (C-15), 23.5 (C-16), 35.3 (C-17), 54.2 (C-18), 39.6 (C-19), 39.5 (C-20), 37.0 (C-21), 30.8 (C-22), 27.4 (C-23), 15.8 (C-24), 15.8 (C-25), 16.9 (C-26), 23.4 (C-27), 70.1 (C-28), 17.5 (C-29), 21.5 (C-30)。以上数据与文献报道一致[12],故鉴定化合物3为乌苏醇。
化合物4:白色粉末(CHCl3)。1H-NMR (600 MHz, CDCl3) δ: 7.62 (1H, d, J=12.0 Hz, H-6′), 7.30 (2H, m, H-3, 5), 7.23 (2H, m, H-2, 6), 7.20 (1H, m, H-4), 6.38 (1H, brs, H-3′), 6.36 (1H, d, J=6.0 Hz, H-5′), 3.23 (2H, t, J=6.0 Hz, H-α), 3.04 (2H, t, J=6.0 Hz, H-β);13C-NMR (150 MHz, CDCl3) δ: 140.7 (C-1), 128.4 (C-2), 128.6 (C-3), 126.3 (C-4), 128.6 (C-5), 128.4 (C-6), 39.7 (C-α), 30.4 (C-β), 203.7 (C=O), 113.7 (C-1′), 162.8 (C-2′), 103.5 (C-3′), 165.1 (C-4′), 107.9 (C-5′), 132.2 (C-6′)。以上数据与文献报道一致[13],故鉴定化合物4为2′, 4′-二羟基二氢查耳酮。
化合物5:黄色晶体(CH3OH),mp 149~150 ℃。1H-NMR (600 MHz, CD3OD) δ: 7.91 (1H, d, J=6.0 Hz, H-6′), 7.77 (1H, d, J=12.0 Hz, H-β), 7.66 (1H, d, J=12.0 Hz, H-α), 7.72 (2H, m, H-3, 5), 7.37 (3H, m, H-2, 4, 6), 6.41 (1H, dd, J=2.1, 6.0 Hz, H-5′), 6.31 (1H, d, J=6.0 Hz, H-3′);13C-NMR (150 MHz, CD3OD) δ: 136.2 (C-1), 130.0 (C-2), 129.6 (C-3), 131.5 (C-4), 129.6 (C-5), 130.0 (C-6), 121.7 (C-α), 145.1 (C-β), 193.2 (C=O), 114.6 (C-1′), 167.5 (C-2′), 103.8 (C-3′), 166.5 (C-4′), 109.3 (C-5′), 133.5 (C-6′)。以上数据与文献报道一致[14],故鉴定化合物5为2′, 4′-二羟基查耳酮。
化合物6:白色晶体(DMSO),mp 184 ℃。1H-NMR (600 MHz, DMSO-d6) δ: 7.66 (1H, d, J=8.5 Hz, H-5), 6.53 (1H, dd, J=2.5, 2.0 Hz, H-6), 6.38 (1H, d, J=2.0 Hz, H-8), 5.59 (1H, dd, J=12.5, 2.5 Hz, H-2), 3.12 (1H, dd, J=17.0, 7.5 Hz, H-3), 2.73 (1H, dd, J=17.0, 3.0 Hz, H-3), 7.51 (5H, m, H-1′, 5′);13C-NMR (150 MHz, DMSO-d6) δ: 79.5 (C-2), 43.8 (C-3), 190.1 (C-4), 128.9 (C-5), 111.3 (C-6), 165.2 (C-7), 103.1 (C-8), 163.5 (C-9), 114.1 (C-10), 139.6 (C-1′), 128.9 (C-2′), 127.0 (C-3′), 129.0 (C-4′), 127.0 (C-5′), 128.9 (C-6′)。以上数据与文献报道一致[15],故鉴定化合物6为7-羟基二氢黄酮。
化合物7:白色晶体(MeOH)。1H-NMR (600 MHz, CD3OD) δ: 7.65 (1H, d, J=8.5 Hz, H-6′), 7.25 (2H, m, H-3, 5), 7.20 (2H, m, H-2, 6), 7.15 (1H, m, H-4), 6.48 (1H, d, J=2.0 Hz, H-3′), 6.43 (1H, dd, J=5.0, 6.0 Hz, H-5′), 3.23 (2H, t, J=6.0, H-α), 2.93 (2H, t, J=12.0 Hz, H-β);13C-NMR (150 MHz, MeOD) δ: 141.7 (C-1), 127.9 (C-2), 128.0 (C-3), 125.5 (C-4), 128.0 (C-5), 127.9 (C-6), 44.9 (C-α), 30.6 (C-β), 200.4 (C=O), 119.1 (C-1′), 161.6 (C-2′), 98.5 (C-3′), 163.5 (C-4′), 107.6 (C-5′), 132.3 (C-6′)。以上数据与文献报道一致[15],故鉴定化合物7为4′-甲氧基-2′-羟基二氢查耳酮。
化合物8:黄色晶体(MeOH),mp 195~197 ℃。1H-NMR (600 MHz, CD3OD) δ: 8.05 (1H, d, J=8.0 Hz, H-6′), 7.70 (2H, d, J=8.0 Hz, H-2, 6), 6.93 (2H, d, J=8.0 Hz, H-3, 5), 7.86 (1H, d, J=16.0 Hz, H-β), 7.69 (1H, d, J=16.0 Hz, H-α), 6.38 (1H, d, J=2.5 Hz, H-3′), 6.50 (1H, dd, J=2.0, 8.5 Hz, H-5′);13C-NMR (150 MHz, CD3OD) δ: 128.2 (C-1), 132.1 (C-2), 117.2 (C-3), 161.9 (C-4), 117.2 (C-5), 132.1 (C-6), 118.7 (C-α), 145.9 (C-β), 193.9 (C=O), 115.0 (C-1′), 167.9 (C-2′), 104.1 (C-3′), 166.7 (C-4′), 109.4 (C-5′), 133.7 (C-6′)。以上数据与文献报道一致[16],故鉴定化合物8为4, 2′, 4′-三羟基查耳酮。
4 对ALF大鼠的治疗作用 4.1 方法将30只SD大鼠随机分为3组(对照组10只、模型组10只、东北岩高兰醋酸乙酯组10只)。采用ig 45%酒精的方法对SD大鼠进行造模,造模同时模型组大鼠饲喂高脂饲料,对照组大鼠饲喂普通饲料,造模8周后,收集对照组和模型组大鼠肝脏组织标本,制作病理切片,观察大鼠酒精性脂肪肝模型是否复制成功。在确保此方法可以建立实验所需模型的基础上,进行下一步实验,即用上述造模方法复制ALF大鼠8周,通过给予大鼠东北岩高兰醋酸乙酯提取部位进行治疗,治疗组每天ig给予20%醋酸乙酯部位萃取溶液1.2 g/kg,同时饲喂普通饲料。治疗4周后,处死各组大鼠,取其肝脏进行病理切片检查,并制备肝组织匀浆进行SOD、MDA、GSH-Px的检测,收集大鼠血液样本进行AST、ALT、TG、TC、TP的检测。
实验12周后,对大鼠进行禁食、不禁水处理,用配制好的乌拉坦溶液对大鼠进行ip麻醉。大鼠麻醉后,肝门静脉位置采集血液样本,3 000 r/min离心15 min,血清放在−80 ℃冰箱保存,用于检测各项生化指标。
大鼠取血后,分离肝脏,准确称量肝脏质量并做好记录,然后取肝左叶约4 mm×4 mm×8 mm的组织,浸泡在10%甲醛溶液中固定,用于HE染色,其余肝组织用锡纸包裹,标记好组别,放置在−80 ℃冰箱里保存待用。
用统计学软件SPSS17.0将测定的数据进行方差分析,组间均数的比较采取t检验,结果用x±s的形式表示。
4.2 结果 4.2.1 大鼠的一般形态学结果对照组大鼠毛发光滑,精力充沛,反应灵敏,饮食及大便正常,无嗜睡现象,未见任何不良反应。
模型组大鼠毛发干枯且缺乏光泽,反应迟钝,目光呆滞,神情恍惚,饮食逐渐减少且伴有流涎现象,大便稀软,渐不成形,有嗜睡现象出现。
治疗组大鼠毛发光滑,基本无流涎、嗜睡现象,食欲及大便基本恢复正常。
4.2.2 大鼠肝脏病理组织学结果肉眼观察,对照组大鼠肝脏大小正常,表面柔软光滑,整个肝脏呈现红褐色。
模型组大鼠肝脏明显肿大,边缘变钝,表面可见凸凹不平,色泽变淡,质地变硬,切面与对照组相比略微黄,与周围组织有粘连,有油腻感。
治疗组大鼠肝脏大小接近正常,比对照组大鼠肝脏略大,但已明显比模型组大鼠肝脏小,边缘较为锋锐,表面光滑,凸凹不平明显减少,肝脏的质地柔软,呈暗红色。
4.2.3 光镜下观察结果对照组大鼠肝细胞正常,细胞核居于细胞中央,汇管区可见血管及胆管结构,未见脂滴及炎性浸润,无病理性改变。模型组大鼠肝脏结构紊乱,呈中度脂肪变性,中央静脉周围片状坏死,炎症细胞浸润,肝细胞肿胀,胞浆疏松,可见许多大小不等的脂滴,细胞边界不清。治疗组大鼠肝脏结构接近正常,染色均匀,细胞排列规则而整齐,只能偶尔在肝小叶中看到炎症浸润及小脂肪滴的出现。结果见图 1。
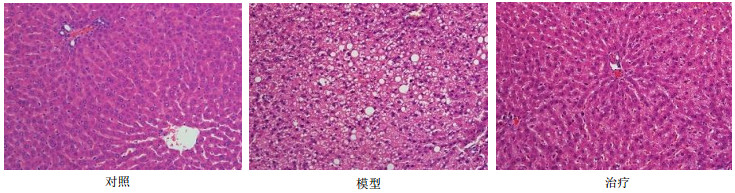
|
图 1 大鼠肝脏组织病理学切片 Fig.1 Liver histopathology in liver tissur of rats |
4.2.4 肝指数、血清学指标、肝组织匀浆中相关指标检测结果
肝指数、血清学指标、肝组织匀浆中各指标检测结果见表 1。
|
|
表 1 大鼠肝指数、血清学指标、肝组织匀浆指标测定结果(x±s, n=10) Table 1 Determination of liver index, serum, and liver homogenate of rats (x±s, n=10) |
5 讨论
本实验对东北岩高兰地上部分进行了化学成分和药理研究,分离并鉴定出其中8个单体化合物,包括5个黄酮类化合物、2个三萜类化合物、1个甾醇类化合物。药理研究表明东北岩高兰的醋酸乙酯部位对AFL大鼠治疗效果良好。本课题组前期生药学基础研究表明东北岩高兰中含有大量的黄酮类化合物,并对ALF大鼠有良好的抑制作用[9],本实验
| [1] | 马俊莹, 张华. 岩高兰[J]. 植物杂志 , 1996 (5) :1–2. |
| [2] | 尹君, 崔克城, 刘景贵, 等. 亚洲岩高兰的利用价值[J]. 特种经济动植物 , 2002, 5 (1) :23–24. |
| [3] | 满志宏, 杨玉新, 张春雨. 黑龙江省东北岩高兰现状及开发利用[J]. 黑龙江科技信息 , 2007 (1) :122–123. |
| [4] | 陈辉. 东北岩高兰的分布及保护利用价值[J]. 内蒙古林业调查设计 , 2011, 34 (6) :119. |
| [5] | 张洪亮, 赵玉杰, 高德志. 内蒙古大兴安岭林区岩高兰种质资源保护的必要性[J]. 内蒙古林业调查设计 , 2010, 33 (6) :92–93. |
| [6] | 康庭棣. 大兴安岭药用资源[M]. 哈尔滨: 哈尔滨出版社, 2001 . |
| [7] | 张玉莲, 梅任强, 刘熙, 等. 东北岩高兰化学成分研究[J]. 中草药 , 2014, 45 (16) :2293–2298. |
| [8] | 李瑞明, 王振月, 康毅华, 等. 岩高兰生药学研究[J]. 中南药学 , 2005, 3 (3) :175–177. |
| [9] | 李春燕.东北岩高兰对大鼠酒精性脂肪肝的预防作用研究[D].哈尔滨:黑龙江中医药大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10228-2009175615.htm |
| [10] | 陈欢, 陈光, 任红梅, 等. 枇杷叶中三萜类成分的研究[J]. 北京化工大学学报 , 2012, 39 (3) :40–45. |
| [11] | 宋少江, 陈佳, 寇翔, 等. 山楂叶的化学成分[J]. 沈阳药科大学学报 , 2006, 23 (2) :88–90. |
| [12] | 张峰, 张俊清, 孔令义. 薜荔化学成分研究[J]. 中草药 , 2009, 40 (10) :1554–1555. |
| [13] | Wollenweber E, Seigler D S. Flavonoids from the exudate of Acacia neovernicosa[J]. Phytochemistry , 1982, 21 (05) :1063–1066. DOI:10.1016/S0031-9422(00)82416-4 |
| [14] | 杨欢, 王栋, 童丽, 等. 镰形棘豆的化学成分研究[J]. 中国药学杂志 , 2008, 43 (5) :338–340. |
| [15] | Krasnov E, Ermilova E, Kadyrova T, et al. Phenolic components of Empetrum extract and the crystal structure of one of them[J]. Chem Nat Comp , 2000, 35 (5) :493–496. |
| [16] | Liu R H, Wen X C, Shao F, et al. Flavonoids from heartwood of Dalbergia cochinchinensis[J]. Chin Herb Med , 2016, 8 (1) :89–93. DOI:10.1016/S1674-6384(16)60014-X |
| [17] | 尹婷, 刘烨, 王邠, 等. 红血藤的化学成分[J]. 药学学报 , 2008, 43 (1) :67–70. |
 2016, Vol. 47
2016, Vol. 47


