蛇足石杉Huperzia serrata(Thunb)Trev.为蕨类植物,系石杉科(Huperiaceae)石杉属Huperzia Bernh多年生植物,又名金不换、千层塔等,民间常用于治疗痈疖、跌打损伤、肿毒等症[1]。蛇足石杉内含石杉碱甲和石杉碱乙,是可逆性胆碱酯酶抑制剂,对于预防和治疗老年性痴呆、记忆力减退和重症肌无力具有显著的疗效[2-3]。蛇足石杉在自然界中生长缓慢,孢子繁殖率低,萌发后产生配子体,需6~15年才能成熟[4-5],又因其巨大的药用价值,导致过度地开发采集,使该种药材资源的再生受到了极大限制。因此,建立合适的人工繁殖体系是解决和保护蛇足石杉资源的重要途径。
关于蛇足石杉的繁殖问题一直备受关注,王德立等[6]研究了蛇足石杉的芽胞繁育,盛束军等[7]及覃大吉等[8]研究了蛇足石杉的扦插繁殖;还有研究者对蛇足石杉孢子囊进行诱导培养[9-10];但仅有韦景枫等[11]以孢子囊为外植体,诱导获得了蛇足石杉原叶体,但未从原叶体获取孢子体;包日双等[12]对蛇足石杉孢子进行诱导获得了原叶体,并从原叶体中获得了少量的孢子体,但仍未达到快速繁殖的目的;李贵等[10]和沈晓霞等[13]对蛇足石杉的灭菌条件进行了研究;梁昊[14]以茎尖为外植体建立了蛇足石杉的组织培养体系,但并未获得增殖苗,因而也未真正达到快速繁殖的目的。Szypula等[15]对同属Huperzia selago(L.)Bernh.ex Schrank et Mart的顶芽进行了离体培养,在其顶芽处培养出绿色小球,由绿色小球再培养成二叉分枝的芽,但也未能获取侧芽。
蛇足石杉的分枝方式为古老的二叉分枝,自然生长情况下,其叶腋内着生孢子囊,无腋芽。目前,有关于石杉属植物诱导产生侧芽的报道非常少,仅在本课题组马英姿等[16]的研究中得到了少量的侧芽,本研究在此基础上继续培养无菌苗,在茎段的不同部位得到了大量的侧芽,并且一个芽点能产生多个侧芽,而后对所产生的侧芽进行了剥离培养条件研究,为蛇足石杉的快速繁殖提供重要参考依据。
1 材料样品活体植株采自湖南浏阳大围山,由中南林业科技大学喻勋林教授鉴定为蛇足石杉Huperzia serrata(Thunb.)Trev.。
2 方法 2.1 外植体表面灭菌剪取蛇足石杉顶芽3 cm长,先用清洁剂在水中清洗,然后在自来水下冲洗3 h,之后将材料参照马英姿等[16]的方法进行表面消毒,无菌水冲洗干净后,接种于1/2 MS培养基中,根据马英姿等[17-18]的研究,选择培养温度为25 ℃,再根据王志安等[19]的研究确定光照条件为5~10 μmol/(cm2∙s)、12 h/d,最终确定最佳培养条件为25 ℃、5~10 μmol/(cm2∙s)、12 h/d,在此条件下培养20 d。
2.2 外植体内生菌杀灭及初代培养将培养20 d后的表面没有微生物污染的顶芽移入含有0.5 mg/L孔雀石绿+100 mg/L AAS的1/2 MS+25 g/L蔗糖培养基上培养,进行内生菌消毒;15 d后将无明显感染的外植体,少量修剪茎基部后,转入适合生长的1/2 MS+25 g/L蔗糖培养基中进行初代培养[16]。
2.3 试管苗的继代培养将外植体在1/2 MS+26 g/L蔗糖培养基上继续培养,每60~90 d换1次培养基,观察其生长变化,包括顶端分枝及孢子囊的形成过程。当培养90 d后,外植体顶芽会形成新的二叉分枝,待二叉分枝长至3~4 cm后,再将2个分枝剪下来各自接种到培养基上继续培养。
2.4 侧芽的形成当试管苗的二叉分枝不断形成、生长,并剪切继代培养3~4次后,在试管苗的一定部位的叶腋内产生了大量的侧芽,观察侧芽的形成部位及主茎的形态变化,统计侧芽发生的数量。
2.5 侧芽的分离培养待侧芽长大到一定高度时,随机挑选2~5 mm的侧芽100个,从母株上拨离,接种到与母株相同培养基中,观测并记录其生长状况,并统计存活率(存活率=存活的侧芽数/接入的侧芽总数)。
2.6 培养基对侧芽生长的影响选择1/2 MS为基本培养基,剥离2~5 mm的侧芽,分别接种到9种不同的改良培养基上,每种10瓶,一瓶2株,30 d后统计存活率,计算出各因素内各个水平之间的极差(R),判定各个因素对侧芽生长的影响程度,确定最佳培养基。
2.7 侧芽长度对侧芽分离的生长影响选取不同长度的侧芽,分为4个长度梯度,分别接种到最佳培养基上,每个梯度接种20株侧芽,30 d后统计存活率。
3 结果与分析 3.1 试管苗侧芽的发生及鉴别经过表面消毒后培养20 d,40%的外植体没有微生物污染迹象,再经过内生菌杀灭,得到了一批无菌苗[16],经过初代培养到二叉分枝剪切继代培养4次后,发现蛇足石杉部分试管苗发生了形态变化,在茎段中部或者茎尖下部的叶腋内没有形成孢子囊,而是产生了数量不等的侧芽。侧芽形态如图 1-B、C,并且不具有芽托结构(图 1-A),与野生蛇足石杉芽胞有较大区别。蛇足石杉的自然生长状态下是原始的二叉分枝,叶腋内只着生孢子囊,而不产生腋芽,目前,国内外关于石杉属植物的培养,除了本课题组之外,尚未见有侧芽培养成功的相关报道。本研究证明了蛇足石杉试管苗在人工培养条件下可以产生新的分枝生长方式。
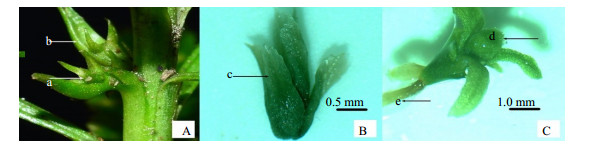
|
A-野生蛇足石杉的芽托B-体视显微镜下的侧芽C-侧芽在培养基中生长30 d a-芽胞与芽托连接点b-芽托的大鳞叶c-幼叶d-膨大的芽尖e-长出的不定根 A-wild H. serrata gemmiphore B-lateral bud under stereomicroscope C-lateral bud growth in culture for 30 d a-join points of gemmas and gemmiphores b-gemmiphores scale leaves c-microphylls d-enlargemented shoot tip e-adventitious root 图 1 芽胞体与侧芽的形态比较 Fig.1 Morphological comparison on gemma and lateral bud |
3.2 侧芽的发生部位与数量
试管苗在二叉分枝继代培养4次后,所有的试管苗均产生了侧芽,但产生的部位、数目有差异(图 2-A、B、C、D),同时还出现同一个芽点产生多个小芽的现象,剥离接种到培养基上,可发育成类似丛生芽的一丛幼苗(图 2-E)。随机抽取10瓶试管苗统计其侧芽数目及芽点发生数(表 1),其发生侧芽的平均数可达7.9,远远高于正常的芽胞发生数目,增值倍数得到了较大的提高。侧芽生长到一定高度后并不会像芽胞一样自行脱落,而是能继续生长为侧枝(图 2-F),与野外芽胞的生长状况完全不同,从另一方面进一步证实了发生的小芽为侧芽,而不是芽胞。

|
A-聚集生长在茎尖的侧芽B-茎段中部着生的两轮侧芽C-生长在茎段中部成辐射对称的侧芽D-生长在二叉分枝分叉口的少量侧芽E-试管苗茎段中部1个芽点发生了多个侧芽F-茎段中部的两个侧芽发育成侧枝a-1个芽点发生了4个小侧芽b-1个芽点发出了2个侧芽c-芽点发生处d-c点拔落的侧芽长大成丛芽状e-长大的侧枝 A-gathered in shoot tip growth of lateral bud B-middle stem of two rounds of lateral bud C-radial symmetry growing in middle stem of lateral bud, D-growth in dichotomous branching of a small amount of lateral bud E-one bud points growing many lateral buds in middle stem of plantlets, F-middle stem of plantlets of two lateral buds grew up into lateral branch a-one bud point growing four lateral bud, b-one bud point growing two lateral bud c-bud point junctions d-lateral bud grew up into clumpy buds form c point e-large lateral branch 图 2 侧芽的发生部位及生长形态 Fig.2 Occurrence location and growth form of lateral buds |
|
|
表 1 试管苗侧芽产生部位及增殖倍数 Table 1 Position and proliferation times of plantlets lateral bud |
3.3 侧芽的分离培养
对侧芽继续培养观察发现,试管苗中产生少量侧芽的植株可以正常生长,侧芽可以继续生长形成侧枝状(图 2-F),但部分产生大量侧芽的试管苗的叶尖出现枯黄现象,且母株产生不同程度的变形,说明大量的侧芽导致试管苗的营养供应不足,进而影响试管苗的生长,如果能将侧芽在早期剥离母株,使其独立生长,发育成完整的幼苗,其繁殖速率将大大提高,野生资源匮乏的问题也将得到缓解。
本研究将生长至2~5 mm的增殖侧芽剥离母株后接种在相同配方的培养基上,在相同的培养条件下培养,30 d后观察统计侧芽存活率,结果存活率为60%;60 d后,存活率降为31%;观察对比发现,60 d后依然生长良好的侧芽在剥离母体时其高度均≥0.5 cm,侧芽的生根率达100%。存活下来的侧芽生长较为旺盛,60 d后不定根出现二叉分枝,120 d后高度可达3~4 cm,成长为一株完整的蛇足石杉幼苗。
3.4 培养基对侧芽生长的影响接种到1/2 MS+25 g/L蔗糖的培养基上侧芽存活率过低,针对上述分析,将生长高度在2~5 mm左右的侧芽接种在1/2 MS改良培养基上,添加不同浓度的生长素与细胞分裂素,并且增大蔗糖的浓度,选择因素A:蔗糖(30、35、40 g/L),B:NAA(0.5、1.0、1.5 mg/L),C:6-BA(0.1、0.5、1.0 mg/L)设计了3因素3水平的L9(33)正交试验表,30 d后统计侧芽存活率见表 2。通过数据分析,可以得出各因素内各个水平之间的R,R的大小反映了该因素的影响程度,从R的大小可知,各因素对存活率影响的大小依次为蔗糖>NAA>6-BA;由表 2还可以看出,蔗糖质量浓度越大,幼嫩侧芽的存活率越高,长势也越旺盛(图 3),当蔗糖质量浓度达到40 g/L时,侧芽的存活率可达到75%;而外源激素对侧芽的生长影响不明显。
|
|
表 2 不同培养基对侧芽存活率的影响 Table 2 Effect of different cultural media on survival rate of lateral buds |

|
A-25 g/L蔗糖培养基上生长30 d的侧芽B-30 g/L蔗糖培养基上生长30 d的侧芽C-35 g/L蔗糖培养基上生长30 d的侧芽D-40 g/L蔗糖培养基上生长30 d的侧芽 A-growing 30 d of lateral bud in 25 g/L sucrose medium B-growing 30 d of lateral bud in 30 g/L sucrose medium C-growing 30 d of lateral bud in 35 g/L sucrose medium D-growing 30 d of lateral bud in 40 g/L sucrose medium 图 3 同蔗糖浓度培养基中增殖侧芽生长状况 Fig.3 Growth condition of lateral buds in different concentration of sucrose medium |
3.5 侧芽长度对侧芽分离的生长影响
侧芽在母株上的长度不同,剥落后接种到培养基上的生长状况和存活率也会有明显差异。在上述结果的基础上,选取了一批不同生长高度的侧芽接种到1/2 MS+40 g/L蔗糖的幼芽培养基上,以探究最佳的侧芽分离培养时期。表 3显示了接种30 d后的侧芽存活率,表明侧芽越长,接种后的存活率也越高,生长也越迅速;而长度在1~2 mm的侧芽剥离母株后几乎不能存活,存活下来也生长缓慢;长度在3~4 mm的侧芽存活率为50%,生长缓慢;长度在5 mm以上的侧芽存活率达90%以上,并且生长旺盛,60 d后高度为8~10 mm(图 4),生长速度远远超过了仍然留在母株上的侧芽。在侧芽过多且生长时间较长时会严重影响母株的生长,甚至导致母株叶发黄至死亡。
|
|
表 3 侧芽长度对分离培养的影响 Table 3 Effect of lateral bud length on cultivation |

|
A-30 d后的生长高度B-60 d后的生长高度C-90 d后的生长高度D-120 d后的生长高度a-基部已长不定根 A-after 30 d of height B-after 60 d of height C-after 90 d of height D-after 120 d of height a-adventitious root from basal of stem 图 4 侧芽在不同时期的生长高度 Fig.4 Growth height of lateral buds in different periods |
4 讨论
在以往的蛇足石杉组织培养研究中,大多是期望得到愈伤组织或者诱导孢子囊的萌发来达到快速繁殖的目的,但因蛇足石杉的本身特性,这些研究收效甚微,并没有达到快速繁殖的目的。本研究在无菌苗二叉分枝后继代培养4代时得到了大量的增殖侧芽,由于蛇足石杉在自然生长状态下不会产生侧芽,只在叶腋内会产生少量芽胞,所以在侧芽产生之初易被误认为是芽胞,但经过仔细观察其生长,查阅文献及与野生蛇足石杉芽胞进行对比后,最终确定培养产生的是蛇足石杉侧芽,而不是芽胞。
根据王小理等[20]对野生石杉芽胞的描述,和笔者对野生蛇足石杉芽胞的观察,5~8月份蛇足石杉茎尖下端3~5 mm的位置会生长出3~5个芽胞,由芽托和芽胞构成芽胞体,芽托由4片鳞叶组成,上端3片小鳞叶,下端1片大麟叶,4片鳞叶包裹着芽胞生长,中间有维管束与芽胞相连,芽胞由一个幼芽和位于幼芽四周的的6片小叶组成,近轴面观有4片小叶,远轴面观有5片小叶,芽胞成熟后会从该连接点掉落,进而在土壤中萌发生长为新的植株;而本研究培养得到的芽体没有芽托,也不具备芽孢体的结构,芽体直接着生在茎段上,经过体视显微镜的观察,发现小芽由多片小叶组成,并通过细小的维管束与主茎相连,小叶大小基本均匀,辐射对称,没有近轴面与远轴面的区别,与野生蛇足石杉芽孢的形态结构完全不同,说明发生的小芽不是芽胞而是侧芽。
研究中发现,当试管苗只发生少量侧芽时,侧芽能够继续留在母株上继续生长成为侧枝,当试管苗发生大量侧芽时,侧芽生长缓慢,同时也影响母株生长,导致母株变形,甚至叶发黄,但是幼嫩的侧芽剥离试管苗后存活率又太低,死亡率较高的原因可能有2种:一是最适培养基可能与母株生长所需的培养基不一样,生长条件不适宜,导致部分死亡;二是由于侧芽过小,维管系统尚未发育完全,独立吸收营养能力弱,脱离母株后造成死亡.为了研究了不同培养基对侧芽存活率的影响,设计了3因素3水平的L9(33)正交试验,结果表明,外源激素NAA和6-BA对侧芽的生长影响不明显,蔗糖质量浓度对侧芽的存活率起了主导作用,可能是由于侧芽过于幼嫩,维管系统尚未发育完全,叶片小,光合作用及吸收能力弱,需要更多的碳源来提供生长需要,而高于5 mm的侧芽剥离培养后存活率提高是因为其维管系统及光合能力增强。
在侧芽剥离后生长形态变化观察中,发现大部分死亡的侧芽在生长过程中出现了如图 1-C所示的茎尖膨大的现象,幼叶分化困难,最后导致枯黄死亡,推测原因可能是因为幼叶自身产生了高浓度的生长素,抑制了茎尖的幼叶分化,因为几乎所有的侧芽在生长30 d后都产生了不定根,而高浓度的生长素能促进不定根的产生;从生长状况良好的二叉分枝试管苗剪下的成熟分枝,在相同的培养基中却不易产生不定根,说明越幼嫩的芽产生的生长素类物质就越高,能促进幼芽产生不定根。当然,幼芽生根后死亡的原理还有待于进一步的深入研究。
本研究通过蛇足石杉离体培养多次继代后,得到了大量侧芽,侧芽剥离长度在5 mm以上,在添加40 g/L蔗糖的1/2 MS培养基上,侧芽的存活率可达90%以上,120 d后侧芽可生长为2~3 cm的具有不定根的幼苗,使蛇足石杉的繁殖系数得到了大大的提高。本研究说明了蛇足石杉培养侧芽并发育成新植株的繁殖方式切实可行,且繁殖率较高,为蛇足石杉的人工快繁技术开辟了新的途径,对蛇足石杉药用资源的开发与保护具有重大的意义。
| [1] | 余红英, 孙远明, 杨跃进. 草药蛇足石杉的研究进展[J]. 中草药 , 2001, 32 (3) :279–281. |
| [2] | 张守圭. 治疗重症肌无力新药——石杉碱甲通过鉴定[J]. 中国新药与临床杂志 , 1985 (4) :235. |
| [3] | Wang R, Tang X C. Neuroprotective effects of huperzine A.A natural cholinesterase inhibitor for the treatment of Alzheimer'sdisease[J]. Neurosignals , 2005, 14 :71–82. DOI:10.1159/000085387 |
| [4] | 郭斌, 徐玲玲, 尉亚辉, 等. 千层塔的研究进展[J]. 中国中药杂志 , 2009, 34 (16) :2018–2022. |
| [5] | Ma X Q, Gang D R. In vitro production of huperzine A, a promising drug candidate for Alzheimer's disease[J]. Phytochemistry , 2008, 69 :2022–2028. DOI:10.1016/j.phytochem.2008.04.017 |
| [6] | 王德立, 冯锦东. 蛇足石杉的芽胞特性和芽胞繁育技术[J]. 安徽农业科学 , 2011, 39 (2) :805–807. |
| [7] | 盛束军, 徐建中, 王志安, 等. 千层塔扦插繁殖研究[J]. 资源开发与市场 , 2000, 16 (5) :268–269. |
| [8] | 覃大吉, 杨永康, 向极钎, 等. 千层塔NFT扦插育苗技术研究[J]. 湖北民族学院学报:自然科学版 , 2010, 28 (1) :18–21. |
| [9] | 马华升, 孙玉强, 童建新, 等. 千层塔组织培养中外植体消毒灭菌研究初报[J]. 杭州农业科技 , 2008 (4) :15–18. |
| [10] | 李贵, 李菁, 黎有有, 等. 蛇足石杉外植体表面消毒及内生菌消除方法[J]. 吉首大学学报:自然科学版 , 2009, 30 (4) :100–103. |
| [11] | 韦景枫, 陶文丞, 钟漫, 等. 千层塔孢子萌发研究初报[J]. 黑龙江生态工程职业学院学报 , 2011, 24 (5) :9–10. |
| [12] | 包日双, 尹培培, 郭斌, 等. 蛇足石杉原叶体的培养及孢子体的诱导[J]. 植物生理学报 , 2012, 48 (4) :393–396. |
| [13] | 沈晓霞, 俞旭平, 盛束军. 千层塔茎尖组织培养灭菌方法的研究[J]. 中国中药杂志 , 2002, 27 (6) :458–459. |
| [14] | 梁昊.千层塔组织培养体系的建立及激素对丛生苗生长和石杉碱甲合成的影响[D].合肥:合肥工业大学, 2010. |
| [15] | Szypula W, Pietrosiuk A, Suchocki P, et al. Somatic embryogenesis and in vitro culture of Huperzia selago shoots as a potential source of huperzine A[J]. Plant Sci , 2005, 168 :1443–1452. DOI:10.1016/j.plantsci.2004.12.021 |
| [16] | 马英姿, 刘江海, 许欢, 等. 蛇足石杉的离体培养[J]. 植物生理学报 , 2015, 51 (4) :465–470. |
| [17] | 马英姿, 张慧, 宋荣, 等. 高温胁迫对蛇足石杉生理特性的影响[J]. 中草药 , 2013, 44 (2) :224–228. |
| [18] | 马英姿, 张慧, 王志毅, 等. 高温胁迫对蛇足石杉质膜透性及叶绿体结构的影响[J]. 中草药 , 2013, 44 (18) :2605–2610. |
| [19] | 王志安, 徐建中, 俞旭平, 等. 生态环境因子对千层塔生长发育的影响研究[J]. 中国中药杂志 , 2008, 33 (15) :1814–1816. |
| [20] | 王小理, 黎万奎, 周吉燕, 等. 长柄石杉芽胞及芽胞植株形态研究[J]. 云南植物研究 , 2007, 29 (5) :521–526. |
 2016, Vol. 47
2016, Vol. 47


