2. 江苏大学药学院, 江苏 镇江 212013 ;
3. 江苏苏中药业集团股份有限公司, 江苏 姜堰 225500
2. School of Pharmacy, Jiangsu University, Zhenjiang 212013, China ;
3. Suzhong Pharmaceuticals Co., Ltd., Jiangyan 225500, China
五味子为兰科植物五味子Schisandra chinensis (Turcz.) Baill.的干燥成熟果实,习称“北五味子”,具有丰富的药用和食用价值,是临床配伍饮片和五味子相关制剂生产的重要原料之一[1]。生脉注射液为依据我国古验方生脉散研制而成的中药注射剂,由红参、麦冬、五味子经水提取后制成的灭菌水溶液,具有益气养阴、复脉固脱的功效[2]。五味子药渣为五味子药材在生脉注射液生产过程中产生的固体废弃物。
现代研究发现,五味子与其他中药配伍可用于急、慢性肝损伤的治疗,可以促进损伤肝细胞的修复、降低血清丙氨酸转氨酶(ALT)活性[3]。如五味子对四氯化碳(CCl4)所致小鼠急性肝损伤具有明显的保护作用[4]。五味子对用CCl4和D-氨基半乳糖(D-GlaN)多次注射造成的慢性肝损伤有较好的治疗作用,五味子与丹参配伍的作用更优于单用五味子,对纤维组织增生具有明显抑制作用[5]。五味子醇提物中均含有五味子醇甲、五味子酯甲、五味子甲素和五味子乙素等木脂素类成分,这些成分是其保肝作用的主要物质基础[6-7],具有改善肝功能、减轻肝细胞脂质过氧化损伤,从而防止肝纤维化的作用[8]。其中五味子乙素可减轻H2O2导致的人肝细胞氧化损伤[9]。研究还表明,肝功能损伤后常常会引起肠黏膜屏障功能的改变、肝功能衰竭,从而导致胃肠功能衰竭;反之,胃肠功能障碍又会影响肝脏的修复,甚至加重肝损伤,目前“肝-肠对话”日益受到国内、外学者的关注[10]。
本实验在前期研究的基础上[11],采用优化的工艺条件对生脉注射液生产过程产生的五味子药渣进行提取与分析,并考察其对急性肝损伤大鼠模型的肝保护作用及其对肠道菌群结构的影响,以期为五味子药渣及其资源性化学物质的资源化利用与产业化开发提供科学依据。
1 材料 1.1 动物SPF级雄性SD大鼠32只,体质量180~200 g,购于上海杰思捷实验动物有限公司,许可证号SCKY(沪)2013-0002,分笼饲养。
1.2 药品与试剂五味子药渣收集于江苏苏中药业集团股份有限公司,经南京中医药大学段金廒教授鉴定,五味子药渣为五味子Schisandra chinensis (Turcz.) Baill.药材在生脉注射液生产过程中产生的固体废弃物(批号20131208);甲醇、乙醇(南京化学试剂有限公司);对照品五味子甲素(质量分数≥98%,批号WWJS20140114)、五味子乙素(质量分数≥98%,批号WWYS20140525)、五味子丙素(质量分数≥98%,批号WWBS20140217)、五味子醇甲(质量分数≥98%,批号WWCJ20140409)、五味子醇乙(质量分数≥98%,批号WWCY20140610),均为南京春秋生物工程有限公司产品;五味子酯甲(质量分数99.4%,批号111529-200604),购于中国食品药品检定研究院。
乳酸杆菌培养基、双歧杆菌培养基、肠球菌培养基和肠杆菌培养基由青岛日水生物有限公司提供;ALT、天冬氨酸转氨酶(AST)、白蛋白(ALB)和总蛋白(TP)试剂盒由南京春秋生物工程有限公司提供;水为实验室自制超纯水。
1.3 仪器美国Waters 2695高效液相色谱系统,Waters 2996 UV检测器,Empower数据管理系统;ML204/02、MS-205电子天平(上海梅特勒-托利多仪器有限公司);DHG-9023A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);Enspire多功能酶标仪(Perkin Elmer);TDL-80-2B型离心机(上海安亭科学仪器);HH数显恒温水浴锅(金坛市医疗仪器厂)。
2 方法与结果 2.1 五味子药渣提取物的制备与成分分析 2.1.1 给药用五味子药渣提取物的制备将五味子药渣于60 ℃下烘干,取干燥药渣打粉,过40目筛,装入自封袋中于干燥器内保存。精密称取60 ℃干燥粉末1 000 g,采用12倍量60%乙醇回流提取3次,每次2 h,合并滤液,浓缩至无醇味后倒入500 mL量瓶中,加入超纯水并定容至300 mL作为大鼠给药药物。
2.1.2 分析用五味子药渣提取物的制备按“2.1.1”项下方法提取1 000 g五味子药渣,合并滤液,浓缩后放入蒸发皿中蒸成浸膏,称质量。取浸膏0.5 g加入5 mL甲醇溶解,稀释10倍后取上清液过0.45 μm滤膜,进样。
2.1.3 对照品溶液的制备分别精密称取五味子甲素、五味子乙素、五味子丙素、五味子醇甲、五味子醇乙、五味子酯甲对照品适量,用甲醇配成质量浓度分别为0.346、0.170、0.113、0.252、0.153、0.165 mg/mL的混合对照品溶液。
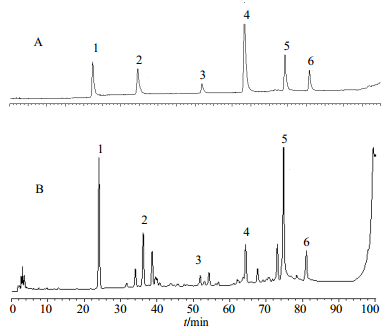
2.1.4 色谱条件色谱柱为BDS HYPERSIL C18柱(250 mm×4.6 mm,5 μm);柱温25 ℃;体积流量1 mL/min;进样量10 μL,以甲醇-超纯水为流动相进行梯度洗脱:0~20 min,50%~55%甲醇;20~30 min,55%~58%甲醇;30~60 min,58%~70%甲醇;60~80 min,70%~79%甲醇;80~90 min,79%~83%甲醇;90~100 min,83%~100%甲醇。HPLC色谱图见图 1。
|
1-五味子醇甲2-五味子醇乙3-五味子酯甲4-五味子甲素5-五味子乙素6-五味子丙素 1-gomisin A 2-gomisin B 3-schisantherin A 4-schisandrin A 5-schizandrin B 6-schizandrin C 图 1 混合对照品(A)和五味子药渣提取物(B)的HPLC图 Fig.1 HPLC of mixed reference substances (A) and Schizandrae Fructus residue extracts (B) |
2.1.5 线性范围考察
取适量五味子甲素、五味子乙素、五味子丙素、五味子醇甲、五味子醇乙、五味子酯甲混合对照品溶液,分别进样1、2、5、10、20 μL,按“2.1.3”项下色谱条件测定,记录峰面积积分值。以峰面积积分值为纵坐标(Y),进样量为横坐标(X),得回归方程,分别为五味子甲素:Y=2 100 000 X+200 000,R2=0.999 5,线性范围0.346~6.92 μg;五味子乙素:Y=2×10−6 X+1.8×10−5,R2=0.999 1,线性范围0.170~3.40 μg;五味子丙素:Y=1.2×10−6 X-25 142,R2=1.000 0,线性范围0.113~2.26 μg;五味子醇甲:Y=1.9×10−6 X-94 185,R2=1.000 0,线性范围0.252~5.04 μg;五味子醇乙Y=1.3×10−6 X-63 894,R2=1.000 0,线性范围0.153~3.06 μg;五味子酯甲Y=7.6×10−5 X-46 235,R2=1.000 0,线性范围0.165~3.30 μg。
2.1.6 精密度试验精密吸取混合对照品溶液10 μL,连续进样6次,测定五味子甲素、五味子乙素、五味子丙素、五味子醇甲、五味子醇乙、五味子酯甲色谱峰峰面积,计算得其RSD分别为0.61%、0.70%、1.60%、1.47%、2.75%、1.88%,表明本实验方法精密度良好。
2.1.7 稳定性试验取“2.1.2”项下制备的样品溶液,每隔2 h测定1次,测定6次,最终五味子甲素、五味子乙素、五味子丙素、五味子醇甲、五味子醇乙、五味子酯甲峰面积的RSD分别为0.37%、0.21%、1.84%、0.49%、1.81%、2.08%,表明样品溶液在24 h内稳定。
2.1.8 重复性试验按照“2.1.2”项方法制备6份样品溶液,按“2.1.4”项下色谱条件测定五味子甲素、五味子乙素、五味子丙素、五味子醇甲、五味子醇乙、五味子酯甲质量分数的RSD分别为1.76%、1.55%、2.74%、0.93%、4.90%、2.71%,表明方法重复性良好。
2.1.9 回收率试验精密称定已知质量分数的样品9份,以样品质量分数的80%、100%、120%加入适量对照品溶液,混匀,每个质量浓度平行3次,按照“2.1.2”项下方法处理,在“2.1.4”项色谱条件下测定6种有效成分的质量分数,计算平均加样回收率。结果显示,五味子甲素的平均回收率分别为98.00%、97.05%、101.03%,RSD分别为3.50%、4.70%、4.34%;五味子乙素的平均回收率分别为99.37%、97.81%、99.36%,RSD分别为2.53%、3.73%、2.34%;五味子丙素的平均回收率分别为91.15%、98.89%、92.20%,RSD分别为2.82%、4.87%、3.20%;五味子醇甲的平均回收率分别为94.61%、96.17%、102.02%,RSD分别为2.30%、1.44%、0.81%;五味子醇乙的平均回收率分别为98.57%、102.04%、101.05%,RSD分别为3.97%、0.89%、1.02%;五味子酯甲的平均回收率为103.05%、95.54%、96.16%,RSD分别为1.68%、2.93%、2.16%。
2.1.10 五味子药渣提取物的成分分析取“2.1.2”项下制备的样品溶液,进样测定。结果五味子药渣浸膏得率为13.60%,五味子药渣提取物中五味子甲素、五味子乙素、五味子丙素、五味子醇甲、五味子醇乙和五味子酯甲的质量分数分别为1.44、3.42、1.68、4.22、2.92、0.58 mg/g,成分总量为14.26 mg/g。
2.2 五味子药渣提取物对急性肝损伤模型大鼠的保护作用 2.2.1 动物分组、造模及给药雄性大鼠喂养1周适应环境后,取大鼠32只,随机分为4组,每组8只,分别为对照组,模型组,五味子药渣提取物低、高剂量(0.535、2.675 g/kg)组。模型组和五味子药渣提取物高、低剂量组大鼠用40%的CCl4橄榄油溶液按照2 mL/kg进行ip,24 h后形成急性肝损伤模型。采集血样0.5 mL(每组随机取5只大鼠,眼眶取血),测血清中的ALT、AST,各造模组较对照组明显升高,说明造模成功。造模成功后第3天开始给药,对照组和模型组分别ig同体积的生理盐水(7.5 mL/kg),五味子药渣提取物高、低剂量组分别ig相应药物,每天1次,连续给药7 d。
2.2.2 五味子药渣提取物对模型大鼠血清中ALT、AST、ALB和TP的影响各组大鼠给药结束后眼眶取血,采样1.5 mL于离心管中,静置30 min,10 000 r/min下离心20 min后分离血清。ALT、AST、ALB和TP的测定严格按照试剂盒说明书要求进行。结果见表 1。与对照组比较,模型组大鼠血清中ALT、AST明显升高(P<0.01),说明造模成功。与模型组相比,五味子药渣提取物高剂量组大鼠血清中的ALT、AST明显降低(P<0.01),ALB、TP水平显著升高(P<0.05)。而五味子药渣提取物低剂量组大鼠血清中的ALT、AST也明显降低(P<0.05、0.01),但ALB、TP水平与模型组比较差异不显著(P>0.05)。
|
|
表 1 各组大鼠血清中ALT、AST、ALB和TP水平比较(x±s, n=8) Table 1 Comparison on levels of ALT, AST, ALB, and TP in serum of rats in each group (x±s, n=8) |
2.2.3 五味子药渣提取物对模型大鼠肝脏病理改变的影响
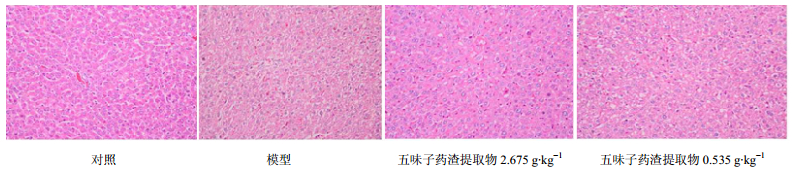
麻醉处死大鼠后,取各组大鼠肝脏于10%甲醛溶液固定后,进行组织病理切片检查。首先经肉眼观察,模型组大鼠肝脏普遍肿大,颜色呈暗红,质地较硬。五味子药渣提取物高、低剂量组大鼠较模型组大鼠症状轻。显微镜下观察肝脏病理切片可见,模型组大鼠肝组织损伤程度明显高于对照组,同时正常结构被破坏、肝细胞肿胀、水样变性、间质内有炎性细胞浸润;五味子药渣提取物高、低剂量大鼠较模型组损伤程度明显降低,肝脏病变明显减轻,并有部分组织修复。结果见图 2。
|
图 2 各组大鼠肝组织病理观察结果 Fig.2 Observation on pathological changes in liver tissue of rats in each group |
2.2.4 五味子药渣提取物对模型大鼠结肠病理改变的影响
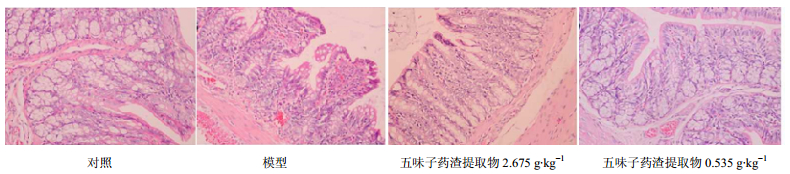
麻醉处死大鼠后,取各组大鼠结肠组织于10%甲醛溶液固定后,进行组织病理切片检查。显微镜下观察,对照组大鼠结肠组织表面光滑,肠黏膜上皮完整。模型组肠黏膜外膜出血、肠腔扩张,并可见炎性细胞浸润;五味子药渣提取物低剂量组大鼠肠黏膜较完整;五味子药渣提取物高剂量组大鼠结肠组织表面光滑,肠黏膜较完整。结果见图 3。
|
图 3 各组大鼠结肠组织病理观察结果 Fig.3 Observation on pathological changes in colonic tissue of rats in each group |
2.2.5 五味子药渣提取物对模型大鼠肠道菌群结构的影响
采用逼迫法无菌采集各组大鼠新鲜粪便样本于已灭菌的离心管中,取新鲜粪便0.2 g加入0.9 mL生理盐水,在振荡器上使之匀浆,标本按照10倍连续稀释法稀释至1×10−6,分别取1×10−4、1×10−5和1×10−6稀释液0.01 mL接种于选择性培养基上,每种稀释度接种3滴。将乳酸杆菌培养基和双歧杆菌培养基置于厌氧罐中,并放入厌氧袋封闭,在37 ℃恒温培养箱中培养48 h。肠球菌培养基和肠杆菌培养基直接放入37 ℃恒温培养箱中培养48 h即可。菌落长出后计数,并计算每克粪便中各菌群的菌落形成单位(lgCFU/g)。结果见表 2。与对照组比较,模型组乳酸杆菌和双歧杆菌减少,肠球菌和肠杆菌明显增多(P<0.05);与模型组比较,五味子药渣提取物高、低剂量组大鼠肠道中的乳酸杆菌、双歧杆菌数量明显增加,肠球菌、肠杆菌数量明显减少(P<0.05)。
|
|
表 2 各组大鼠肠道细菌菌落比较(x±s, n=8) Table 2 Comparison on intestinal bacterial colonies of rats in each group (x±s, n=8) |
3 讨论
目前,五味子资源的利用仍以其成熟果实用于中药工业和中医临床配方调剂等。年需量3 000余吨。在五味子药材采收加工过程中,每年有大量五味子果肉、果梗、茎叶、药渣等废弃物产生,大部分被丢弃或焚烧,造成资源浪费[12]。然而中药废渣的产生主要以中药制剂生产带来的废渣量最大,约占废弃药渣总量的70%[13]。因此,对五味子药渣亟待通过现代科学技术及集成技术进行系统回收利用。研究发现,利用生物技术、通过微生物发酵将药渣转化为菌体蛋白饲料,可大幅度提高药渣的利用价值[11]。如利用白腐菌对中药渣进行固态发酵,发现在经过3~5 d的发酵后,发酵产物的真蛋白质量分数比原料本身高71.34%[14]。五味子药渣经蛹虫草菌发酵后能提高仔猪的免疫功能[15]。此外,五味子中蛋白质类、多糖类、纤维素类成分尚可利用生物转化技术制备饲料添加剂、生物肥料等高附加值产品,实现废弃物的转化增效价值。
五味子现代药用主要治疗以ALT升高为主要体征的肝炎等症,现已利用该资源及其所含资源性化学成分研制成中成药制剂如联苯双酯胶囊、五仁醇胶囊等。肝脏在调节身体多种功能上起着至关重要的作用,包括合成、分泌和外源物质的代谢等。CCl4是一种在实验动物研究中用于诱导肝损伤的最为常用的肝毒素[16]。在肝细胞微粒体细胞色素P450的作用下,CCl4发生反应释放三氯甲基自由基、三氯甲基过氧自由基等自由基以及一系列活性氧类物质,肝脏细胞膜、内质网膜等发生脂质过氧化,蛋白质变性,DNA受损,最终导致肝细胞死亡[17]。ALT与AST是诊断肝脏疾病最常用的酶,主要分布于肝脏,肝炎、肝硬化、药物中毒导致肝细胞坏死时,ALT和AST的量就会明显增高,其中ALT是最敏感的肝功能检测指标之一[18]。现代研究发现五味子甲素和五味子醇甲对CCl4所致肝脏损伤具有保护作用[19]。五味子乙素和五味子醇甲对PC12细胞氧化损伤具有保护作用[20]。五味子木脂素类成分中护肝主要活性成分的体外筛选中发现,五味子乙素护肝作用最强[21]。本实验发现,与模型组相比,五味子药渣提取物高剂量组大鼠血清中的ALT、AST明显降低,ALB、TP水平升高。结合肝脏的病理切片,可知五味子药渣提取物对CCl4所致肝损伤大鼠具有治疗作用,对肝脏组织结构病变有一定的修复作用,这与之前的文献报道[4, 19]一致。因此,五味子中的木脂素类成分在发挥着保护肝脏的重要作用,推测其保护作用的机制是通过清除氧自由基、减轻其对DNA的损伤等方面实现的。
肝功能损伤后常常会影响肠黏膜屏障功能的改变,肠内菌群失调。本实验发现,五味子药渣提取物高、低剂量组的益生菌(双歧杆菌和乳酸杆菌)菌落较模型组增加,有害菌(肠球菌和肠杆菌)菌落减少,说明五味子药渣提取物具有增殖益生菌、抑制有害菌过度生长的作用,对CCl4所致肝损伤大鼠的肠道菌紊乱方面有一定的调节作用;此外,结合结肠病理观察,发现五味子药渣提取物高、低剂量组较模型组肠黏膜损伤明显减轻,可见五味子药渣提取物能保护大鼠结肠组织结构的完整性,并可促进肠黏膜损伤恢复,为其资源化利用提供了重要支撑。
| [1] | 金银萍, 焉石, 刘俊霞, 等. 五味子科植物中降三萜类成分及其药理作用研究进展[J]. 中草药 , 2014, 45 (11) :1643–1650. |
| [2] | 周洪玉.生脉注射液药效物质基础研究[D].长春:吉林大学, 2011. |
| [3] | 陈玮莹, 温博贵, 郑瑞明, 等. 五味子对CCl4中毒大鼠肝细胞核基质蛋白和结构的保护作用[J]. 免疫学杂志 , 2006, 22 (4) :455–459. |
| [4] | 齐彦, 郭丽新, 周迎春, 等. 五味子对四氯化碳所致小鼠急性肝损伤的作用研究[J]. 中医药学报 , 2009, 37 (4) :26–27. |
| [5] | 王胜春, 田卫斌, 李剑锋, 等. 五味子及其与丹参灵芝柴胡配伍对慢性肝损伤的影响[J]. 解放军药学学报 , 2001, 17 (1) :4–7. |
| [6] | 王宝莲, 扈金萍, 盛莉, 等. 五味子醇提物的化学-药代-药效指纹图谱研究(英文)[J]. 药学学报 , 2013, 48 (5) :734–740. |
| [7] | 孔华丽, 闫亮, 段惠娟. 五味子醇提取物保肝作用成分分析[J]. 解放军药学学报 , 2010, 26 (1) :27–29. |
| [8] | 李宜轩, 陈建光, 李凤, 等. 北五味子提取物对实验性肝纤维化大鼠肝损伤的保护作用[J]. 吉林大学学报:医学版 , 2014, 40 (2) :285–288. |
| [9] | 蔡晶, 张庆, 肖峰, 等. 五味子乙素对人肝细胞氧化损伤的保护作用[J]. 天然产物研究与开发 , 2014, 26 (5) :766–769. |
| [10] | 雷金艳, 贾建伟, 李秋伟, 等. 鲜生地对肝损伤大鼠肠道生物屏障和机械屏障功能的影响[J]. 山东医药 , 2012, 52 (45) :28–30. |
| [11] | 陶小芳, 沈飞, 宿树兰, 等. 生脉注射液生产过程五味子药渣中资源性物质的分析与循环利用途径探讨[J]. 中草药 , 2015, 46 (18) :2712–2719. |
| [12] | 段金廒. 中药废弃物的资源化利用[M]. 北京: 化学工业出版社, 2013 . |
| [13] | 刘萍, 张海英. 论中药药渣的合理利用[J]. 新疆中医药 , 2002, 20 (6) :49. |
| [14] | 王兵, 王向东, 秦岭, 等. 中药渣固态发酵生产蛋白饲料[J]. 食品与生物技术学报 , 2007, 26 (4) :77–82. |
| [15] | 罗杰, 黄朝翔, 贺晓玉, 等. 蛹虫草菌发酵五味子药渣菌质的免疫活性[J]. 食品工业科技 , 2014, 35 (8) :355–358. |
| [16] | Vuda M, D'Souza R, Upadhya S, et al. Hepatoprotective and antioxidant activity of aqueous extract of Hybanthus enneaspermus against CCl4-induced liver injury in rats[J]. Exp Toxicol Pathol , 2012, 64 (7/8) :855–859. |
| [17] | Abbas A T, El-Shitany N A, Shaala L A, et al. Red sea Suberea mollis Sponge extract protects against CCl4-induced acute liver injury in rats via an antioxidant mechanism[J]. Evid Based Compl Alternat Med , 2014 . DOI:10.1155/2014/745606 |
| [18] | 齐彦, 郭丽新, 周迎春, 等. 枸杞子对四氯化碳所致小鼠急性肝损伤的作用研究[J]. 中医药学报 , 2006, 34 (4) :34. |
| [19] | 张明华, 陈虹, 李灵芝, 等. 五味子甲素和五味子醇甲对四氯化碳所致肝脏损伤的保护作用[J]. 武警医学 , 2002, 13 (7) :395–396. |
| [20] | 王蕾, 唐勇, 黄山. 五味子乙素和五味子醇甲对PC12细胞氧化损伤的保护作用[J]. 中国临床康复 , 2006, 10 (47) :64–67. |
| [21] | 王昌, 张东杰. 五味子木脂素类成分中护肝主活性成分的体外筛选[J]. 黑龙江八一农垦大学学报 , 2010, 22 (2) :80–84. |
 2016, Vol. 47
2016, Vol. 47


