2. 广西农业科学院 葡萄与葡萄酒研究所, 广西 南宁 530007 ;
3. 长沙三福生物科技有限公司, 湖南 长沙 410138
2. Grape and Wine Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, China ;
3. Changsha Sunfull Bio-tech Co., Ltd., Changsha 410138, China
洋常春藤Hedera helix L.为五加科常春藤属常绿藤本植物,原产于欧洲,现在世界范围内广泛种植[1-2]。洋常春藤是一种传统的药用植物,具有很高的药用价值,其药用价值和功效早在19世纪就已经得到很多欧洲国家的认可,现已被《欧洲药典》和《英国药典》收录为植物药,主要用于治疗哮喘、支气管炎等呼吸道系统疾病[3-6]。国外学者尤其是欧洲学者对其药理活性和临床应用进行了深入研究,研究表明其主要活性成分是α-常春藤皂苷、常春藤皂苷C、常春藤皂苷B和常春藤皂苷D等三萜皂苷类化合物[7-9],《欧洲药典》和《英国药典》的收录标准就是春季采集的洋常春藤叶片且干燥后洋常春藤皂苷C的量不低于3%[3]。洋常春藤成功引种到我国已经有很长一段时间,并在全国范围内广泛繁殖应用,但是国内研究仅仅涉及到其繁殖栽培领域,关于其药用价值以及主要功效成分的研究尚未见相关报道[10-12]。在常春藤相关的产品开发方面,现在很多欧洲制药企业都生产以洋常春藤提取物为主要成分的糖浆、片剂、栓剂、滴剂以及泡腾片等成药剂型[1, 13-14]。因此,合理采集洋常春藤药用原材料是生产高质量提取物的基础,并有助于进一步节约生产成本,创造更高的经济效益。本实验在前期对常春藤属植物皂苷类化合物HPLC-UV指纹图谱的研究基础上,进一步研究洋常春藤在1年生长周期内的皂苷类化合物动态变化,探讨其代谢累积规律,以期为洋常春藤药用原料的繁殖栽培、合理采收及其功效成分的进一步利用提供理论基础。
1 材料与仪器 1.1 材料本实验选用长势一致的洋常春藤1年生扦插苗165株,经湖南农业大学观赏园艺教研室鉴定为洋常春藤Hedera helix L.,采样部位为新叶、老叶、茎和根,其中,新叶为当前生长发育期萌发的叶片,叶色浅绿且已完全展开,叶质柔软、薄;老叶为前一个或前几个生长发育期萌发的叶片,叶色深绿,叶质厚硬[15-16]。
1.2 仪器及试剂Shimadzu高效液相色谱仪,包括Shimadzu SPD20A检测器、Shimadzu SIL20A自动进样器、Shimadzu LCSolutions工作站;Milli-Q超纯水仪;梅特勒-托利多电子天平;超声波清洗器;鼓风干燥箱。乙腈(色谱纯),磷酸(色谱纯),超纯水,甲醇(分析纯)。对照品α-常春藤皂苷(批号CTZG20120820)、常春藤皂苷C(批号CTGC20130311)、常春藤皂苷B(批号CTGB20131106)和常春藤皂苷D(批号CTGD20131110),质量分数均≥98%,均购自南京春秋生物工程有限公司。
2 方法与结果 2.1 样品的采集 2.1.1 不同部位代谢累积实验采样方法2014年5月5日随机选择长势良好的洋常春藤植株15株,随机分为3组,每组5株为一个生物学重复。分别采集新叶、老叶、茎、根不同部位样品,洗净后置于60℃鼓风干燥箱中干燥至恒定质量,粉碎后密封备用。
2.1.2 不同生长时期代谢累积实验采样方法选取长势一致的洋常春藤植株150株,随机分为3组,每组50株为一个生物学重复。样品采集时间从2014年6月30日持续到2015年5月31日,每月最后一天采样并处理保存。鉴于洋常春藤只在生长期萌发新叶,因此实验拟定叶片采样方法为每次采样从每株洋常春藤基部采集2片老叶,洗净后置于60℃鼓风干燥箱中干燥至恒定质量,粉碎后密封备用;洋常春藤茎采样方法为每次采样从根颈以上10 cm处剪取全部茎段以保证取样后的植株能发芽成活,洗净后置于60℃鼓风干燥箱中干燥至恒定质量,粉碎后密封备用。
2.2 供试样品溶液的制备将不同的洋常春藤供试样品粉碎后过80目筛。精密称取供试样品粉末1.00 g置于250mL圆底烧瓶中,先加入80%甲醇溶液50mL,水浴回流提取1 h,冷却后过滤,回收滤渣后再加入80%甲醇溶液30 mL,水浴回流提取30 min,冷却后滤过,合并滤液并定容至100 mL,摇匀,经0.45μm微孔滤膜滤过即得供试样品溶液。
2.3 对照品溶液的制备精密称取各对照品适量,分别加甲醇配制成对照品溶液,其质量浓度分别为α-常春藤皂苷2.64 mg/mL、常春藤皂苷C 2.76 mg/mL、常春藤皂苷B1.48 mg/mL、常春藤皂苷D 1.84 mg/mL,4℃保存备用。
2.4 色谱条件[17]色谱柱:Unitary C18色谱柱(250 mm×4.6 mm,5μm);流动相:乙腈(A)-0.2%磷酸水溶液(B);二元高压梯度洗脱:0~5 min,10%~13% A;5~10 min,13%~20% A;10~45 min,20%~50% A;45~50 min,50%~60% A;50~60 min,60%~100% A;检测波长205 nm;体积流量1 mL/min;进样量20μL;柱温25℃。
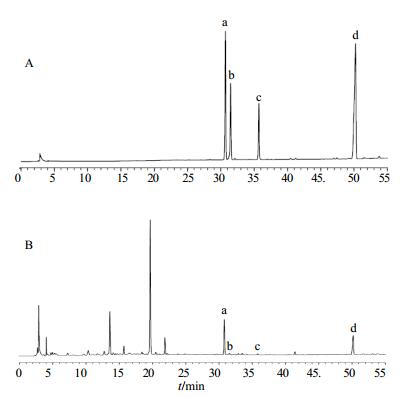
2.5 常春藤皂苷类化合物测定不同常春藤皂苷类化合物测定采用对照品外标法进行计算得出。分别将α-常春藤皂苷、常春藤皂苷C、常春藤皂苷B和常春藤皂苷D对照品溶液梯度稀释成5份,按照“2.4”项下色谱条件进样分析,以质量为横坐标(X),峰面积为纵坐标(Y)进行线性回归,得出各个成分的标准曲线线性回归方程,见表 1,记录色谱图(图 1-A)。
|
|
表 1 4种常春藤皂苷类化合物线性回归方程和线性范围 Table 1 Linear regression analysis parameters of four hederacosides in H. helix |
|
图 1 对照品(A)和样品(B)色谱图 Fig.1 HPLC of reference substances (A) and samples (B) |
待测样品按照“2.2”项下方法制备样品溶液,同样采用“2.4”项下HPLC色谱条件进样检测,记录色谱图及4种常春藤皂苷类化合物的峰面积,通过标准曲线线性回归方程计算其质量分数。在该HPLC色谱条件下,待测样品溶液和对照品溶液基线平稳,各物质成分峰型对称、分离度好,色谱图具有较好的直观表现性和清晰度(图 1-B)。
3 结果与分析 3.1 洋常春藤不同组织部位皂苷类化合物量分析实验通过对洋常春藤新叶、老叶、茎和根4个不同部位的样品材料进行测定,测得常春藤皂苷C、常春藤皂苷D、常春藤皂苷B和α-常春藤皂苷4个主要三萜皂苷的量均有明显差异,根据表 2检测结果可知,不同部位中4种常春藤皂苷类化合物总量为老叶>新叶>茎>根。
|
|
表 2 洋常春藤不同部位4种皂苷类化合物量检测结果(n=3) Table 2 Contents of four saponins in different parts of H. helix (n=3) |
通过对不同部位逐一分析可知,新叶中4种皂苷总量为6.48%,其中α-常春藤皂苷量最高,其次是常春藤皂苷C,而常春藤皂苷B和D量较低。老叶中总量为9.19%,是总量最高的一个部位,但老叶中量最高的是常春藤皂苷C,其次为α-常春藤皂苷且与新叶量相差不大,而常春藤皂苷B和D量略高于新叶。茎中总量略低于新叶,4种皂苷的量为常春藤皂苷C>常春藤皂苷B>α-常春藤皂苷>常春藤皂苷D。根中总量远低于其他3个部位的量,其中量最高的是常春藤皂苷B,也是4个不同部位中最高的,而常春藤皂苷C量仅为0.19%,与其他部位量差异明显。综上可知,洋常春藤中量较高的皂苷类化合物主要是常春藤皂苷C和α-常春藤皂苷,且常春藤皂苷C主要分布在叶片和茎中,而α-常春藤皂苷主要分布在叶片中,根中这2种皂苷类化合物的量非常低甚至未能检出,见表 2。
3.2 洋常春藤不同生长时期皂苷类化合物动态累积分析洋常春藤为常绿藤本植物,根据不同部位皂苷类化合物分析结果,实验选取洋常春藤叶片和茎测定其从2014年6月至2015年5月1年生长周期内皂苷类化合物量动态变化趋势,探索其累积规律,结果详见表 3。
|
|
表 3 不同生长时期不同部位常春藤皂苷类化合物量(n=3) Table 3 Contents of saponins from different parts and different growth stages (n=3) |
3.2.1 叶片中皂苷类化合物动态累积分析
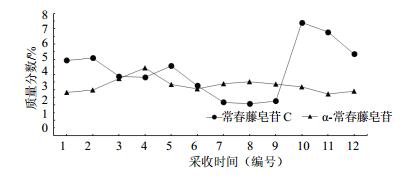
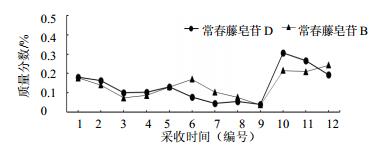
根据表 3结果显示,叶片中量较高的常春藤皂苷C和α-常春藤皂苷在不同的采样时期量有所差异,且动态累积规律也有所不同。首先从叶片中量最高常春藤皂苷C分析可知,在1年的生长时期内其动态累积规律见图 2,叶片中常春藤皂苷C量在2015年3月份为最高,然后在1年的生长周期内呈现逐步下降的主要趋势,在2014年10月份稍微有所升高后急剧下降,到12月份达到最低后一直持续到2015年2月份,然后迅速上升到3月份的最高值。进一步分析其动态累积规律的原因可能与洋常春藤的生长发育周期有关,虽然洋常春藤为常绿藤本植物,但其在1年的周期内会出现2次生长发育期和2次休眠期,2次生长发育期分别是在3月份和10月份,在生长发育期间会萌发新叶和嫩茎,整株长长,而2次休眠期是夏季高温和冬季低温所导致。因此,叶片中常春藤皂苷C的合成和累积主要是在生长发育期,尤其是经过低温休眠后的生长发育期;其次对叶片中量较高的α-常春藤皂苷进行分析,在1年的生长周期内,α-常春藤皂苷量有所变化但变化幅度较小,其动态累积规律见图 2。虽然α-常春藤皂苷的累积规律趋于平缓,但在1年的生长周期内仍然出现了2次量升高的趋势,一次是在2014年9月份,另一次在2015年1月份,这就表明叶片中α-常春藤皂苷量升高是在洋常春藤的2次休眠期,尤其是高温休眠时量最高。同时,对比常春藤皂苷C动态累积规律不难发现,α-常春藤皂苷的规律刚好与其相反,分析其原因可能是这2种次生代谢产物在洋常春藤叶片中所起的生理功能不同而导致;最后,分析叶片中量较低的常春藤皂苷B和常春藤皂苷D可知,它们在1年生长期内的动态累积规律与常春藤皂苷C相似,其原因也可能相同,见图 3。
|
图 2 洋常春藤叶片组织中常春藤皂苷C和α-常春藤皂苷动态累积规律 Fig.2 Dynamic accumulation of hederacoside C andα-hederin in leaves of H. helix |
|
图 3 洋常春藤叶片中常春藤皂苷D和常春藤皂苷B动态累积规律 Fig.3 Dynamic accumulation of hederacoside D and hederacoside B in leaves of H. helix |
3.2.2 茎中皂苷类化合物动态累积分析
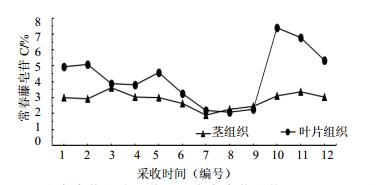
根据表 3结果显示,洋常春藤茎中不同皂苷类化合物在不同的采样时期质量分数及动态累积规律同样有所差异,4种皂苷类化合物整体量与“3.1”项下检测分析结果一致,即常春藤皂苷C量相对较高,其他3种皂苷类化合物量较低。通过分析茎中常春藤皂苷C量变化可知,其在1年生长周期内波动较小,大多数月份常春藤皂苷C的量在3%左右,经过第2个生长发育期后的11月份开始下降,在12月份开始低温休眠时达到最低值后逐步上升至第1个生长发育期的3%左右,总体分析其动态累积规律与叶片中常春藤皂苷C量变化是相辅相成的,见图 4。探析其原因可能是常春藤皂苷C的生物合成主要是在洋常春藤叶片中进行,而茎自身并不合成常春藤皂苷C,主要负责运输和转移;其他3种皂苷类化合物虽然也有各自的累积规律,但因量较低对总量的变化影响不明显。其原因也可能与茎自身不合成皂苷类化合物有关。
|
图 4 洋常春藤叶片和茎组织中常春藤皂苷C动态累积规律 Fig.4 Dynamic accumulation of hederacoside C in leaves and stems of H. helix |
4 讨论
洋常春藤作为药用植物,其质量优劣取决于活性成分的量高低,本研究以常春藤皂苷C、常春藤皂苷B、常春藤皂苷D和α-常春藤皂苷4种三萜皂苷类化合物为主要成分指标,研究了洋常春藤不同部位的量差异。结果表明了常春藤皂苷C和α-常春藤皂苷的量远远高于常春藤皂苷B和常春藤皂苷D,且不同部位药用质量为老叶>新叶>茎>根,进一步证实了《欧洲药典》收录洋常春藤叶片作为植物药的合理性[3]。同时,欧洲药企生产洋常春藤的成药剂型主要以10%或60%的常春藤皂苷C提取物为原料,研发生产常春藤皂苷C提取物并出口欧洲具有良好的市场前景,结合本文研究结果,虽然茎中常春藤皂苷C量低于叶片,但在同一生长周期内,茎的生长量要大于叶片,因此选取洋常春藤的茎作为生产常春藤皂苷C提取物主要原料,既符合欧洲制药企业所需的原料标准[1, 3, 14],又能进一步降低成本提高产品利润。
合理采收也是影响药用植物质量和产量的重要因素,确定最佳采收时期的标准就是分析比较有效成分的累积量和不同生长发育阶段的动态累积规律[18]。本研究探析了洋常春藤叶片和茎中4种皂苷类化合物的代谢累积变化规律,总结得出洋常春藤叶片的最适宜采收时期为3月份开始的生长发育期,而茎的适宜采收时期则可以从3月份开始的生长发育期持续到低温休眠开始前的11月份。该结论与《欧洲药典》和《英国药典》记录的在春季采收洋常春藤叶片入药的标准相符合[3],为高质量药用洋常春藤原料的采收及可持续利用提供理论基础。
| [1] | Landgrebe H, Matusch R, Marburg F R, et al. Effectiveness and use of an old medicinal plant[J]. Pharm Zeitung , 1999, 35 (5) :11–15. |
| [2] | Virginia V, Pablo V. Quantitative morphology and species delimitation under the general lineage concept: optimization for hedera (Araliaceae)[J]. Am J Bot , 2010, 97 (9) :1555–1573. DOI:10.3732/ajb.1000115 |
| [3] | European Pharmacopoeia [S]. 2012. |
| [4] | Fazio S, Pouso J, Dolinsky D, et al. Tolerance, safety and efficacy of Hedera helix extract in inflammatory bronchial diseases under clinical practice conditions: A prospective, open, multicentre postmarketing study in 9657 patients[J]. Phytomedicine , 2009, 16 (1) :17–24. DOI:10.1016/j.phymed.2006.05.003 |
| [5] | Häberlein H, Lis K, Chodorowska G, et al. Hedera helix-mechanizm działania potwierdzony badaniami biologicznymii biofizycznymi na modelu komórkowym[J]. Przewodnik Lek , 2008, 103 (1) :255–256. |
| [6] | Ute C, Bertram O, Petr A. Acute bronchitis therapy with ivy leaves extracts in a two-arm study. A double-blind, randomised study vs. an other ivy leaves extract[J]. Phytomedicine , 2011, 18 (13) :1105–1109. DOI:10.1016/j.phymed.2011.06.014 |
| [7] | Lutsenko Y, Bylka W, Matlawska I, et al. Hedera helix as a medicinal plant[J]. Herba Pol , 2010, 56 (1) :83–96. |
| [8] | Mendel M, Chłopecka M, Dziekan N, et al. Participation of extracellularcal ciumin a-hederin-induced contractions of ratisolated stomach strips[J]. J Ethnopharm , 2013, 146 :423–426. DOI:10.1016/j.jep.2012.12.023 |
| [9] | Mendel M, Chłopecka M, Dziekan N, et al. The effect of the whole extract of common ivy (Hedera helix) leaves and selected active substances on the motoric activity of rat isolated stomach strips[J]. J Ethnopharm , 2011, 134 (3) :796–802. DOI:10.1016/j.jep.2011.01.036 |
| [10] | 赵茜. 欧洲常春藤南京地区引种试验[J]. 林业科技开发 , 2008, 22 (4) :115–116. |
| [11] | 陈爱莉, 蔡汉.常春藤属植物种质资源[A]//第三届中国花卉产业高峰论坛[C].杭州:中国花卉协会, 2006. |
| [12] | 王洪良, 肖万里, 李刚. 盆栽常春藤工厂化栽培[J]. 中国花卉园艺 , 2009 (12) :26–27. |
| [13] | Khdair A, Mohammad M K, Tawaha K, et al. A validated RP HPLC-PAD method for the determination of hederacoside C in Ivy-Thyme cough syrup[J]. Inter J Anal Chem , 2010, 2010 (10) :1–5. |
| [14] | Stauss-Grabo M, Atiye S, Warnke A, et al. Observational study on the tolerability and safety of film-coated tablets containing ivy extract (Prospan® Cough Tablets) in the treatment of colds accompanied by coughing[J]. Phytomedicine , 2011, 18 (6) :433–436. DOI:10.1016/j.phymed.2010.11.009 |
| [15] | 谢红旗, 刘发宝, 杨星星, 等. 葡萄植株中白藜芦醇及葡萄素量动态积累规律研究[J]. 天然产物研究与开发 , 2012, 24 :1079–1083. |
| [16] | Demirci B, Goppel M, Demirci F, et al. HPLC profiling and quantification of active principles in leaves of Hedera helix L[J]. Pharmazie , 2004, 59 (10) :770–774. |
| [17] | 孙化鹏, 阮琴妹, 吴易雄, 等. 洋常春藤及其栽培品种的HPLC-UV指纹图谱和质量评价研究[J]. 中草药 , 2015, 46 (18) :2794–2799. |
| [18] | 张春艳, 李国辉, 李天祥, 等. 不同生长期杠柳各部位活性成分的累积变化[J]. 中草药 , 2012, 43 (12) :2508–2511. |
 2016, Vol. 47
2016, Vol. 47


