2. 湖南生物机电职业技术学院 藤本植物研究所, 湖南 长沙 410004
2. Research Institute of Vine Plant, Hunan Biological and Electromechanical Polytechnic, Changsha 410004, China
常春藤属Hedera L. 植物是五加科多年生常绿攀援藤本植物,原产于欧洲、亚洲和北非等地。常春藤属植物品种和变种很多,其中洋常春藤Hedera helix L. 已经被欧洲药典和英国药典收录为植物药,用于治疗哮喘、支气管炎等呼吸道系统疾病[1, 2, 3];中华常春藤H. nepalensis K. Koch. var. sinensis(Tobl.) Rehd,作为我国一种传统的药用植物,也有2 000多年的应用历史,在很多中医著作中都详细记载了以其为主的中医选方[4];此外,还有加拿列常春藤H. canariensis K. Koch、革叶常春藤H. colchica K. Koch和海波尼亚常春藤H. haiboniya K. Koch等多个品种及其变种[5]。常春藤属植物作为一种传统的药用植物,其药用价值和功效已经被欧洲国家所接受[6, 7],现阶段的研究表明常春藤属植物主要功能成分是皂苷类化合物,其中量较高的是常春藤皂苷C和α-常春藤皂苷[8, 9],且欧洲药典和英国药典收录常春藤作为植物药,主要评价标准就是常春藤干燥叶片中常春藤皂苷C不低于3%[1]。
虽然常春藤属植物品种和变种很多,但大多数品种作为观赏植物在我国境内已经引种栽培成功,并且有很多品种已经进行商品化繁殖栽培[10, 11],然而国内外却没有对它们的药用质量以及主要功能成分进行统一的比较评价。因此,充分利用国内丰富的常春藤资源,开展常春藤属植物药用价值的研究具有非常重要的意义。鉴于欧洲药典和英国药典收录洋常春藤为植物药的主要部位是叶片[1],本研究通过收集国内已经商品化繁殖的洋常春藤品和与其相近的加拿列常春藤种资源的新鲜叶片,利用HPLC建立一种可靠、稳定、重现性好的常春藤皂苷类化合物指纹图谱,并通过外标法计算常春藤皂苷C和α-常春藤皂苷的量,结合统计学分析方法为分析评价洋常春藤及其栽培品种的药用质量提供参考依据[12, 13, 14]。
1 材料与仪器 1.1 材料样品在2014年3月采集于湖南、山东、江苏、上海等地,经湖南农业大学钟晓红教授鉴定为洋常春藤及其栽培品的新鲜叶片,洗净后置于60 ℃鼓风干燥箱中干燥至恒定质量,粉碎后密封备用。样品信息详见表1。
| 表1 样品信息表 Table1 Samples infromation |
Shimadzu 高效液相色谱仪,包括Shimadzu SPD20A检测器、Shimadzu SIL20A自动进样器、Shimadzu LCSolutions工作站;Milli-Q超纯水仪;电子天平;超声波清洗器;鼓风干燥箱。
1.3 试剂乙腈(色谱纯),磷酸(色谱纯),超纯水,甲醇(分析纯)。对照品常春藤皂苷C(批号CTGC20130311)和α-常春藤皂苷(批号CTZG20120820)均购自南京春秋生物工程有限公司,质量分数均大于98%。
2 方法 2.1 供试品溶液的制备将常春藤干燥叶片粉碎后过80目筛。精密称取叶片粉末1.00 g置于250 mL圆底烧瓶中,先加入80%甲醇50 mL,回流提取1 h,冷却后滤过,回收滤渣后再加入80%甲醇30 mL,回流提取30 min,冷却后滤过,合并滤液并定容至100 mL,摇匀,0.45 μm微孔滤膜滤过即得供试品溶液。
2.2 对照品溶液的制备精密称取各对照品适量,分别加甲醇配制成质量浓度为2.04 mg/mL常春藤皂苷C和2.16 mg/mL α-常春藤皂苷对照品溶液,4 ℃保存备用。
2.3 色谱条件色谱柱:Unitary C18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.2%磷酸水溶液(B);二元高压梯度洗脱:0~5 min,10%~13% A;5~10 min,13%~20% A;10~45 min,20%~50% A;45~50 min,50%~60% A;50~60 min,60%~100% A。检测波长205 nm;体积流量1 mL/min;进样量20 μL;柱温25 ℃。
2.4 指纹图谱方法学考察 2.4.1 精密度试验取同一供试品溶液(S1),按照“2.3”项下色谱条件连续进样6次,检测指纹图谱,利用中国药典委员会主持开发的“中药色谱指纹图谱相似度评价系统(2004A)”进行相似度评价,结果相似度均>0.99,表明仪器精密度良好,符合指纹图谱的要求。
2.4.2 稳定性试验取同一供试品溶液(样品S1),按照“2.3”项下色谱条件分别在0、3、6、12、24、48 h进样,检测指纹图谱,结果显示各色谱峰的相对保留时间及相对峰面积无明显变化,用“中药色谱指纹图谱相似度评价系统(2004A)”进行相似度评价,结果相似度均>0.99,表明供试品溶液在48 h内稳定,符合指纹图谱的要求。
2.4.3 重复性试验取同一供试品粉末6份(样品S1),按“2.1”项下方法制备供试品溶液,按照“2.3”项下色谱条件进样检测,用“中药色谱指纹图谱相似度评价系统(2004A)”进行相似度评价,结果相似度均>0.99,表明该方法重现性好,符合指纹图谱的要求。
2.5 常春藤皂苷类化合物指纹图谱的建立分别取17份洋常春藤及其栽培品种样品粉末,按“2.1” 项下方法制备供试品溶液,按照“2.3”项下色谱条件进样分析,记录图谱。利用“中药色谱指纹图谱相似度评价软件”生成常春藤皂苷类化合物HPLC指纹图谱,标定了12个共有指纹峰,结果见图1。其中利用HPLC测定并结合对照品加样,标定了常春藤皂苷C和α-常春藤皂苷所对应的成分,即峰7为常春藤皂苷C的色谱峰,峰12为α-常春藤皂苷的色谱峰,见图2。
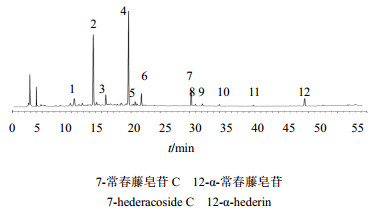 | 图1 常春藤属植物皂苷类化合物HPLC色谱图 Fig.1 HPLC of saponins from plants of Hedera L. |
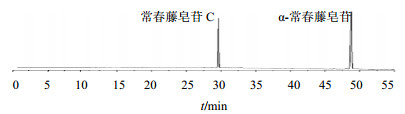 | 图2 常春藤属植物皂苷对照品色谱图 Fig.2 HPLC of reference substances of saponins from plants of Hedera L. |
为分析不同样品中标定成分的质量分数,对各标定成分进行线性回归分析。分别将常春藤皂苷C和α-常春藤皂苷对照品溶液梯度稀释成5份,按照“2.3”项下色谱条件进样分析,以质量为横坐标(X),峰面积为纵坐标(Y)进行线性回归,回归方程为常春藤皂苷C:Y=4×106 X+117 439,线性范围为2.5~41.0 μg,r为0.999 3;α-常春藤皂苷:Y=9×106 X+7 399.1,线性范围为2.7~43.0 μg,r为0.999 9。
3 结果与分析 3.1 常春藤皂苷类化合物指纹图谱相似度计算与评价采用中国药典委员会“中药色谱指纹图谱相似度评价系统(2004A)”比较17份样品的色谱图和计算相对保留时间,设置S1为参照指纹图谱,采用多点校正后进行自动匹配,得到对照图谱(R),结果见图3。
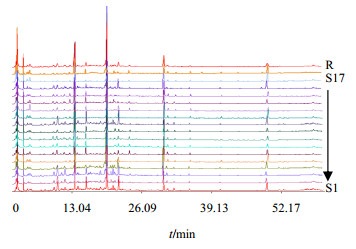 | 图3 17份常春藤属植物样品HPLC-UV指纹图谱 Fig.3 HPLC-UVFingerprint of 17 samples from Hedera L. |
17份样品图谱的相似度是以R为基准,取平均数计算的方法得出,其相似度计算结果分别为0.988、0.962、0.926、0.907、0.941、0.937、0.956、0.969、0.955、0.976、0.835、0.958、0.895、0.798、0.992、0.715、0.856。由此结果分析可知,17份样品色谱图中S11、S13、S14、S16和S17的相似度结果低于0.9,其他样品相似度较高,该结果表明不同品种的洋常春藤及其栽培品种叶片中皂苷类化合物成分类型基本相同,但各成分量之间有差异,这种差异从直观上很难区分开来。因此,在分析评价其药用质量时需要进一步从量化指标以及采用统计学分析方法来比较分析。
3.2 聚类分析将17份样品HPLC图谱中12个共有峰的峰面积值标准化,组成17×12阶原始数据矩阵,运用SPSS 19.0数据统计软件,选用组间连接聚类方法,利用余弦法作为样品的测度,对其进行系统聚类分析,聚类结果见图4。
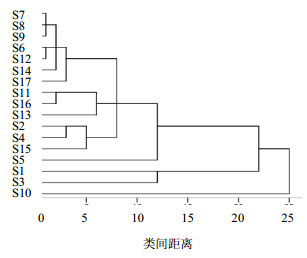 | 图4 17份常春藤属植物样品聚类分析图 Fig.4 Cluster analysis of 17 samples from Hedera L. |
由树状聚类图分析可知,首先当类间距离在10~15时,可以聚为3类,S10为一类,S1、S3为一类,其他为一类;其次当类间距离在5~10之间时,S6、S7、S8、S9、S12、S14、S17为一类,S11、S13、S16为一类,S2、S4、S15为一类。根据以上聚类结果进一步分析可知,17份样品的差异主要体现为地域和品种2大类,且地域要比品种差异明显,如S1、S5、S10为不同产地的洋常春藤叶片样品,它们各属一类;S6、S7、S8、S9均采自山东潍坊,它们聚为一类;而S15作为与其他样品同属不同种的单一样品却没有单独聚为一类,可能是因为S15样品中所含皂苷类化合物的种类与含量均与洋常春藤及其栽培品种相同且没有太大差异而导致的。
3.3 主成分分析主成分分析是综合评价药材品质的一种统计方法,采用SPSS 19.0数据统计软件对17份样品的12个共有峰峰面积进行主成分分析,由表2分析结果可以看出,第1成分的贡献率为36.954%,第2成分的贡献率为29.077%,第3成分的贡献率为12.441%,第4个成分的贡献率为11.734%,前4个成分的累计贡献率已经达到90.205%,可见前4 个成分足以说明该数据的变化趋势,完全符合主成分分析的要求,故取前4个主成分作为数据分析的有效成分。
| 表12 4个主成分的特征值及贡献率 Table12 Eigenvalues and contribution of four principal components |
进一步通过将各特征向量中心化和标准化后,17份样品主成分得分如图5所示,第1主成分得分最高的为S1和S3,第2主成分得分最高的为S10,第3主成分得分最高为S5,第4主成分得分最高为S5。因此,通过以上分析结果可以得出4个主成分得分最高的分别是来源于不同产地的洋常春藤叶片,这就说明虽然不同品种洋常春藤及其栽培品种叶片中皂苷类化合物成分类型相似,但从综合药用质量评价,还是洋常春藤叶片的药材品质最佳,这也与聚类分析中不同产地的洋常春藤叶片样品分别聚为一类相对应。
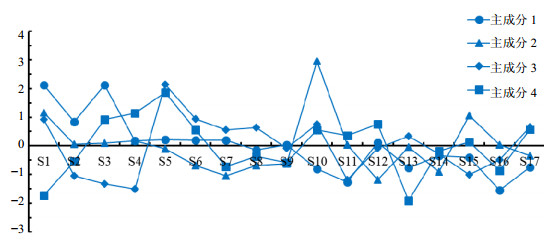 | 图5 17份洋常春藤属植物样品4个主成分的排序坐标图 Fig.5 Coordinate diagram of four principal components in 17 samples from Hedera L. |
常春藤皂苷C和α-常春藤皂苷是常春藤叶片中量较高、药理活性好的2种皂苷类化合物,很多欧洲学者都对它们的药理活性进行了相关研究,欧洲药典和英国药典收录洋常春藤作为植物药,它们也被列为主要检测指标[1, 6, 8]。本研究采用对照品外标法对17份常春藤属植物样品中常春藤皂苷C和α-常春藤皂苷的量进行检测,检测结果见表3。
| 表3 17份常春藤属植物样品中常春藤皂苷C和α-常春藤皂苷量测定结果 Table3 Determination of hederacoside C and α-hederin in 17 samples from Hedera L. |
通过结果分析可以看出,17份常春藤属样品中常春藤皂苷C的量差异并不明显,样品S4量最高为6.58%,而量最低的S16也达到5.06%,完全符合欧洲药典和英国药典中常春藤皂苷C量不低于3%的入药指标。另外各个样品之间虽然α-常春藤皂苷的量也存在差异,但却无明显的变化规律,深入探讨其原因可能是因为常春藤皂苷C和α-常春藤皂苷在生物合成过程中存在紧密联系,α-常春藤皂苷可能是常春藤皂苷C生物合成的前体化合物,并且该结果与欧洲药典和英国药典没有同时把α-常春藤皂苷的量作为收录标准相符合。由此说明,从常春藤皂苷C量这一单一指标来看,国内引种栽培或商品化繁殖的常春藤属植物药用质量与洋常春藤非常接近。
4 讨论常春藤作为植物药已被研制生产为糖浆、片剂、栓剂、滴剂以及泡腾片等成药剂型[6],生产常春藤提取物并进入欧洲市场有着良好的发展前景。筛选高品质常春藤药材原料是常春藤提取物系列产品开发及产业化实施进程的重中之重。本研究充分利用国内丰富的常春藤属植物资源,参考欧洲药典和英国药典的评价指标,重点考察了洗脱梯度对各组分的影响,结果表明流动相为乙腈(A)-0.2%磷酸水溶液(B),二元高压梯度洗脱为0~5 min,10%~13% A;5~10 min,13%~20% A;10~45 min,20%~50% A;45~50 min,50%~60% A;50~60 min,60%~100% A时,基线平稳,各组分峰峰型良好,分离度好。
综合比较聚类分析和主成分分析结果以及常春藤皂苷C和α-常春藤皂苷的检测结果,选用的17份常春藤属植物材料中,不同地区的洋常春藤药用质量要略高于其他品种。当然,国内还有很多本研究过程中未能收集到的常春藤属植物的品种资源,如中华常春藤、革叶常春藤及加那列常春藤等,本研究为进一步分析评价它们的药用价值及皂苷类化合物测定奠定基础。
| [1] | European Pharmacopoeia[S]. 2012. |
| [2] | Fazio S J, Pouso D, Dolinsky, et al. Tolerance, safety and efficacy of Hedera helix extract in inflammatory bronchial diseases under clinical practice conditions: A prospective, open, multicentre postmarketing study in 9657 patients[J]. Phytomedicine, 2009, 16(1): 17-24. |
| [3] | Häberlein H K, Lis G, Chodorowska, et al. Hedera helix-mechanizm działania potwierdzony badaniami biologicznymii biofizycznymi na modelu komórkowym[J]. Przewodnik Lekarza, 2008, 103(1): 255-256. |
| [4] | 童 星. 中华常春藤中皂苷类成分和挥发油分离分析研究[D]. 长沙: 中南大学, 2007. |
| [5] | 陈爱莉, 蔡 汉. 常春藤属植物种质资源[A]//中国花卉协会. 第三届中国花卉产业高峰论坛论文集[C]. 浙江:中国花卉协会, 2006. |
| [6] | Lutsenko, BylkaY W, Matlawska I, et al. Hedera helix as a medicinal plant[J]. Herba Polonica, 2010, 56(1): 83-96. |
| [7] | Hartmut L, Rudolf M, Marburg I, et al. Effectiveness and use of an old medicinal plant[J]. Pharm Zeitung, 1999, 35: 11-15. |
| [8] | Sieben A L, Prenner T, Sorkalla A, et al. α-Hederin, but not hederacoside C and hederagenin from Hedera helix, affects the binding behavior, dynamics, and regulation of β2-adrenergicreceptors[J]. Biochemistry, 2009, 48(15): 3477-3482. |
| [9] | Gepdiremen A, Mshvildadze V, Süleyman H, et al. Acute anti-inflammatory activity of four saponins isolated from ivy: alpha-hederin, hederasaponin-C, hederacolchiside-E and hederacolchiside-F in carrageenan-induced rat paw edema[J]. Phytomedicine, 2005, 12(6/7): 440-444. |
| [10] | 赵 茜. 欧洲常春藤南京地区引种试验[J]. 林业科技开发, 2008, 22(4): 115-116. |
| [11] | 赵和文, 崔金腾, 王 杰, 等. 干旱胁迫下常春藤响应的生理生化机制[J]. 中国农学通报, 2013, 29(7): 12-19. |
| [12] | 魏 娟, 曾金祥, 毕 莹, 等. 吴茱萸水溶性成分HPLC指纹图谱与化学模式识别研究[J]. 中草药, 2013, 44(23): 3400-3405. |
| [13] | 何新荣, 古 今, 刘 萍. 车前子指纹图谱研究及其2种指标成分的测定[J]. 中草药, 2013, 44(21): 3053-3056. |
| [14] | 宋江峰, 李大婧, 刘春泉, 等. 甜糯玉米软罐头主要挥发性物质主成分分析和聚类分析[J]. 中国农业科学, 2010, 43(10): 2122-2131. |
 2015, Vol. 46
2015, Vol. 46


