2. 塔里木大学生命科学学院 新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室, 新疆 阿拉尔 843300
2. Key Laboratory of Protection and Utilization of Biological Resources in Tarim Basin, Xinjiang Production & Construction Corps College of Life Science, Tarim University, Alar 843300, China
藏药蓝玉簪龙胆Gentianae Vettchiorum cum Radice Herba为龙胆科(Gentianaceae)龙胆属Gentiana (Tourn.) L. 植物蓝玉簪龙胆Gentiana veitchiorum Hemsl. 的干燥地上部分,藏语学名为“邦见温保”[1-2]。其主要分布于西藏、四川、青海等地区,海拔3 200~4 700 m的高山草地或林地边。该药具有清热解毒功效,主治肝炎黄疸、咽喉肿痛、目赤淋浊。现代药理研究表明蓝玉簪龙胆可减轻肝肺部炎症,保护肝肺功能,抑制肝肺纤维化的形成[3-4],并且对慢性支气管炎有较好的改善效果[5]。本课题组前期进行了蓝玉簪龙胆提取物对CCl4致大鼠肝损伤的实验,结果表明该提取物具有明显的护肝效果[6]。杨红澎等[7-8]从蓝玉簪龙胆花中分离鉴定了落干酸、熊果酸、2α-羟基熊果酸、远志脑苷、龙胆苦苷、异荭草素-3′-甲醚、异牡荆苷、异金雀花素和异荭草素等化合物。为进一步明确蓝玉簪龙胆中的化学成分,本实验采用现代色谱分离技术,从50%乙醇提取物中分离得到6个化合物,分别鉴定为5,7,3′,4′-四羟基黄酮-6-C-β-D-吡喃葡萄糖基-4′-O-β-D-吡喃葡萄糖基- (1→6)-β-D-吡喃葡萄糖苷(5,7,3′,4′-tetrahydroxyl flavone-6-C-β-D-glucopyranosyl-4′-O-β-D-glucopyranosyl-(1→6)-β-D-glucopyranoside,1)、异荭草素(isoorientin,2)、异牡荆苷(isovitexin,3)、异金雀花素(isoscoparine,4)、异荭草素-4′-O-葡萄糖苷(isoorientin-4′-O-glucoside,5)和异皂草苷(isosaponarin,6)。其中化合物1为新化合物,化合物5和6为首次从该植物中分离得到。
1 仪器与药品中压液相色谱仪(Büchi公司),Waters 2767制备型高效液相色谱仪(Waters公司),500 MHz核磁共振仪(Bruck公司);负离子高分辨电喷雾飞行时间质谱(Waters公司),Evolution 201型紫外可见分光光度仪(Thermo公司),红外光谱仪(Thermo公司),柱色谱硅胶(200~300目)为青岛海洋化工厂产品,液相用溶剂为色谱甲醇,水为超纯水。
藏药蓝玉簪龙胆采于四川省红原县,由四川大学张浩教授鉴定为蓝玉簪龙胆Gentiana veitchiorum Hemsl.,标本(201509012)现保藏于西南民族大学第一实验楼标本室。
2 提取分离干燥的蓝玉簪龙胆地上部分5.0 kg粉末,用50%乙醇浸泡3 d后热回流提取3次,减压浓缩后加3倍体积乙醇沉淀,上清液减压浓缩得浸膏210.0 g,取40.0 g浸膏用硅胶柱色谱分离,以二氯甲烷-甲醇溶剂系统(10∶1→3∶1)进行梯度洗脱,得组分IA~ID。其中,IC(14.5 g)经中压液相色谱,甲醇-水(20%、30%、70%、100%甲醇)梯度洗脱,20%~30%洗脱部位合并得ICa(3.0 g);70%~100%洗脱部位合并得ICb(5.0 g);ICa和ICb分别进行高效液相色谱制备,流动相为含0.1%冰乙酸的30%甲醇水溶液(A)-100%甲醇(B)溶剂系统,按如下程序洗脱:0~90 min,100%~79%A;90~120 min,79%~70%A,体积流量8mL/min;检测波长254 nm;得到化合物1~6。
3 结构鉴定化合物1:黄色无定形粉末,HR-ESI-Q-TOF-MS显示准分子离子峰为m/z: 771.197 8 [M-H]− (C33H39O21,计算值771.198 4),确定分子式为C33H40O21。UV λmax带I为336 nm,带II为274 nm;IR谱显示有羟基(3 414 cm−1)和羰基(1 649 cm−1)的伸缩振动,有苯环的骨架振动峰(1 615、1 518、1 467 cm−1);10%硫酸乙醇显亮黄色,高温加热后显黑色,提示该化合物为黄酮苷类化合物。1H-NMR谱(表 1)中显示有2个芳氢单峰信号δ 6.79 (1H,s) 与6.52 (1H,s),1个ABX系统 [δ 7.47 (1H,d,J = 2.0 Hz),7.50 (1H,dd,J = 8.5,2.0 Hz),7.41 (1H,d,J = 8.5 Hz)];13C-NMR谱(表 1)显示有33个碳信号,包括1个羰基碳信号(δC 182.2),14个芳碳信号(其中6个被氧取代,δC147.3~165.0);结合HSQC谱显示有3组糖端基碳氢信号 [δC 73.7与δH 4.60 (1H,d,J = 9.5 Hz),δC 101.8与δH 4.85 (1H,d,J = 7.5 Hz),δC 103.8与δH 4.25 (1H,d,J = 7.5 Hz)],提示该化合物是黄酮的三糖苷。其中2个糖基以氧苷键相连;另1个糖基以碳苷键相连,该糖及苷元的13C-NMR谱与异荭草素相似[9-11]。在HMBC谱(图 1)中,δH 4.60 (H-1″) 与δC 161.1 (C-5),109.5 (C-6),165.0 (C-7) 相关,表明碳苷键位于C-6位;δH 4.85 (H-1′′′) 与δC 147.3 (C-3′),148.9 (C-4′),116.7 (C-5′) 相关,表明第2个糖基连于C-4′位;第3个糖基的端基氢δH 4.25 (H-1′′′′) 与δC 68.9 (C-6′′′) 相关,表明第3个糖基连于第2个糖的C-6′′′位,δH 3.57 (H-6′′′) 与δC 103.8 (C-1′′′′) 的HMBC相关关系以及δH 3.57 (H-6′′′) 和4.25 (H-1′′′′) 的ROESY关系(图 1)进一步证实了这种连接方式;13C-NMR谱结合HSQC和HMBC谱归属糖的信号表明3个糖基均是吡喃葡萄糖;3个葡萄糖基的端基质子的3J偶合常数分别为7.5、7.5、9.5 Hz,表明葡萄糖基均是β构型。综上所述,化合物1为5,7,3′,4′-四羟基黄酮-6-C-β-D-吡喃葡萄糖基- 4′-O-β-D-吡喃葡萄糖基-(1→6)-β-D-吡喃葡萄糖苷,命名为异荭草素-4′-二葡萄糖苷。
|
|
表 1 化合物1的1H-NMR和13C-NMR数据 (500/125 MHz,DMSO-d6) Table 1 1H-NMR and 13C-NMR data of compound 1 (500/125 MHz,DMSO-d6) |
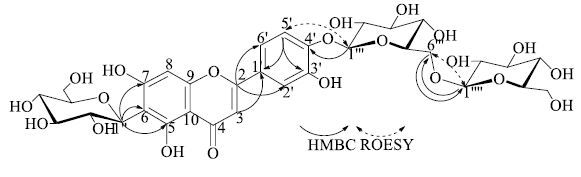
|
图 1 化合物1的结构和主要HMBC和ROESY关系 Fig.1 Structure of compound 1 and its keyHMBC and ROESY correlations |
化合物2:黄色无定形粉末。HR-ESI-Q-TOF-MS m/z: 447.092 5 [M-H]−。1H-NMR (500 MHz,CD3OD) δ: 7.43 (1H,dd,J = 7.8,2.0 Hz,H-6′),7.41 (1H,d,J = 2.0 Hz,H-2′),6.90 (1H,d,J = 7.8 Hz,H-5′),6.69 (1H,s,H-3),6.50 (1H,s,H-8),4.60 (1H,d,J = 10.0 Hz,H-1″);13C-NMR (125 MHz,CD3OD) δ: 163.7 (C-2),102.8 (C-3),181.9 (C-4),160.7 (C-5),108.9 (C-6),163.3 (C-7),93.6 (C-8),156.3 (C-9),103.4 (C-10),121.5 (C-1′),113.3 (C-2′),145.8 (C-3′),149.8 (C-4′),116.1 (C-5′),119.0 (C-6′),73.1 (C-1″),70.3 (C-2″),79.0 (C-3″),70.7 (C-4″),81.6 (C-5″),61.5 (C-6″)。以上数据与文献报道一致[9],故确定化合物2为异荭草素。
化合物3:黄色无定形粉末。HR-ESI-QTOF-MS m/z: 431.097 6 [M-H]−。1H-NMR (500 MHz,CD3OD) δ: 7.66 (2H,d,J = 8.0 Hz,H-2′,6′),6.78 (2H,d,J = 8.0 Hz,H-3′,5′),6.42 (1H,s,H-3),6.33 (1H,s,H-8),4.79 (1H,d,J = 10.0 Hz,H-1″);13C-NMR (125 MHz,CD3OD) δ: 164.7 (C-2),102.4 (C-3),182.5 (C-4),160.6 (C-5),107.7 (C-6),163.4 (C-7),93.9 (C-8),157.2 (C-9),103.8 (C-10),121.6 (C-1′),128.0 (C-2′),115.6 (C-3′),161.3 (C-4′),115.6 (C-5′),128.0 (C-6′),73.9 (C-1″),71.2 (C-2″),78.7 (C-3″),70.4 (C-4″),81.2 (C-5″),61.5 (C-6″)。以上数据与文献报道一致[7],故确定化合物3为异牡荆苷。
化合物4:黄色粉末。1H-NMR (500 MHz,CD3OD) δ: 7.33 (1H,d,J = 7.0 Hz,H-6′),7.27 (1H,s,H-2′),6.86 (1H,d,J = 7.0 Hz,H-5′),6.45 (1H,s,H-3),6.35 (1H,s,H-8),4.92 (1H,d,J = 10.0 Hz,H-1″),3.84 (3H,s,-OMe);13C-NMR (125 MHz,CD3OD) δ: 164.3 (C-2),102.7 (C-3),182.4 (C-4),160.5 (C-5),108.9 (C-6),163.3 (C-7),93.9 (C-8),157.1 (C-9),103.8 (C-10),121.9 (C-1′),108.9 (C-2′),147.9 (C-3′),150.6 (C-4′),115.3 (C-5′),120.2 (C-6′),73.9 (C-1″),70.4 (C-2″),78.7 (C-3″),71.3 (C-4″),81.2 (C-5″),61.4 (C-6″),58.2 (-OMe)。以上数据与文献报道一致[10],故确定化合物4为异金雀花素。
化合物5:黄色无定形粉末。HR-ESI-QTOF-MS m/z: 609.145 7 [M-H]−。1H-NMR (500 MHz,DMSO- d6) δ: 7.50 (1H,d,J = 8.0,2.0 Hz,H-6′),7.49 (1H,d,J = 2.0 Hz,H-2′),7.24 (1H,d,J = 8.0 Hz,H-5′),6.79 (1H,s,H-3),6.52 (1H,s,H-8),4.60 (1H,d,J = 9.5 Hz,H-1″),4.89 (1H,d,J = 7.0 Hz,H-1′′′);13C-NMR (125 MHz,DMSO-d6) δ: 163.2 (C-2),104.3 (C-3),182.2 (C-4),161.1 (C-5),109.5 (C-6),165.0 (C-7),94.3 (C-8),156.8 (C-9),103.6 (C-10),125.2 (C-1′),114.0 (C-2′),147.6 (C-3′),149.0 (C-4′),116.5 (C-5′),118.8 (C-6′),73.6 (C-1″),70.6 (C-2″),79.5 (C-3″),70.2 (C-4″),82.0 (C-5″),61.9 (C-6″),101.7 (C-1′′′),71.1 (C-2′′′),76.4 (C-3′′′),70.2 (C-4′′′),77.8 (C-5′′′),61.2 (C-6′′′)。以上数据与文献报道一致[11],故确定化合物5为异荭草素-4′-O-β-D-吡喃葡萄糖苷。
化合物6:黄色无定形粉末。HR-ESI-QTOF-MS m/z: 593.150 4 [M-H]−。1H-NMR (500 MHz,DMSO- d6) δ: 8.03 (2H,d,J = 7.5 Hz,H-2′,6′),7.19 (2H,d,J = 8.5 Hz,H-3′,5′),6.86 (1H,s,H-3),6.52 (1H,s,H-8),5.03 (1H,d,J = 5.6 Hz,H-1′′′),4.60 (1H,d,J = 9.5 Hz,H-1″);13C-NMR (125 MHz,DMSO-d6) δ: 163.1 (C-2),104.2 (C-3),182.3 (C-4),160.7 (C-5),109.6 (C-6),163.1 (C-7),94.4 (C-8),156.9 (C-9),103.5 (C-10),124.5 (C-1′),128.6 (C-2′),117.1 (C-3′),161.1 (C-4′),117.1 (C-5′),128.6 (C-6′),73.7 (C-1″),70.7 (C-2″),79.5 (C-3″),70.1 (C-4″),82.0 (C-5″),61.9 (C-6″),100.4 (C-1′′′),71.1 (C-2′′′),77.0 (C-3′′′),70.1 (C-4′′′),77.6 (C-5′′′),61.1 (C-6′′′)。以上数据与文献报道一致[12],故确定化合物6为异皂草苷。
| [1] | 杨永昌. 藏药志[M]. 西宁: 青海人民出版社, 1991 . |
| [2] | 帝玛尔·丹增彭措. 晶珠本草[M]. 上海: 上海科学技术出版社, 1986 . |
| [3] | 侯颖, 曹蔚, 李涛, 等. 蓝玉簪颗粒治疗小鼠慢性支气管炎作用机理的研究[J]. 第四军医大学学报 , 2008, 29 (14) :1331–1333. |
| [4] | 李鹏, 唐坚, 李安, 等. 蓝玉簪龙胆对二甲基亚硝胺诱导的肝纤维化的治疗研究[J]. 时珍国医国药 , 2008, 19 (7) :1565–1567. |
| [5] | 耿铮, 李旭波, 侯颖, 等. 蓝玉簪龙胆治疗慢性支气管炎小鼠有效组分研究[J]. 中药材 , 2010, 33 (3) :428–431. |
| [6] | Zhang Z F, Liu Y, Lu L Y, et al. Hepatoprotective activity of Gentiana veitchiorum Hemsl[J]. Chin J Nat Med , 2014, 12 (7) :488–494. |
| [7] | 杨红澎, 确生, 吴锡冬, 等. 蓝玉簪龙胆中苷类成分的研究[J]. 中国中药杂志 , 2008, 33 (21) :2505–2507. |
| [8] | 邹琼宇, 梁健, 廖循, 等. 蓝玉簪龙胆的化学成分研究[J]. 华西药学杂志 , 2010, 25 (5) :512–514. |
| [9] | 许传梅, 张春红, 董琦, 等. 藏药提宗龙胆花的化学成分研究[J]. 西北植物学报 , 2008, 28 (12) :2543–2546. |
| [10] | 高桂花, 邓湘豊, 刘娟, 等. 大青叶中碳苷黄酮类化合物[J]. 沈阳药科大学学报 , 2007, 24 (12) :747–750. |
| [11] | ÇalişÌ, BirincioğluS S, KırmızıbekmezH, 等. Secondary metabolites from Asphodelus aestivus[J]. Z Naturforsch , 2006, 61 (2) :1304–1310. |
| [12] | Takahiro H, Young S Y, Akira K. Five novel flavonoids from Wasabia japonica[J]. Tetrahedron , 2005, 61 (29) :7037–7044. |
 2016, Vol. 47
2016, Vol. 47


