2. 成都中医药大学药学院, 四川 成都 610075
2. Department of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 610075, China
Caco-2细胞来源于人结肠腺癌细胞(human colon adenocarcinoma cell line,Caco-2),具有类似于肠上皮细胞的特征。正常情况下,Caco-2细胞能自发分化为成熟细胞并形成完整的单分子膜[1],从而可以考察药物跨膜转运方式[2]。由于在形态学和生物化学方面与肠上皮细胞具有相似性,Caco-2细胞常作为药物肠吸收和转运特征研究的体外模型[3-5]。
目前,中药提取物在Caco-2细胞中跨膜转运特征的研究常采用化学方法测定其流通量,如HPLC、LC-MS等[6-7]。马丽等[8]研究了板蓝根中有效成分在Caco-2细胞模型中的吸收转运特征,以精氨酸和腺苷为指标成分,采用HPLC检测,计算其表观渗透系数(Papp)与外排率。然而,与成分单一且明确的化学药物不同,中药提取物是混合物,其活性成分十分复杂。化学测定法只能考察有限数量成分的转运特征,且当所测成分呈现的转运特征不一致时[9-10],难以反映提取物的整体特征。Yang等[11]考察肉豆蔻中新木脂素类成分的转运特征时测定了其中10个单体成分的Papp,不同成分之间转运特征既有强吸收,也有弱吸收,既有被动扩散,也有主动转运。可见,要评估含有这些成分的提取物总体的转运特征,单一成分的化学测定法显然难以达成目的。因此,要获得中药提取物整体的转运特征需要建立一种全新的方法,这种方法必须跳出单一成分测定的窠臼。
厚朴Magnoliae officinalis Cortex为木兰科植物厚朴Magnolia officinalis Rehd. et Wils. 或凹叶厚朴Magnolia officinalis Rehd. et Wils. var. bilobaRehd. et Wils. 的干燥干皮、根皮及枝皮。具有燥湿消痰、下气除满的功效,主要用于治疗湿滞伤中、脘痞吐泻、食积气滞、腹胀便秘、痰饮喘咳等[12],是传统中医及日本汉方医学广泛使用的药材。其化学成分包括木脂素类、生物碱类、挥发油及多糖等。近年从厚朴药材中分离最多的是木脂素类化合物,包括厚朴酚、和厚朴酚等,具有抗氧化,抗炎及抗菌作用[13]。中医临床使用厚朴以水煎内服为主,最近牛晓晨等[14]研究了厚朴的Kreb-Ringer’s超声提取液中厚朴酚与和厚朴酚在大鼠肠道的吸收,结果显示2种成分在小肠上段有较好的吸收,属被动转运。但对厚朴水煎剂整体的体外吸收特性的研究迄今未见。考虑到厚朴富含多酚类成分(木脂素属多酚中的一类),而这类成分抗氧化作用突出。本实验拟以厚朴水提物总抗氧化能力来判断提取物在Caco-2细胞中的肠转运特征,并观察提取物对Caco-2细胞膜上P-糖蛋白(P-gp)活性的影响,为厚朴的临床应用提供初步的药动学研究基础。
1 材料 1.1 Caco-2细胞株源于ATCC(AmericanTypeculture Collection,Rockville,MD,美国)。
1.2 药材厚朴购于西南药都中药材市场,经成都中医药大学卢先明教授鉴定为木兰科植物厚朴Magnolia officinalis Rehd. et Wils. 的干皮、根皮及枝皮,为《中国药典》2015年版收录品种[12]。
1.3 主要试剂DMEM培养基、非必需氨基酸(Gibco公司);胎牛血清(Hyclone公司);鼠尾胶原、非索非拉定、罗丹明123(rhodamine123,Rh123)、2,4,6-三吡啶基三嗪(tripyridyltriazine,TPTZ),均来源于Sigma- Aldrich公司;L-谷氨酰胺(北京欣经科生物技术有限公司);碱性磷酸酶(ALP)测定试剂盒(中生北控生物科技股份有限公司);维拉帕米、普萘洛尔(中国食品药品检定研究院);青霉素、链霉素、胰蛋白酶、Hank’s平衡盐液(Hank’s balance salt solution,HBSS)、荧光黄等;实验用水为三蒸水。
1.4 主要仪器Multiskan Ascent酶标仪、微孔板恒温振荡器(美国Thermo Electron公司);Napco 5410二氧化碳孵箱(美国NAPCO公司);BCN-1360型超净工作台(北京东联哈尔仪器制造有限公司);EVOM细胞电阻仪(美国WPI公司)、TranswellTM培养板(0.4 μmol pore size,美国Corning公司);CKX41倒置显微镜(日本 Olympus公司);雷磁PHS-3B 型精密pH计(上海精密科学仪器有限公司)。
2 方法 2.1 厚朴水提物的制备取厚朴20 g,置于圆底烧瓶中,200 mL水浸泡30 min后冷凝回流煎煮。先武火至煮沸,沸后文火续煎15 min,滤过,60 ℃减压浓缩至100 mL,相当于厚朴原生药量为0.2 g/mL[15],4 ℃冷藏备用。经HPLC测定水提物中厚朴酚与和厚朴酚总量为2.63%。
2.2 Caco-2细胞单层模型的建立及验证[16]取对数生长期的Caco-2细胞,按8×104/cm2接种于涂有鼠尾胶原的TranswellTM培养板上,接种后第1周隔天更换培养液,后2周每天换液,并于接种后每间隔2~4 d用细胞电阻仪测定单层细胞的跨上皮细胞电阻(TEER)。各孔中TEER值随时间逐渐升高,于19~21 d分化形成,TEER>500 Ω∙cm2,两侧ALP比值为1∶2.8,与Sussman等[17]报道接近,经验证[18]符合实验要求。
2.3 厚朴水提物对Caco-2细胞毒性实验 2.3.1 厚朴水提物对Caco-2细胞活力的影响取对数生长期的Caco-2细胞,按每孔5×104个接种于96孔培养板,于37 ℃、含5% CO2的培养箱中培养24 h后,给药组每孔加入100 μL含不同质量浓度(终质量浓度为15.625、31.25、62.5、125、250 μg/mL)厚朴水提物的培养基,并设药液对照孔(只加含药培养基,不加细胞),对照组加入等体积的培养基,并设空白孔(只加培养基,不加细胞),各组3个复孔,各组细胞于CO2培养箱中培养22 h后,每孔加入20 μL的MTS/PMS混合溶液孵育2 h,于酶标仪492 nm处测定吸光度(A)值。计算活力抑制率,并以活力抑制率为因变量(Y),药物质量浓度为自变量(X)进行线性回归,通过回归方程计算药物作用24 h对细胞半数抑制浓度(IC50)值。
| $活力抑制率=1-(给药孔A值-给要对照孔A值)/对照孔A值-空白孔A值)$ |
取经验证符合要求的Caco-2细胞单层,于黏膜侧或肠腔侧(AP侧)每孔加入0.5 mL含厚朴水提物(终质量浓度0、40、70、100、150 μg/mL)的培养基,对照组每孔加入等体积的培养基;于浆膜侧或肠内壁侧(BL侧)每孔加入1.5 mL培养基;分别于给药后30 min和150 min在恒温热板上测定TEER值,计算转运前后自身TEER变化率。
| $TEER变化率=(给药后150minTEER值-给药后30minTEER值)/给药后30minTEER值$ |
采用亚铁离子还原能力(FRAP)实验测定其总抗氧化能力[19]。取各质量浓度厚朴水提物100 μL(空白孔为100 μL HBSS),加入96孔酶标板中,每孔加入100 mL TPTZ工作液,微型振荡器上振荡30 s后,在微孔板恒温振荡器上37 ℃避光孵育20 min。酶标仪540 nm处测定A值,以A值对质量浓度进行回归,绘制厚朴水提物总抗氧化能力标准曲线。
2.4.2 厚朴水提物双向跨膜转运实验取经验证符合转运条件的TranswellTM 12孔培养板,用HBSS清洗3次,分别进行AP侧(供侧)向BL侧(受侧)转运,以及BL侧(供侧)向AP侧(受侧)转运实验。于供侧每孔加入0.5 mL含厚朴水提物(终质量浓度50、100 μg/mL)的HBSS,受侧每孔加入1 mL HBSS,CO2培养箱中孵育2 h后,取受侧液进行总抗氧化能力测定。
2.5 厚朴水提物对Caco-2细胞P-gp活性的影响[20] 2.5.1 蓄积测定将不同质量浓度的厚朴水提物与1 μg/mL Rh123在Caco-2细胞中避光共孵育2 h,以30 μmol/L维拉帕米(P-gp抑制剂)作阳性对照,对照组每孔加入相同体积的培养基。随后以无酚红HBSS洗涤3次,溶胞后在λex 488 nm、λem 530 nm处测定胞内荧光强度。
2.5.2 外排测定将 1 μg/mL Rh123与Caco-2细胞避光孵育1 h,替换为不含Rh123的受试药物与Caco-2细胞避光孵育1 h;以30 μmol/L维拉帕米作阳性对照,对照组每孔加入相同体积的培养基。随后以无酚红HBSS洗涤3次,加入溶胞液后在λex 488 nm、λem 530 nm处测定胞内荧光强度。
2.6 参数计算与统计学分析TEER、Papp以及溢流率[ER值,ER值=Papp(BL→AP)/Papp(AP→BL)]计算方法参考文献报道[21]。为有别于经典化学测定法计算的Papp,本实验条件下通过生物测定法计算出的表观渗透系数值称为P’app。两组间样本均数差异比较采用t检验,多组间比较应该用单因素方差分析。
3 结果 3.1 厚朴水提物对Caco-2细胞的毒性 3.1.1 厚朴水提物对Caco-2细胞活力的影响结果表明随着厚朴水提物质量浓度的升高,对Caco-2细胞活力的抑制作用逐渐增强,见图 1。回归方程为Y=0.432 X-0.027,R2=0.978,作用24 h的IC50为116 μg/mL。根据课题组前期研究[22],跨膜浓度选择在24 h IC50的1倍之内为相对安全剂量,一般不会损伤细胞单层完整性。
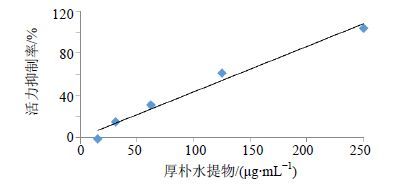
|
图 1 厚朴水提物对Caco-2细胞活力的影响 Fig.1 Effect of WEMOC on vitality of Caco-2 cells |
3.1.2 厚朴水提物对Caco-2细胞单层模型TEER值的影响
给药150 min后,对照组及给药组Caco-2细胞单层模型TEER值均有所上升。与对照组比较,在误差允许范围内,厚朴水提物给药150min后,40~150 μg/mL内不会对Caco-2细胞单层模型的完整性造成损伤。结果见表 1。
|
|
表 1 厚朴水提物对Caco-2细胞单层模型TEER值的影响(x±s,n=3) Table 1 Effect of WEMOC on TEER value in Caco-2 cell monolayer model (x±s,n=3) |
3.2 厚朴水提物在Caco-2细胞单层模型中的双向转运 3.2.1 厚朴水提物总抗氧化能力标准曲线
厚朴水提物在0~20 μg/mL内其总抗氧化能力与质量浓度呈良好线性关系,标准曲线回归方程为Y=0.133X+0.102 6,R2=0.9987。
3.2.2 厚朴水提物在Caco-2细胞单层模型中的双向转运厚朴水提物受侧质量浓度随着供侧质量浓度的增大而增加,从AP侧到BL侧时,供侧质量浓度为50 μg/mL时,受侧质量浓度为(5.51±0.51)μg/mL,供侧质量浓度为100 μg/mL时,受侧质量浓度为(6.78±0.75)μg/mL,提示其为被动扩散,P’app(AP→BL)值在1×10−5 cm/s左右;从BL侧到AP侧时,供侧质量浓度为50 μg/mL时,受侧质量浓度为(9.19±0.62)μg/mL,供侧质量浓度为100 μg/mL时,受侧质量浓度为(11.76±0.46)μg/mL。口服给药生物利用度大于70%[3],显示其吸收较好;ER值在0.8~0.9,小于2,说明没有外排,不是P-gp底物[23]。具体数据见表 2。
|
|
表 2 厚朴水提物转运2 h的P’app(AP→BL)、P’app(BL→AP)及ER值(x±s,n=3) Table 2 P’app(AP→BL),P’app(BL→AP),and ER value of WEMOC after 2 h transportation (x±s,n=3) |
3.3 厚朴水提物对P-gp活性的影响 3.3.1 厚朴水提物对Rh123蓄积的影响
共设置5个厚朴水提物质量浓度,从200 μg/mL开始,以0.4倍递减,范围内包含双向转运实验中的2个质量浓度。由表 3可见,P-gp抑制剂维拉帕米浓度为30 μmol/L即可显著增加P-gp底物Rh123在Caco-2细胞内的蓄积。而不同质量浓度的厚朴水提物对Rh123的蓄积几乎没有影响。
|
|
表 3 厚朴水提物对Rh123在Caco-2细胞内蓄积的影响(x±s,n=3) Table 3 Effect of WEMOC on accumulation of Rh123 in Caco-2 cells (x±s,n=3) |
3.3.2 厚朴水提物对Rh123外排的影响
移除培养基中Rh123后,30 μmol/L维拉帕米即可显著抑制已进入Caco-2细胞内的Rh123的外排。而不同质量浓度的厚朴水提物对Rh123的外排均无明显影响。因此无论蓄积实验还是外排实验均显示厚朴水提物对P-gp活性没有影响。结果见表 4。
|
|
表 4 厚朴水提物对Rh123从Caco-2细胞外排的影响(x±s,n=3) Table 4 Effect of WEMOC on efflux of Rh123 from Caco-2 cells (x±s,n=3) |
4 讨论
Caco-2细胞模型是常用的研究口服药物吸收的体外细胞模型[4],建模后需经过单层完整性、细胞分化极性、膜通透性以及P-gp表达等方面验证后,才能进行后续的研究[18]。具体到正式的转运研究,还应当选择对细胞单层无损的指标,如TEER值(完整性)及ALP比值(极性)。本实验研究采用的是符合条件的Caco-2细胞单层模型。
以Caco-2细胞单层模型研究受试物转运特征,经典的方法是采用HPLC或LC-MS测定转运成分的量并计算出相应的Papp、ER等值来判断该化合物的转运特征。这些化学方法虽然灵敏、准确、可靠,但其只适合于已知成分。对包含大量未知成分的中药提取物,采用经典方法来研究并反映中药提取物整体转运特征显然是不适合的,其原因有二。首先,化学测定无法穷尽提取物中所有成分;更重要的是,当同一提取物中不同成分显示出截然不同的转运特征时,用哪种成分的转运代表提取物整体是无法判断的。因此,为评价中药提取物整体的转运特征,需建立一种有别于传统的新的研究方法。本实验采用了生物测定法来评价厚朴水提物的肠转运特征。由于厚朴含有多种酚类物质,具有显著的抗氧化活性[24]。因此,可通过选择此生物活性的量效曲线来判断厚朴水提物在Caco-2细胞单层的转运量。结果显示,厚朴水提物转运具有浓度依赖性,为被动扩散;P’app(AP→BL)值在1×10−5 cm/s左右(1.35×10−5~8.34×10−6 cm/s),大于判断吸收不良的临界值[3](P’app(AP→BL)值为1×10−6 cm/s,生物利用度为20%),说明与抗氧化作用有关的活性成分群吸收较好。ER值在0.8~0.9,表明这类成分总体上不存在外排[25]现象。
P-gp是肠上皮细胞中主要的外排蛋白,由于厚朴水提物不具外排特征,自然不可能是P-gp等外排蛋白的底物,但厚朴水提物是否对P-gp活性有影响却不明确。有文献报道,厚朴能抑制远志中细叶远志皂苷、远志𠮿酮III在空肠和结肠的吸收[26],提示厚朴水提物对肠上皮细胞中的外排蛋白活性似乎有兴奋作用。对此,聚焦于肠道中最主要的外排蛋白P-gp,通过它的底物Rh123在Caco-2细胞中的蓄积和外排实验来评价厚朴水提物对其活性的影响。结果显示,厚朴水提物对Rh123的蓄积和外排均无明显影响,说明厚朴水提物并不影响P-gp活性。当然,在肠上皮细胞中,具有促外排的蛋白并不只有P-gp,厚朴水提物对肠上皮细胞中多药耐药相关蛋白2(multidrug resistance related protein 2,MRP2)或乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)等外排蛋白[27]是否有兴奋作用尚待研究。
需要说明的是,通过本实验条件计算出的P’app值与经典化学测定法计算的Papp值是有区别的。前者是针对混合物的整体,而后者针对的是特定的成分;如果以成分来比较两者区别,P’app不仅反映了成分的原型,也包括这些成分的代谢物、降解物甚至还包括细胞单层分泌的因子等[28],这些物质均可能影响到所具有的生物活性,而Papp却只能代表原型成分。从这个角度来看,P’app值可能与体内实际作用更为吻合[29]。当然,P’app所代表的转运特征是与该生物活性相关的成分群的总和,它不能反映提取物中与该生物活性无关的成分群。因此,准确地说,这里所谓的“整体”,也只是与该生物活性相关的成分集合。同时,采用生物测定法进行转运特征研究是有条件的。首先,选择的生物测定指标要足够灵敏,至少能从2 h或4 h的受侧液中检测出明确的生物活性,并能通过量效曲线进行有效计算。其次,该生物活性检测体系要与转运介质兼容,即转运介质与生物活性测定的反应介质不能相冲突;最后,该生物活性能够反映中药提取物中足够多的成分,这才有可能代表这个集合的整体情况。
由于采用生物活性的量效曲线来判断提取物的转运量,其灵敏度往往低于化学方法。为了进行有效测定,常常需要在受侧加入尽量多的受试物,但前提是不破坏细胞单层的完整性。对此,在实验中首先进行了厚朴水提物对Caco-2细胞24 h毒性实验,并计算出其IC50为116 μg/mL。根据前期研究结果[22],IC50的1~1.5倍用于转运研究可能是安全的。事实上,本实验显示150 μg/mL及以下厚朴水提物不破坏细胞单层的完整性。当然,考虑到生物活性的灵敏度,最终选择了50和100 μg/mL 2个质量浓度进行转运实验。
综上,本研究为评价多成分的厚朴水提物在Caco-2细胞中的肠转运特征,建立了一种全新的方法。实验结果表明,厚朴水提物吸收较好,以被动扩散方式转运,无外排,且不影响P-gp活性,这为临床合理使用厚朴提供了药动学基础。同时提示,只要能找到合适的生物活性指标,生物测定法同样适用于其他中药提取物转运特征的研究。
| [1] | Artursson P, Karlsson J. Correlation between oral drug absorption in humans and apparent drug permeability coefficients in human intestinal epithelial (Caco-2) cells[J]. Biochem Biophys Res Commun , 1991, 175 (3) :880–885. |
| [2] | Yamashita S, Furubayashi T, Kataoka M, et al. Optimized conditions for prediction of intestinal drug permeability using Caco-2 cells[J]. Eur J Pharm Sci , 2000, 10 (3) :195–204. |
| [3] | Yee S. In vitro permeability across Caco-2 cell (colonic) can predict in vivo (small intestinal) absorption in man-fact or myth[J]. Pharm Res , 1997, 14 (6) :763–766. |
| [4] | Artursson P, Palm K, Luthman K. Caco-2 monolayers in experimental and theoretical predictions of drug transport[J]. Adv Drug Deliv Rev , 2001, 46 (1/3) :27–43. |
| [5] | 朱容慧, 赵军宁, 毕岳琦, 等. 中药肠吸收动力学的研究进展[J]. 药物评价研究 , 2010, 33 (1) :25–29. |
| [6] | 吴安国, 曾宝, 王春玲, 等. HPLC考察小檗碱和黄连提取物中小檗碱在Caco-2细胞模型的转运[J]. 中国药理学通报 , 2011, 27 (7) :1007–1011. |
| [7] | 戚娟, 郭涛, 李海燕, 等. 黄连多组分在Caco-2细胞单层模型的吸收及其相互作用[J]. 中草药 , 2013, 44 (13) :1801–1806. |
| [8] | 马丽, 何茂秋, 骆瀚超, 等. 板蓝根提取液中有效成分的吸收转运特性分析[J]. 中国实验方剂学杂志 , 2015, 21 (24) :5–9. |
| [9] | Li N, Tsao R, Sui Z, et al. Intestinal transport of pure diester-type alkaloids from an aconite extract across the Caco-2 cell monolayer model[J]. Planta Med , 2012, 78 (7) :692–697. |
| [10] | Zhao B, Yang X B, Yang X W, et al. Intesinal permeability of the consistuents from the roots of Saposhnikovia divaricate in the human Caco-2 cell monolayer model[J]. Planta Med , 2011, 77 (13) :1531–1535. |
| [11] | Yang X W, Huang X, Ma L, et al. The Intestinal Permeability of Neolignans from the Seeds of Myristica fragrans in the Caco-2 cell monolayer model[J]. Planta Med , 2010, 76 (14) :1587–1591. |
| [12] | 中国药典 [S] 一部. 2015. |
| [13] | 秦洁, 李晓庆, 赵春娟, 等. 厚朴酚与和厚朴酚抗鼻咽癌作用机制研究[J]. 中草药 , 2015, 46 (2) :226–230. |
| [14] | 牛晓晨, 程林忠, 李青. 厚朴酚与和厚朴酚在大鼠不同肠道中的吸收情况及与药物浓度关系[J]. 中药材 , 2015, 38 (4) :817–820. |
| [15] | 傅勇, 肖武, 李达, 等. 远志与厚朴不同配比水煎液的HPLC指纹图谱比较研究[J]. 中国药房 , 2012, 23 (43) :4072–4074. |
| [16] | Artursson P. Epithelial Transport of drugs in cell culture: A model for studying the passive diffusion of drugs over intestinal absorptive Caco-2 cells[J]. J Pharm Sci , 1990, 79 (6) :476–482. |
| [17] | Sussman N L, Eliakim R, Rubin D, et al. Intestinal alkaline phosphatase is secreted bidirectionally from villous enterocytes[J]. Am J Physiol , 1989, 257 (1) :G14-23 . |
| [18] | 蔡润兰, 王敏, 齐云, 等. Caco-2细胞模型验证指标的选择与评判[J]. 中国药学杂志 , 2008, 43 (24) :1871–1875. |
| [19] | Wang M, Xie C, Cai R L, et al. Studies on antioxidant activities of breviscapine in the cell-free system[J]. Am J Chin Med , 2008, 36 (6) :1199–1207. |
| [20] | Anuchapreeda S, Leechanachai P, Smith M M, et al. Modulation of P-glycoprotein expression and function by curcumin in multidrug-resistant human KB cells[J]. Biochem Pharmacol , 2002, 64 (4) :573–582. |
| [21] | 齐云, 王敏, 蔡润兰, 等. 两种方法测定灯盏花素经Caco-2细胞模型的转运[J]. 中国药理学通报 , 2009, 25 (6) :831–833. |
| [22] | 蔡润兰, 代勇, 王敏, 等. 9种中药提取物细胞毒性及其与人结肠腺癌细胞系单层细胞旁通透性的相关性研究[J]. 中国药理学通报 , 2011, 27 (10) :1418–1421. |
| [23] | Polli J W, Wring S A, Humphreys J E, et al. Rational use of in vitro P-glycoprotein assays in drug discovery[J]. J Pharmacol Exp Ther , 2001, 299 (2) :620–628. |
| [24] | 李清华, 翁新楚. 厚朴抗氧化活性的研究[J]. 中国油脂 , 2005, 30 (9) :37–40. |
| [25] | Center for Drug Evaluation and Research. Guidance for Industry: Drug Interaction Studies-Study Design, Data Analysis, Implications for Dosing, and Labeling Recommendations[M]. Silver Spring: Food and drug Administration, 2012 . |
| [26] | 黄立华, 王建, 吴明权, 等. 远志、厚朴配伍对其活性成分在大鼠肠段吸收的影响[J]. 中成药 , 2015, 37 (4) :739–745. |
| [27] | Alvarez A I, Real R, Pérez M, et al. Modulation of the activity of ABC transporters (P-glycoprotein, MRP2, BCRP) by flavonoids and drug response[J]. J Pharm Sci , 2010, 99 (2) :598–617. |
| [28] | Eguchi A, Murakami A, Ohigashi H. Novel bioassay system for evaluating anti-oxidative activities of food items: use of basolateral media from differentiated Caco-2 cells[J]. Free Radic Res , 2005, 39 (12) :1367–1375. |
| [29] | Gao Y, Zong C, Liu F, et al. Evaluation of the intestinal transport of a phenylethanoid glycoside-rich extract from Cistanche deserticola across the Caco-2 cell monolayer model[J]. PLoS One , 2015, 10 (2) :e011649. |
 2016, Vol. 47
2016, Vol. 47


