中药不同于化学药品,是由一类甚至多类化学成分组成,每一类化学成分中又存在结构变化多端的不同化合物。在如此庞大的化学库中,既有初级代谢产物,也有次级代谢产物;既有活性成分,也有辅助成分,还有无效成分;既有专属性成分,也有普通成分;既有量大成分,也有微量成分。那么质量控制中的指标成分该如何研究、选择和确定?究竟哪些成分能够较好表征这个中药?这一直都是中药研究的难点和热点,也是制约中药现代化的关键问题之一。由于受到科学技术水平及人力、物力的限制,很多中药成分的检测并不是十分合理,如《中国药典》2015年版,冬虫夏草测定腺苷的量、铁皮石斛测定甘露糖的量、板蓝根检测精氨酸的量、九香虫检测油酸的量等,而这些成分既不是其主要有效成分,也不是专属性成分,检测它们对其质量控制没有太大意义。此外,桑叶和一枝黄花等检测芦丁、蒲公英测定咖啡酸等,虽然为有效成分,但缺乏特征性,它们广泛存在各种中药材及植物中,势必会给这些药材的质量控制带来很多漏洞。
针对上述难题,刘昌孝院士等[1]提出“中药质量标志物(Q-Marker)”的新概念,是对中药指标成分新的认识和提升。其基本条件包括:(1) 中药材和中药产品中固有存在的或加工制备过程中形成的化学物质;(2) 与中药的功能属性密切相关,有明确的化学结构;(3) 可以进行定性鉴别和定量测定的物质;(4) 按中医配伍组成的方剂君药首选原则,兼顾臣、佐、使药的代表性物质。虽然Q-Marker的要求比较高,对于大多数中药而言,是一项任重道远的工作,但近年来,随着我国科学技术水平的提高、交叉学科的应用以及基础科研投入的增加,深入研究中药Q-Marker成为可能。笔者以益母草和赶黄草研究为例,描述中药Q-Marker的探索过程。
1 获得中药材中固有存在的次生代谢物或加工制备过程中形成的化学物质深入的药效物质研究是探索中药Q-Marker的基础,因为目前对大多数中药的基础研究还十分薄弱,并不完全清楚其成分组成,甚至不明确成分类型。据统计,《中国药典》2015年版一部共收载中药材(含饮片和提取物)665种,但其中210余种既没有指标成分的定性鉴别,也没有定量测定,而且已经进行过系统化学成分研究的品种不超过20%,这也是导致中药难以被西方国家接受的原因之一。因此,要想获得理想的Q-Marker,物质基础研究是首要任务,即使是中药指纹图谱,也应该是主要成分明确条件下的指纹特征,同时最好有Q-Marker的指认。在过去的几年间,笔者对传统中药益母草和赶黄草进行了深入的物质基础研究,较详细地阐明了两味中药的化学成分,力求获得具有代表性的Q-Marker。
益母草Leonurus japonicus Houtt.(同名于Leonurus heterophyllus Sw.)是一味广泛应用的传统中药,有“经产良药”之称。其始载于《神农本草经》,原名茺蔚,被列为上品。在《本草纲目》中被称之为“血家之圣药”,主治“胎漏难产,胎衣不下,血晕,血风,血痛,崩中漏下,尿血”。在当今产科应用方面,益母草对宫缩乏力所致产后出血和子宫复旧困难有良好疗效[2-3]。从20世纪90年代开始,人们对益母草化学成分研究逐渐增多,但仍然没有对益母草的物质基础进行持续的系统性研究[4-6]。笔者近年来通过深入系统地研究,较详细地阐明了益母草各类成分的基本组成,并发现了一系列与益母草功能属性密切相关的活性物质,涵盖三萜类、二萜类、倍半萜及单萜类、挥发油类、甾体类、生物碱类(包括环肽类)、苯丙素类(包括香豆素及木脂素类)、黄酮类、脂肪族类、小分子芳香族类及其他,共130余个化学成分[7-28],其中新化合物27个,新骨架化合物2个。研究表明益母草中代表性成分为二萜和生物碱,前者主要包括普通、裂环或降碳半日花烷型二萜[7-8, 10],后者主要为植物环肽类、甾体生物碱、亚精胺、氨基酸衍生物、益母草碱衍生物及水苏碱、胆碱、葫芦巴碱等[18, 25, 28],图 1列举了从益母草中获得的代表性化合物。
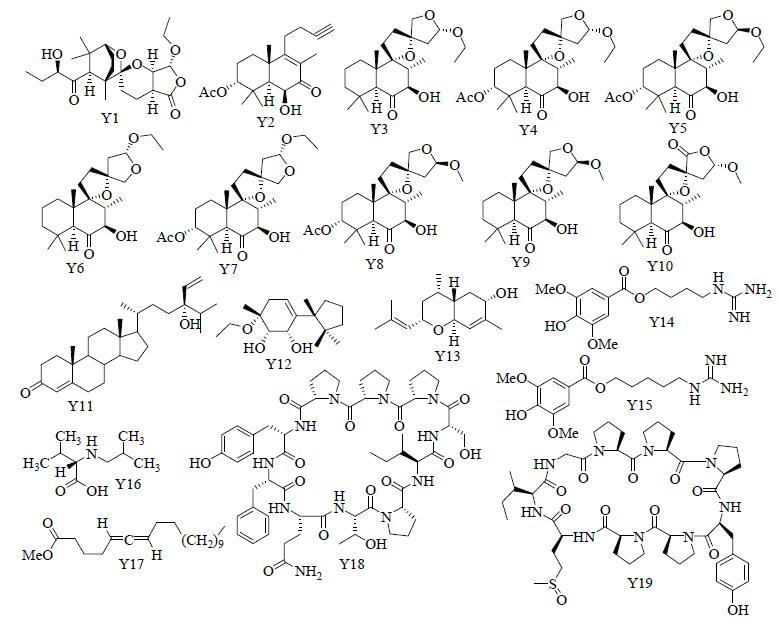
|
图 1 从益母草中获得的代表性化学成分 Fig.1 Typical chemical constituents isolated from L. japonicus |
赶黄草Penthorum chinense Pursh又名扯根菜,被誉为神仙草,分布于中国大部分地区,尤其是四川省古蔺县被认为是赶黄草的主产区[29]。千百年来,赶黄草在苗族地区以全草入药,除湿利水、祛瘀止痛,主治黄疸、水肿、经闭、跌打损伤和各型肝炎[30]。现代临床和基础研究均表明,赶黄草提取物具有降酶,保肝,退黄,治疗乙型肝炎、肝癌以及其他相关的肝损伤疾病等作用[31-32]。近年来,对赶黄草药理活性和新药开发的研究越来越多,其相关肝保护和治疗肝脏疾病用途的专利约80个。笔者研究发现赶黄草汤剂具有明显的保肝作用[33-34],并进一步对其活性部位(水煎液醋酸乙酯萃取物)进行深入的化学成分研究,获得了26个化合物,含新化合物9个,新骨架化合物4个,成分类型主要为木脂素类和黄酮类[35-36, 37],其中木脂素类是自然界十分少见的类型,尤其是新发现的7,3'-新木脂素。图 2列举了从赶黄草中获得的代表性化合物,为研究该中药Q-Marker提供基础。
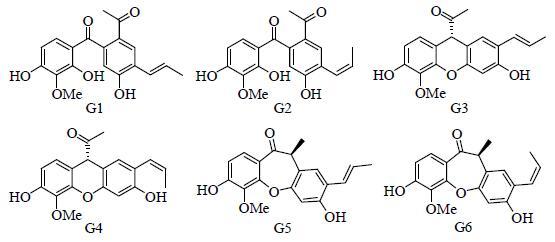
|
图 2 从赶黄草中获得的代表性化学成分 Fig.2 Typical chemical constituents isolated from P. chinense |
2 中药Q-Marker的专属性研究
一般而言,中药材中获得一个专属性较强的化学成分很难,因为中药的主要成分是自然界植物中普遍存在的初级或次级代谢产物,例如上述的甘露糖、精氨酸、油酸、腺苷、芦丁、咖啡酸等。此外,药典中检测的熊果酸、齐墩果酸、没食子酸、阿魏酸、绿原酸、谷氨酸、苯甲酸、槲皮素、麦角甾醇等均属于此类。那么以这些缺乏特征性的成分作为指标成分,尤其是那些不具备生物活性的成分,如苯甲酸和精氨酸等,会给中药质量控制带来许多问题,特别是在制剂生产过程中,曾发生过直接外加指标成分或者用含有该成分的其他植物(食物)代替该药材的做法。但目前仍不能很好地解决这种问题,因为在简单可行的条件下,可检测的大多数中药成分属于这种类型,专属性较强的指标成分少之又少。
2.1 益母草化学成分的研究奠定其Q-Marker基础在科学技术飞速发展的今天,很多结构特殊且具有显著生物活性的新成分被发现,这就为获得“Q-Marker候选物”提供了更多可能。截止目前,在过去的30年间,其他研究者从益母草中共获得了110余个化学成分[4-6, 38-49],加上本课题组系统研究所得到的130余个化学成分,从益母草中已明确的化学成分超过240个。结合文献查阅,图 1中列出的益母草代表性化合物具有较强的专属性,Y1为新发现的新骨架二萜,其生源途径如图 3所示,由益母草属中广泛存在的半日花烷型二萜转化而来,最终形成一个复杂的螺缩酮结构[7];Y2为罕见的降碳半日花烷型二萜[10];Y3~Y10为益母草属代表性的双螺环半日花烷型二萜,且这些化合物目前只发现于益母草中[8];Y14和Y15为特征性强的胍类生物碱(益母草碱及衍生物),目前只报道于2种市场流通的益母草药材[25, 41, 50];Y18~Y19为只从益母草中分离得到的2个特征性环肽[25],而益母草中存在的水苏碱、胆碱、葫芦巴碱等其他化合物专属性较低。
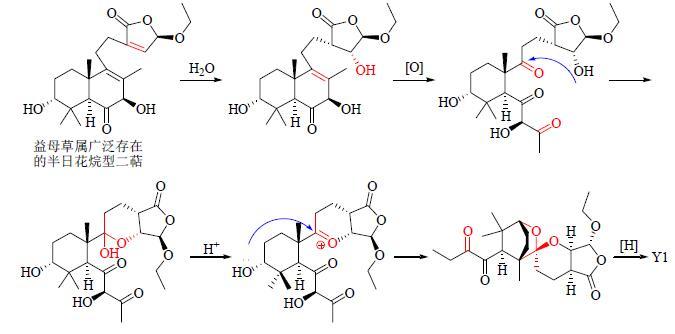
|
图 3 益母草化合物Y1 (leonuketal) 可能的生源途径 Fig.3 Biosynthetic pathway of compound Y1 (leonuketal) isolated from L. japonicus |
2.2 专属性更强的赶黄草化学成分的发现奠定其Q-Marker基础
相对于益母草而言,赶黄草化学成分的研究报道较少,且大部分集中于最近10年,只报道了20余个化学成分[31, 51-54],加上笔者研究得到的26个化合物,赶黄草中已获得的化学成分达到50余个。虽然化合物数量不及益母草,但所含化学成分的专属性更强,尤其是赶黄草木脂素类成分具有很强的特征性。图 2列出了笔者从赶黄草中获得的代表性木脂素,化合物G1和G2为重排的新木脂素骨架[35];G3和G4为新发现的7,3'-新木脂素骨架[35];G5和G6为罕见的8,3'-新木脂素类,与自然界其他8,3'-新木脂素最大的区别在于分子中还存在一个2,4'-环氧结构,目前只报道于赶黄草中[36, 54]。以上特殊木脂素的生源前体均为自然界普遍存在的8,3'-新木脂素,但在赶黄草的次级代谢产物生源合成中,发生了进一步的转化(图 4),从而形成了独具特色的专属性木脂素。它们的存在与赶黄草植物的生物特殊性密切相关,赶黄草属最早归于景天科,1981年归属于虎耳草科,1998年,在APG分类系统中其独立为赶黄草科,而这个科目前仅包括1属2种。专属性成分的获得不仅为该植物分类提供佐证,而且也有利于赶黄草Q-Marker的研究。
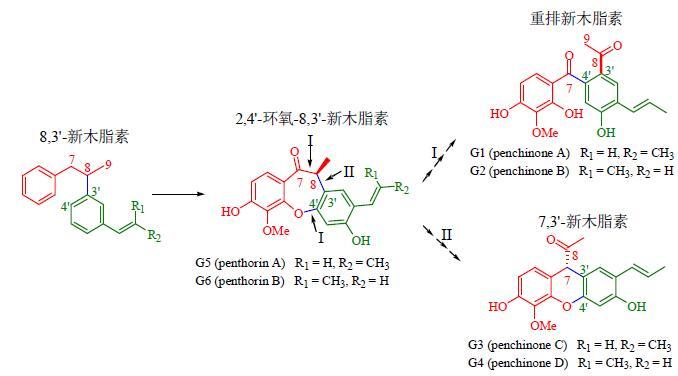
|
图 4 赶黄草特殊木脂素可能的生源途径 Fig.4 Biosynthetic pathway of specific lignin isolated from P. chinense |
3 中药Q-Marker的化学结构和生物活性研究 3.1 现代分析方法推进中药活性成分的研究
由于传统的方法和仪器的限制,常发生中药活性成分结构被确定错误的情况,例如杜鹃酮、秦艽甲素等。但近20年来,分析化学和仪器设备迅猛发展,为中药化学成分结构研究提供了更多可靠的方法和技术,尤其是各种波谱学方法和仪器的创新应用。例如,在普通中药成分的质谱检测中,最主要的革新是离子源技术,包括电离方式和超微量样品离子化2个方面,除电子轰击电离(EI)、化学电离(CI)、场电离(FI)、快原子轰击(FAB)和场解析(FD)以外,电喷雾电离(ESI)和基质辅助激光解析电离(MALDI)等软电离技术逐渐显示出优势,已经被广泛应用。而针对活性中药成分的量和得率太低的问题,超微量样品离子化技术纳升级电喷雾质谱(nano2ESI)使质谱的检测限大为降低,可达到nmol级,甚至amol级。核磁技术作为中药成分结构确定的主要手段,也在不断的发展,例如超低温探头的应用、线圈的改进、3 mm和1 mm等微量核磁管的开发使样品的检出限从mg级降低至μg级,甚至ng级。此外,各种二维核磁共振的应用也使中药成分结构的鉴定更加准确。
3.2 准确鉴定有效成分的结构保证Q-Marker结构的准确性在益母草和赶黄草的化学成分研究中,笔者采用各种波谱学技术和化学方法,鉴定了所有成分的结构,保证了Q-Marker结构的准确性。尤其在空间构型的确定中,运用了化学转化、核磁共振、圆二色谱、量子化学、X-射线单晶衍射等多种技术手段。例如,鉴定化合物Y1和Y6中利用了改良Mosher’s法[7-8];结合圆二色谱和量子化学的方法鉴定G3、G5、G6和Y1等[7, 35-36];应用Marfey’s法鉴定Y18~Y19[25];采用X-射线单晶衍射确定了Y7和Y11[8-9]绝对构型,力求精细结构的准确(图 5)。
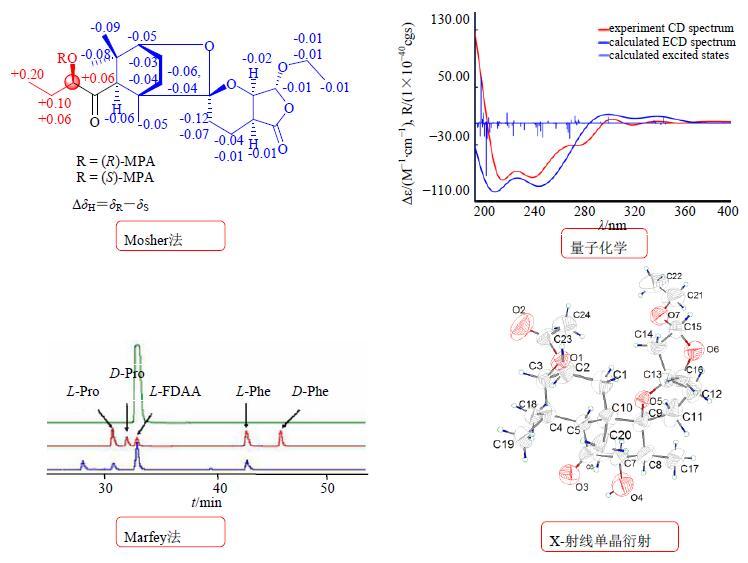
|
图 5 益母草和赶黄草化学成分立体结构确定的实例 Fig.5 Examples of stereostructure elucidation for chemical constituents from L. japonicus and P. chinense |
3.3 益母草和赶黄草化学成分生物活性研究提供其Q-Marker与生物学效应关联性
中药Q-Marker除了应具有明确的化学结构外,还应有明显的生物活性。益母草临床上主要用于血液系统疾病和妇产科疾病,因此,笔者通过针对性的研究,发现了一系列与益母草功能属性密切相关的活性成分,例如Y1对氯化钾诱导的大鼠主动脉收缩具有显著的血管舒张活性(EC50=2.32 μmol/L)[7];Y2在显著降低凝血活酶时间(APTT)、凝血酶原时间(PT)和凝血酶时间(TT)的同时(P<0.01、0.05),升高纤维蛋白原(FIB)水平(P<0.05),有明显的凝血作用[10];Y6和Y7能明显抑制二磷酸腺苷(ADP)诱导的血小板聚集(P<0.05),而C-13位构型相反的二萜类似物不具有明显活性[8];Y14、Y18和Y19具有兴奋子宫平滑肌的作用,主要表现在收缩频率、收缩平均值、收缩最小值、收缩活力升高(P<0.01、0.05)(图 6)[25]。
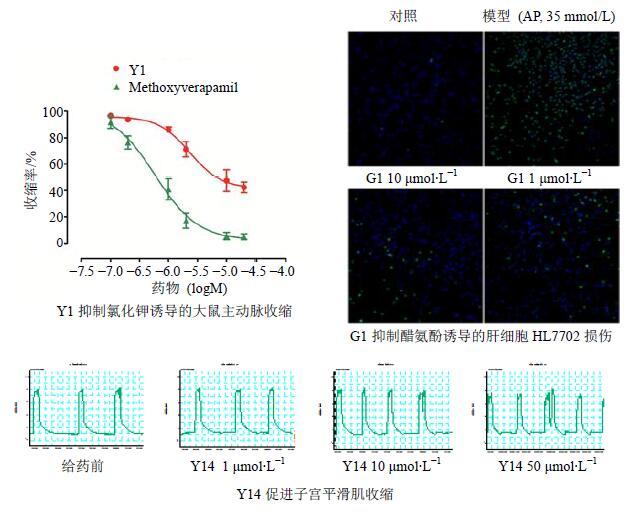
|
图 6 益母草和赶黄草化学成分生物活性研究的实例 Fig.6 Examples of bioactivity of chemical constituents in L. japonicus and P. chinense |
赶黄草主要用于肝脏疾病方面,提取物的保肝作用也得到了一致认可,故笔者开展了进一步的针对性研究,通过MTT筛选,G1对醋氨酚诱导的肝细胞HL7702损伤具有保护作用(P<0.05),并进一步通过高内涵荧光成像验证[35];G2对H2O2导致的肝细胞LO2损伤有明显保护作用(P<0.05),并对醋氨酚诱导的LO2细胞损伤有保护作用趋势[37];G6可保护醋氨酚诱导的肝细胞LO2免受损伤(P<0.05),见图 6[36]。
4 中药Q-Marker的可测性研究色谱及其相关技术是中药质量控制采取的主要方法,绝大多数中药是通过色谱来实现定性鉴别和定量测定。因此,中药Q-Marker在色谱上的可测性非常重要,而且尽可能在操作方便、前处理简单的情况下进行,这对于很多既具有专属性又具有活性的成分而言,较难实现。即使越来越多的检测手段可以被选择,也仍然难以克服量微、成分复杂难分离等问题。
经过系统的筛选和实践,笔者发现在益母草和赶黄草的化学成分中,在兼顾专属性较强、结构明确、具有与功能属性密切相关的基础上,赶黄草化合物G2和益母草化合物Y14可在操作方便、前处理简单的情况下被很好分离和检测(图 7)。在药材供试品溶液的制备过程中,由于赶黄草其他成分对G2的色谱行为影响较大,故采取了聚酰胺柱对赶黄草60%甲醇提取物进行前处理,先弃去30%乙醇洗脱液,再收集70%乙醇洗脱液,制备相应的TLC供试品溶液和HPLC供试品溶液,这也是首次对赶黄草木脂素类成分进行定性鉴别和定量测定。益母草的供试品溶液制备未采取色谱前处理,即可进行良好分离和检测。
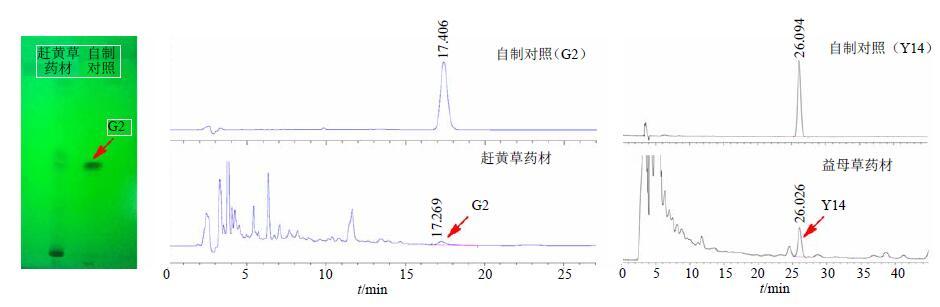
|
图 7 赶黄草成分G2和益母草成分Y14的检测 Fig.7 Determination of G2isolated from P. chinense and Y14 isolated from L. japonicus |
5 基于中药Q-Marker的指纹图谱研究
指标成分的鉴别和定量测定对中药的质量控制起着至关重要的作用,但对于复杂的中药而言,往往不能全面、整体地反映一个中药,因此,色谱或光谱指纹图谱是一个很好的补充。但在共有峰指认时,如果只是一些极普通且没有生物活性的化学成分,不能反映中药主要有效成分或指标成分的共同特征,那么指纹图谱的价值将大打折扣。可以看出,中药Q-Marker在中药指纹图谱中意义非凡,可更好地鉴别真伪和控制质量。
以赶黄草为例,采集主要种植区域的四川、贵州10个产地的赶黄草样本,以80%甲醇溶液超声提取制备供试液,运用RP-HPLC(乙腈-0.2%甲酸水溶液梯度洗脱)进行色谱分析研究,采用“中药色谱指纹图谱相似度评价系统2004A版”软件进行色谱峰的校正、匹配、生成药材的共有峰以及对照指纹图谱(图 8),共指认出9个色谱峰,大部分为量较大的成分或(和)活性成分,其中7号峰可作为典型的赶黄草Q-Marker色谱峰(G2,赶黄草酮B)。
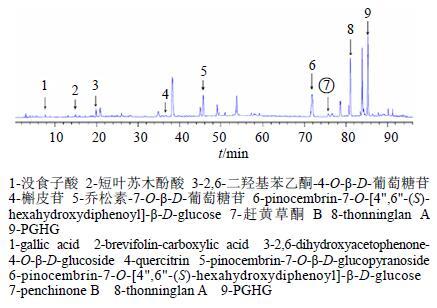
|
图 8 赶黄草药材对照指纹图谱 Fig.8 Reference fingerpints of P. chinense |
6 结语与展望
《中国药典》2005、2010和2015年版均收载了益母草药材和相关制剂,如2015年版收载5种制剂,包括口服液、片剂、胶囊、颗粒剂和浸膏,在质量标准检测中均以盐酸水苏碱和盐酸益母草碱为指标。其在植物体内是否全部以盐酸盐形式存在?在测定前处理过程中也未见使用某一浓度的盐酸,在植物体中是否还存在大量的游离碱形式或者其他盐形式?如果在药材中不是全以盐酸盐形式存在,那么其存在状态(盐和碱)的差异可能会影响定量测定的准确性。另外,从文献报道中已知水苏碱集中分布在唇形科(Labiatae)、白花菜科(Capparidaceae)、豆科(Leguminosae)、芸香科(Rutaceae)和菊科(Compositae)植物中[55],因此,水苏碱是否是其药材的特有成分也值得探讨。
虽然赶黄草目前还未收载于《中国药典》,但在民间得到了广泛应用,主治黄疸、经闭、水肿、跌打损伤等症。由其花、叶、茎加工的袋泡茶、饮料等已在市场上广泛销售[56],由单味药材水煎液制成的肝苏颗粒,在临床上用于急慢性乙型肝炎、病毒性肝炎、肝纤维化等肝脏疾病的治疗[57-58]。《四川省中药材标准》已经收载了赶黄草,但其质量标准中仅仅以槲皮素为指标成分[59],显然槲皮素离赶黄草Q-Marker的要求还相差甚远。
Q-Marker是在现代科学技术条件下提出的新概念,也为中药质量控制提出了新的要求。但是中药Q-Marker的基本要求较高,不仅需要深入的药效物质基础研究,而且要求该次级代谢产物具有专属性和生物活性,同时还应有较好的色谱行为,在当今技术条件下可以被定性鉴别和定量测定。因此,中药Q-Marker需要一个系统性研究来支撑。笔者以近年来对益母草和赶黄草的研究为例,对中药Q-Marker应具备的基本条件和研究过程进行了简要叙述,获得了一些中药Q-Marker,并进行了一系列相关研究。赶黄草酮B(penchinone B,G2)等可作为赶黄草代表性的Q-Marker;益母草碱(leonurine,Y14)等可作为益母草代表性的Q-Marker,这些化合物符合中药Q-Marker的基本要求。虽然对于数量庞大的中药而言,中药Q-Marker的研究任重而道远,需要投入大量的基础研究,但在飞速发展的科学技术和日益增加的科研投入支撑下,中药Q-Marker的研究和应用有望不断取得突破性地进展,完善中药质量控制体系,促进中药现代化发展。
| [1] | 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物 (Q-Marker): 中药产品质量控制的新概念[J]. 中草药 , 2016, 47 (9) :1443–1457. |
| [2] | 赵丁, 刘伟娜, 王伟, 等. 益母草提取物对小鼠体外子宫收缩功能的影响[J]. 医药导报 , 2008, 27 (6) :640–642. |
| [3] | Chan W C, Wong Y C, Kong Y C, et al. Clinical observation on the uterotonic effect of I-mu Ts'ao (Leonurus artemisia)[J]. Am J Chin Med , 1983, 11 :77–83. |
| [4] | Romero-González R R, Avila-Núñez J L, Aubert L, et al. Labdane diterpenes from Leonurus japonicus leaves[J]. Phytochemistry , 2006, 67 (10) :965–970. |
| [5] | Chang J M, Shen C C, Huang Y L, et al. Two new glycosides from Leonurus japonicus[J]. J Asian Nat Prod Res , 2010, 12 (9) :740–744. |
| [6] | Moon H I. Three diterpenes from Leonurus japonicus Houtt protect primary cultured rat cortical cells from glutamate-induced toxicity[J]. Phytother Res , 2010, 24 (8) :1256–1259. |
| [7] | Xiong L, Zhou Q M, Zou Y, et al. Leonuketal, a spiroketal diterpenoid from Leonurus japonicus[J]. Org Lett , 2015, 17 (24) :6238–6241. |
| [8] | Xiong L, Zhou Q M, Peng C, et al. Bis-spirolabdane diterpenoids from Leonurus japonicus and their anti-platelet aggregative activity[J]. Fitoterapia , 2015, 100 :1–6. |
| [9] | Zhou Q M, Peng C, Yang H, et al. Steroids from the aerial parts of Leonurus japonicus[J]. Phytochem Lett , 2015, 12 :287–290. |
| [10] | Peng F, Xiong L, Zhao X M. A bicyclic diterpenoid with a new 15,16-dinorlabdane carbon skeleton from Leonurus japonicus and itscoagulant bioactivity[J]. Molecules , 2013, 18 (11) :13904–13909. |
| [11] | Zhou Q M, Peng C, Li X H, et al. Aromatic compounds from Leonurus japonicus Houtt[J]. Biochem Syst Ecol , 2013, 51 :101–103. |
| [12] | Xiong L, Zhou Q M, Peng C, et al. Sesquiterpenoids from the herb of Leonurus japonicus[J]. Molecules , 2013, 18 (5) :5051–5058. |
| [13] | Xiong L, Peng C, Zhou Q M, et al. Chemical composition and antibacterial activity of essential oils from different parts of Leonurus japonicus Houtt[J]. Molecules , 2013, 18 (1) :963–973. |
| [14] | 周勤梅, 彭成, 蒙春旺, 等. 益母草中脂肪族化合物的研究[J]. 中草药 , 2015, 46 (9) :1283–1286. |
| [15] | 张雪, 谢晓芳, 熊亮, 等. 益母草芳香族化合物对大鼠体外凝血功能影响[J]. 中成药 , 2015, 37 (7) :1573–1575. |
| [16] | 李燕, 谢晓芳, 余泉毅, 等. 筛选益母草注射液缩宫成分[J]. 中成药 , 2015, 37 (7) :1416–1422. |
| [17] | 谢晓芳, 熊亮, 李丹, 等. 益母草注射液有效部位对大鼠离体子宫活动的影响[J]. 中成药 , 2015, 37 (5) :1103–1106. |
| [18] | 何成军, 彭成, 戴鸥, 等. 益母草注射液化学成分研究[J]. 中草药 , 2014, 45 (21) :3048–3052. |
| [19] | 杨槐, 周勤梅, 彭成, 等. 益母草香豆素类化学成分与抗血小板聚集活性[J]. 中国中药杂志 , 2014, 39 (22) :4356–4359. |
| [20] | 赵小梅, 彭成, 熊亮, 等. 益母草注射液有效部位提取及其对凝血系统的影响研究[J]. 中国中医基础医学杂志 , 2014, 20 (3) :390–392. |
| [21] | 赵小梅, 谢晓芳, 熊亮. 益母草注射液主要提取成分对凝血系统影响的筛选[J]. 中国实验方剂学杂志 , 2014, 20 (4) :128–130. |
| [22] | 李丹, 谢晓芳, 彭成, 等. 益母草注射液提取物对流产大鼠离体子宫的影响[J]. 药物评价研究 , 2014, 37 (1) :21–24. |
| [23] | 李丹, 谢晓芳, 彭成, 等. 益母草水提物对子宫收缩活动的影响[J]. 中药与临床 , 2014, 5 (2) :66–68. |
| [24] | 李丹, 谢晓芳, 彭成, 等. 益母草不同提取物调经作用研究[J]. 中药与临床 , 2014, 5 (3) :24–27. |
| [25] | 刘 娟. 益母草正丁醇部位影响子宫平滑肌活动的药效物质基础研究 [D]. 成都: 成都中医药大学, 2016. |
| [26] | 杨 槐. 延龄草及益母草的化学成分研究 [D]. 成都: 成都中医药大学, 2016. |
| [27] | 周勤梅. 益母草的化学成分研究 [D]. 成都: 成都中医药大学, 2014. |
| [28] | 何成军. 附子化学成分研究及益母草注射液化学成分研究 [D]. 成都: 成都中医药大学, 2014. |
| [29] | 胡杨洋, 王胜鹏, 陈锐娥, 等. 赶黄草的药学研究和应用[J]. 中药药理与临床 , 2012, 28 (3) :136–140. |
| [30] | 全国中草药汇编编写组. 全国中草药汇编 (下册)[M].第2版. 北京: 人民卫生出版社, 2000 . |
| [31] | Lu Q, Jiang M H, Jiang J G, et al. Isolation and identification of compounds from Penthorum chinense Pursh with antioxidant and antihepatocarcinoma properties[J]. J Agric Food Chem , 2012, 60 (44) :11097–11103. |
| [32] | 赵建勤, 杨明, 赵连三, 等. 扯根菜及其系统提取物抗乙型肝炎病毒体外实验研究[J]. 中西医结合肝病杂志 , 2002, 12 (1) :26–27. |
| [33] | 肖丽萍, 谢晓芳, 宋洋洋, 等. 赶黄草抗酒精性脂肪肝研究[J]. 中药药理与临床 , 2014, 30 (3) :92–95. |
| [34] | 肖丽萍, 宋洋洋, 周彦希, 等. 赶黄草抗非酒精性脂肪肝的实验研究[J]. 中国实验方剂学杂志 , 2014, 20 (10) :125–129. |
| [35] | He Y C, Peng C, Xie X F, et al. Penchinones A-D, two pairs of cis-trans isomers with rearranged neolignane carbon skeletons from Penthorum chinense[J]. RSC Adv , 2015, 5 (94) :76788–76794. |
| [36] | He Y C, Zou Y, Peng C, et al. Penthorin A and B, two unusual 2,4'-epoxy-8,5'-neolignans from Penthorum chinese[J]. Fitoterapia , 2015, 100 :7–10. |
| [37] | 何亚聪. 赶黄草保护肝细胞药效物质基础研究 [D]. 成都: 成都中医药大学, 2016. |
| [38] | Wu H K, Mao Y J, Sun S S, et al. Leojaponic acids A and B, two new homologous terpenoids, isolated from Leonurus japonicus[J]. Chin J Nat Med , 2016, 14 (4) :303–307. |
| [39] | Jiang J, Li Y, Feng Z, et al. Glucaric acids from Leonurus japonicus[J]. Fitoterapia , 2015, 107 :85–89. |
| [40] | Ye M, Xiong J, Zhu J J, et al. Leonurusoleanolides E-J, minor spirocyclic triterpenoids from Leonurus japonicus fruits[J]. J Nat Prod , 2014, 77 (1) :178–182. |
| [41] | Shang X, Pan H, Wang X, et al. Leonurus japonicus Houtt.: Ethnopharmacology, phytochemistry and pharmacology of an important traditional Chinese medicine[J]. J Ethnopharmacol , 2014, 152 (1) :14–32. |
| [42] | Liu Y, Kubo M, Fukuyama Y. Spirocyclic nortriterpenoids with NGF-potentiating activity from the fruits of Leonurus heterophyllus[J]. J Nat Prod , 2012, 75 (7) :1353–1358. |
| [43] | Gong H Q, Wang R, Shi Y P. New labdane-type diterpenoids from Leonurus heterophyllus[J]. Helv Chim Acta , 2012, 95 (4) :618–625. |
| [44] | Li Y, Chen Z, Feng Z, et al. Hepatoprotective glycosides from Leonurus japonicus Houtt[J]. Carbohydr Res , 2012, 348 :42–46. |
| [45] | Hung T M, Luan T C, Vinh B T, et al. Labdane-type diterpenoids from Leonurus heterophyllus and their cholinesterase inhibitory activity[J]. Phytother Res , 2011, 25 (4) :611–614. |
| [46] | 张琳, 蔡晓菡, 高慧媛. 益母草化学成分的分离与鉴定[J]. 沈阳药科大学学报 , 2009, 26 (1) :15–26. |
| [47] | 蔡晓菡, 车镇涛, 吴斌, 等. 益母草的化学成分[J]. 沈阳药科大学学报 , 2006, 23 (1) :13–14. |
| [48] | 丛悦, 王金辉, 郭洪仁, 等. 益母草化学成分的分离与鉴定Ⅱ[J]. 中国药物化学杂志 , 2003, 13 (6) :349–352. |
| [49] | 王金辉, 丛悦, 李铣, 等. 益母草化学成分的分离与鉴定[J]. 中国药物化学杂志 , 2002, 12 (3) :146–148. |
| [50] | Yeung H W, Kong Y C, Lay W P, et al. The structure and biological effect of leonurine. A uterotonic principle from the Chinese drug, I-mu Ts'ao[J]. Planta Med , 1977, 31 (1) :51–56. |
| [51] | Huang D, Jiang Y, Chen W, et al. Polyphenols with anti-proliferative activities from Penthorum chinense Pursh[J]. Molecules , 2014, 19 (8) :11045–11055. |
| [52] | Wang M, Jiang Y, Liu H L, et al. A new flavanone from the aerial parts of Penthorum chinense[J]. Nat Prod Res , 2014, 28 (2) :70–73. |
| [53] | 付明, 魏麟, 余娟, 等. 扯根菜的化学成分研究[J]. 中国药学杂志 , 2013, 48 (22) :1911–1914. |
| [54] | Zhang T, Chen Y M, Zhang G L. Novel neolignan from Penthorum chinense[J]. J Integr Plant Biol , 2007, 49 (11) :1611–1614. |
| [55] | Trinchant J C, Boscari A, Spennato G, et al. Proline betaine accumulation and metabolism in alfalfa plants under sodium chloride stress. Exploring its compartmentalization in nodules[J]. Plant Physiol , 2004, 135 (3) :1583–1594. |
| [56] | 杨玲霞, 朱旭江, 刘婷婷. 赶黄草袋泡茶中黄酮类成分的定量分析[J]. 中国现代中药 , 2016, 18 (2) :219–221. |
| [57] | 贺劲松, 颖俊, 陈亮, 等. 肝苏颗粒治疗慢性乙型肝炎肝纤维化的临床研究[J]. 中西医结合肝病杂志 , 2007, 17 (3) :136–137. |
| [58] | 张长法, 李子贺, 潘雪飞, 等. 肝苏颗粒治疗非酒精性脂肪性肝炎临床观察[J]. 药物流行病学杂志 , 2007, 16 (1) :5–7. |
| [59] | 四川省中药材标准 [S]. 2010. |
 2016, Vol. 47
2016, Vol. 47


