2. 浙江中医药大学, 浙江 杭州 310053
2. Zhejiang University of Traditional Chinese Medicine, Hangzhou 310053, China
丸剂、散剂等常用传统中药固体制剂,大多直接以药材饮片原粉入药,因此中药粉体的特性对该类中药固体制剂质量影响较大[1-2]。在传统中药固体制剂理论中就十分注重粉体类型的选择,如具有缓释特征的大、小蜜丸一般需选用饮片细粉入药,某些需要速释的丸剂如水丸所选用药材粉体粒径则趋于更小。目前,对于丸剂中粉体类型的选择,多来源于传统制药经验的传承或仅以粒径大小为标准,但由于中药来源复杂,质地、细胞大小、有效成分性质差异悬殊,单纯以粉体粒径作为选择中药固体制剂粉体类型的依据不够充足。
由熟地黄、酒茱萸、山药、泽泻、茯苓、牡丹皮6味中药组成的六味地黄丸是历代医家公认滋阴补肾名方之一,临床上多用于治疗肾阴亏虚、腰膝酸软、盗汗遗精等症[3]。现代药理研究发现,该方具有抗肿瘤、抗炎、调节免疫功能、保护肝肾等药理作用[4-6],被广泛应用于心脑血管、内分泌、泌尿生殖等系统疾病的治疗[7]。六味地黄丸因其疗效确切、不良反应少,现已被制成浓缩丸、大小蜜丸、片剂、口服液、硬胶囊、软胶囊等多种剂型[8]。
本实验拟选择六味地黄丸为研究对象,研究不同类型六味地黄丸(LDP)粉体粒径分布、特征细胞破壁率以及体外溶出特征的差异,并对三者的相关性进行考察,以期通过细胞破壁率来控制有效成分的释放速率和程度,为中药固体制剂制备过程中粉体类型的选择提供依据。
1 仪器与材料MJ33-快速水分测定仪,梅特勒-托利多国际股份有限公司;CLF-20C1000克密封型摇摆式粉碎机,浙江温岭市创力药材器械厂;FDA超细粉碎机,北京兴时利和科技有限公司;MOTIC B2系列生物显微镜,麦克奥迪实业集团有限公司;A2003N型电子天平,上海精密科学仪器科技有限公司;XS105 DualRange型分析天平,梅特勒-托利多仪器(上海)有限公司;RCZ-6B3型药物溶出度仪,上海黄海药检仪器有限公司;KH-250DB型数控超声清洗器,昆山禾创超声仪器有限公司;BT-2001激光粒度分布仪、BT-800湿法分散进样系统,丹东市百特仪器有限公司;Agilent1200高效液相色谱仪,美国Agilent公司。
熟地黄为玄参科植物地黄Rehmannia glutinasa Libosch. 干燥块根的炮制加工品、酒萸肉为山茱萸科植物山茱萸Cornus officinalis Sieb. et Zucc. 的干燥成熟果肉(除去杂质和残留果核)的炮制加工品、牡丹皮为毛茛科植物牡丹Paeonia suffruticosa Andr. 的干燥根皮、茯苓为多孔菌科真菌茯苓Poria cocos (Schw.) Wolf的干燥菌核、山药为薯蓣科植物薯蓣Dioscrea opposite Thunb. 的干燥根茎、泽泻为泽泻科植物泽泻Alisma orientale (Sam.) Juzep. 的干燥块茎,均购于浙江中医药大学中药饮片厂,由浙江中医药大学陈孔荣副教授鉴定。对照品马钱苷(批号111640-201005,质量分数99.6%)、丹皮酚(批号110708-200506,质量分数100%),中国食品药品检定研究院;甲醇(批号15015031)、乙腈(批号14115023),色谱纯,美国天地公司;水(纯净水),杭州娃哈哈集团有限公司;其他试剂均为分析纯。
2 方法与结果 2.1 4种粉体LDP的制备分别取6味药材饮片适量于60 ℃干燥至含水量在3%~5%,粉碎,并按照《中国药典》2015年版一部有关要求,进行筛分,制备粗粉、细粉与极细粉,按文献方法[9-10]制备微粉;将各粉体按处方比例混匀,即得六味地黄丸各药材粗粉、细粉、极细粉与微粉。
2.2 粒径的测定分别取6味药材粗粉、细粉、极细粉、微粉按照处方混合均匀,分别取适量各药材及药材混合细粉、极细粉、微粉样品置于激光粒度分析仪容器内,采用纯水作为分散剂,并将样品进行超声分散,然后分别测定其粒径分布(D)。结果见表 1,表明六味地黄丸各药材的粒径随粉碎程度的增加而减小,均匀度(以D60/D10表示)可以表征粒子的规整程度[11],尽管不同药材粉末的粒径分布略有差异,但粒径明显变小,粒径分布也更均匀。
|
|
表 1 LDP的粒径分布测定结果(x ± s, n = 3) Table 1 Distribution of particle size of LDP (x ± s, n = 3) |
2.3 粉体显微观察及细胞破壁率计算
在六味地黄丸中,熟地黄、山药、茯苓3味药材因炮制或过多淀粉粒干扰,难以观察到其特征细胞,因此本实验选择酒茱萸(石细胞)、泽泻(薄壁细胞)、牡丹皮(木栓细胞)为观测对象。具体方法为在光镜(×400)视野中随机测定50个完整特征细胞的直径,计算完整细胞的平均直径[12],结果完整酒茱萸石细胞、泽泻薄壁细胞、牡丹皮木栓细胞的平均直径及其分布范围分别为72.50(65.29~110.35)、81.32(55.69~132.58)、82.50(70.53~128.59)μm。
理想破壁模型单元的细胞破壁率(η)的计算公式为n>1时,η=1-(1-1/n)3(n为粉末粒径与细胞直径的比值);n≤1时,η=100%[9]。本实验即以上面所测得特征细胞平均直径作为理想破碎模型的细胞直径。结果如表 2所示,方中药材的η随着粉体粒径的减小而增大。
|
|
表 2 酒茱萸、泽泻、牡丹皮各粉体的细胞破壁率测定结果 (x ± s, n = 3) Table 2 Measurement on cellular wall-breaking rate of powder of Corni Fructus, Alismatis Rhizoma, and Moutan Cortex (x ± s, n = 3) |
2.4 LDP中马钱苷和丹皮酚HPLC定量测定方法的建立 2.4.1 色谱条件
色谱柱为Kromasil-C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水,梯度洗脱:0~17 min,11%乙腈;17~18 min,11%~35%乙腈;18~43 min,35%乙腈;检测波长:0~17 min,237 nm;17~25 min,400 nm;25~43 min,274 nm;体积流量1.0 mL/min,进样量20 μL,柱温35 ℃。
2.4.2 对照品溶液的配制精密称定马钱苷对照品1.80 mg和丹皮酚对照品1.39 mg,置50 mL量瓶中,以甲醇-水(1:1)溶解,稀释至刻度,于4 ℃保存备用,过0.45 μm微孔滤膜,取续滤液,即得马钱苷质量浓度为36.0 μg/mL、丹皮酚质量浓度为27.8 μg/mL的混合对照品溶液。
2.4.3 供试品溶液的制备取LDP约0.300 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇溶液50 mL,密塞,称定质量,超声处理60 min,放冷,再称定质量,用50%甲醇补足减失的质量,滤过,滤液置50 mL量瓶中,加50%甲醇溶液至刻度,摇匀,过0.45 μm微孔滤膜,取续滤液,即得LDP供试品溶液。
2.4.4 阴性溶液的制备按处方比例分别称取除酒茱萸、牡丹皮以外的药材细粉,按LDP方剂配伍混匀,按“2.4.3”项下方法制备阴性对照溶液。
2.4.5 方法的专属性考察取混合对照品溶液、供试品溶液和阴性对照溶液按“2.4.1”项下色谱条件分别进样,得到相应的色谱图,见图 1。结果表明在所选的色谱条件下,马钱苷、丹皮酚分离度良好,对称因子分别为0.997、0.954,分离度为18.63、19.08,理论塔板数为18 449、58 391,阴性对照无干扰。
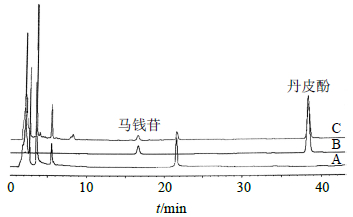
|
图 1 阴性对照溶液(A)、混合对照品溶液(B)和供试品溶液(C)的HPLC图 Fig.1 HPLC of negative sample (A), loganin and paeonol reference substances (B), and sample (C) |
2.4.6 线性关系考察
精密吸取混合对照品溶液1、5、10、15、18、20 μL,按“2.4.1”项下色谱条件进样,记录马钱苷、丹皮酚的峰面积。以峰面积积分值为纵坐标(Y),以进样量为横坐标(X)进行线性回归,得到回归方程:马钱苷Y=1 408.8 X-0.683 5,r=1.000 0,线性范围为36.0~720.0 ng;丹皮酚Y=4 848.2 X-13.442,r=0.999 9,线性范围为27.8~556.0 ng。结果表明马钱苷、丹皮酚在上述范围内成良好的线性关系。
2.4.7 精密度试验取LDP(细粉)供试品溶液,按“2.4.1”项下色谱条件进样,连续进样6次,记录马钱苷、丹皮酚峰面积。计算其峰面积的RSD值分别为0.18%、0.57%,表明该方法的精密度良好。
2.4.8 稳定性试验取LDP(细粉)供试品溶液,按“2.4.1”项下色谱条件分别于供试品溶液配制后0、2、4、8、12、24、36、48 h进样20 μL,记录峰面积积分值。计算马钱苷、丹皮酚峰面积的RSD值分别为2.12%、0.56%,结果表明供试品溶液在48 h内稳定性良好。
2.4.9 重复性试验按“2.4.3”项供试品制备方法平行制备6份LDP(细粉)供试品溶液,按“2.4.1”项下色谱条件进样,测定并计算马钱苷和丹皮酚质量分数。结果马钱苷平均质量分数为334.8 μg/g,RSD值为1.73%;丹皮酚平均质量分数为615.4 μg/g,RSD值为2.01%。结果表明本方法的重复性良好。
2.4.10 加样回收试验取同一批LDP(细粉),精密称取6份,每份约0.15 g,置于具塞锥形瓶中,分别精密加入马钱苷、丹皮酚适量,再精密加入50%甲醇50 mL,按供试品溶液制备方法进行制备,在“2.4.1”项色谱条件下进样,测得峰面积,计算回收率,结果马钱苷和丹皮酚的平均回收率分别为97.5%、100.2%,RSD分别为1.59%、3.64%,结果表明该方法的回收率符合要求。
2.5 溶出度测定采用《中国药典》2015年版四部溶出度与释放度测定法中第二法(桨法)进行测定,以脱气纯净水900 mL为溶出介质,温度为(37.0±0.5)℃,转速为75 r/min。取粗粉、细粉、极细粉、微粉各3份,每份各5 g,分别置于杯内,桨降入溶出介质中,立即计时,分别于2、4、5、10、15 min定位吸取溶液5.00 mL(同时补充同温介质5.00 mL)过微孔滤膜(0.45 μm),取续滤液[13],作为供试品溶液。取供试品溶液各20 μL,在“2.4.1”项色谱条件下进样,记录峰面积,依法计算样品中马钱苷、丹皮酚的量,并分别绘制相对累积释放曲线,见图 2。
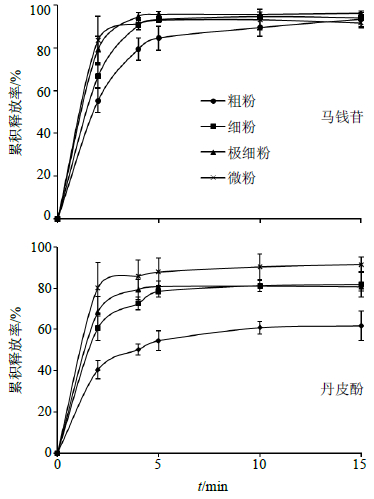
|
图 2 马钱苷与丹皮酚在4种LDP中的累积释放率 Fig.2 Relative cumulative dissolution rates of loganin and paeonol in four kinds of LDP |
3 讨论
丸剂和散剂等以中药粉体入药的固体制剂发挥药效的前提是其中药粉体中有效成分的溶出,本实验选择六味地黄丸中酒茱萸中的马钱苷和牡丹皮中丹皮酚作为指标成分,是基于两者的极性差异较大[14-15],可以更好表征LDP的整体溶出特征。
本实验的目的是对不同粉碎程度的LDP的粒径分布、细胞破壁率以及体外溶出特性进行研究,以考察三者之间的相关性。在研究中发现酒茱萸、泽泻、牡丹皮3味中药细粉的D90在200~300 μm,特征细胞破壁率均在60%左右,在细粉中存在着大量的完整细胞,而这类细胞中药效活性组分扩散需要透过细胞壁,因而需要一定时间,溶出度测定结果也显示六味地黄方细粉中马钱苷和丹皮酚溶出的速率和程度较低,具有一定的缓释特征,在一定程度上验证了蜜丸需用细粉传统中药制剂理论的科学性和阐明了“丸者,缓也”的释药机制。
同时,在对不同类型LDP的粒径分布、细胞破壁率以及马钱苷体外溶出特性比较中发现,从粗粉-细粉-极细粉的变化过程中,粒径-细胞破壁率-溶出度具有较好的正相关性,而从极细粉-微粉的变化过程中,粒径的变化并未引起细胞破壁率和溶出度的改变。粒径与溶出度之间的相关性是具有一定范围的,一旦超过这个范围,粉碎程度的改变将对有效成分溶出的速率和程度的影响变小。而这个范围应该是能引起细胞破壁率改变的粒径变化范围,换而言之粒径与有效成分溶出度之间的相关性是通过破壁率实现的。
以往对于中药粉碎方法的选择,较多地沿用化学药或中药提取物的粉碎原理(通过改变粉体的粒径以使其表面活性改变而控制药物的溶解度和溶出度),一味追求超微粉碎以减小粉体粒径,而忽视了植物类中药有效成分分布于细胞内的这一特征[16]。基于中药粉体具有细胞结构的特殊性,在研究中药粉体该选用何种粉碎方法时,首先需明确其有效成分分布的细胞或细胞器直径,根据该类细胞或细胞器的直径分布范围、有效成分溶出的难易程度和应用于何种类型固体制剂,以此确定需要粉体的细胞破壁率标准,从而有针对性地选择适宜的粉碎方法。
| [1] | 杨明, 韩丽, 杨胜, 等. 基于传统丸、散剂特点的中药粒子设计技术研究[J]. 中草药, 2012,43 (1) :9–13. |
| [2] | 王娟, 狄留庆, 单进军. 中药传统丸剂的释药特点与机制分析[J]. 中成药, 2012,34 (4) :723–730. |
| [3] | 曹占花. 阿卡波糖联合六味地黄丸治疗早期糖尿病肾病的临床疗效观察[J]. 现代药物与临床, 2013,28 (5) :760–762. |
| [4] | Perry B, Zhang J, Saleh T, et al. Liuwei Dihuang, a traditional Chinese herbal formula, suppresses chronic inflammation and oxidative stress in obese rats[J]. J Integr Med, 2014, 12 (5) :447–454 . |
| [5] | Nair S V, Zhang J, Wang Y. Ethanol extract of Liuwei Dihuang reduces weight gain and visceral fat in obese-prone CD rats fed a high-fat diet[J]. Exp Biol Med (Maywood), 2014, 239 (5) :552–558 . |
| [6] | 徐柳, 张树峰. 六味地黄丸的药理作用及临床应用研究[J]. 河北医药, 2013,19 (4) :616–619. |
| [7] | Lian F, Wu H C, Sun Z G, et al. Effects of Liuwei Dihuang Granule (六味地黄颗粒) on the outcomes of in vitro fertilization pre-embryo transfer in infertility women with Kidney-yin deficiency syndrome and the proteome expressions in the follicular fluid[J]. Chin J Integr Med, 2014, 20 (7) :507–509 . |
| [8] | 石伟, 李家春, 刘汉青, 等. 基于多成分定量测定的六味地黄浓缩丸质量分析[J]. 中草药, 2015,46 (7) :1002–1006. |
| [9] | 梁兆昌, 诸洪标, 肖琳, 等. 杜仲超微粉体理化特性及体外溶出性能研究[J]. 中草药, 2015,46 (11) :1609–1614. |
| [10] | 蔡光先, 杨永华. 单味中药超微饮片的质量标准研究[M]. 长沙: 湖南科学技术出版社, 2007 . |
| [11] | 任桂林, 韩丽, 王小平, 等. 微粉化对酒制当归粉体性质及溶出度的影响[J]. 中成药, 2015,37 (4) :762–767. |
| [12] | 国家药典委员会. 中华人民共和国中药材显微鉴别彩色图鉴[M]. 北京: 人民卫生出版社, 2009 . |
| [13] | 鹿丽丽, 萧伟, 徐连明, 等. 不同粒径三七粉物理性质及体外溶出度的比较研究[J]. 世界科学技术—中药现代化, 2013,15 (2) :305–309. |
| [14] | 李雪, 王芳, 赵晓宏. 丹皮酚溶解性能的测定[J]. 中医学报, 2013,28 (2) :221–223. |
| [15] | 蔡光先. 超微中药的临床应用和实验研究[M]. 北京: 中国中医药出版社, 2011 . |
| [16] | 李凤生, 姜炜, 付廷明, 等. 药物粉体技术[M]. 北京: 化学工业出版社, 2007 . |
 2016, Vol. 47
2016, Vol. 47


