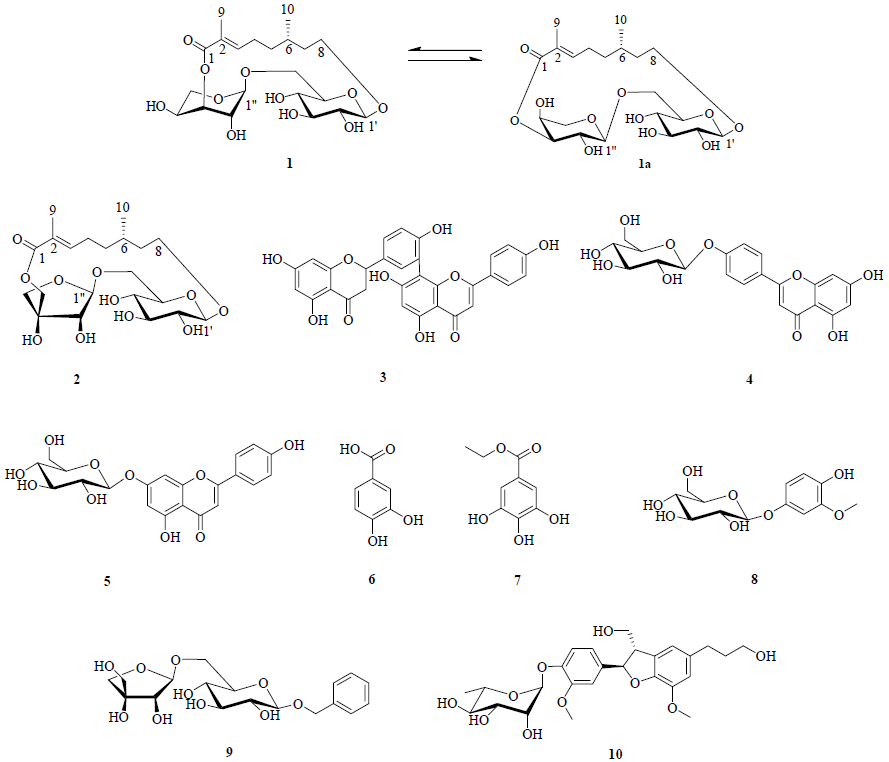
莛子藨Triosteum pinnatifidum Maxim. 系忍冬科(Caprifoliaceae)莛子藨属Triosteum Linn. 多年生草本植物。莛子藨的根天王七属于“陕西七药”之一,是一种常用的民间药,味苦、涩,性平,具有祛风湿、健脾胃、理气活血、消炎镇痛、生肌之功效。其叶称天王七叶,味苦、涩,性平,有止血生肌之功效[1]。前人已经对莛子藨化学成分进行了一定的研究,并从中分离得到了环烯醚萜类[2-3]、黄酮类[4-6]、苯丙素类[5, 7-8]、生物碱类[9]、甾体类[10]以及单萜二糖苷类[9]等化合物,为了挖掘该植物的药用价值,开发新的中草药资源,本实验进一步对采自陕西眉县的莛子藨地上部分进行系统研究,并从其乙醇提取物中分离得到10个化合物,结构见图 1。其中包括2个单萜二糖苷:(E)-(6S)-8-[α-L-arabinopyranosyl-(1→6)-β-D-glucopyranosyloxy]-2,6-dimethyloct-2-eno-1,3″-lactone(1)、urceolide(2)和8个酚类化合物:2,3-二氢穗花杉双黄酮(2,3-dihydroamentoflavone,3)、芹菜素4′-O-β-D-葡萄糖苷(apigenin-4′-O-β-D-glucoside,4)、芹菜素7-O-β-D-葡萄糖苷(apigenin- 7-O-β-D-glucoside,5)、原儿茶酸(protocatechuic acid,6)、没食子酸乙酯(ethyl gallate,7)、tachioside(8)、icariside F2(9)、icariside E4(10)。除化合物2外,其他化合物均为首次从本属植物中分离得到。
|
图 1 化合物1~10的结构 Fig.1 Structures of compounds 1—10 |
1 仪器与材料
Bruker Tensor 27红外光谱仪(瑞士Bruker公司);Bruker Avance DRX-500型核磁共振谱仪(500 MHz,瑞士Bruker公司);Bruker AvanceIII液体核磁共振谱仪(600 MHz,瑞士Bruker公司);Bruker micrOTOF-QII高分辨率质谱仪(瑞士Bruker公司);薄层色谱硅胶(GF254,10~40 μm)、柱色谱硅胶(100~200、200~300目)为青岛海洋化工厂产品;聚酰胺(60~80目)为浙江台州路桥四甲生化塑料厂产品;Sephadex LH-20葡聚糖凝胶为Amersham Pharmacia生物技术公司产品;ODS柱色谱硅胶(20~45 μm)为Fuji Silysia化学有限公司产品;D101大孔吸附树脂由天津市海光化工有限公司生产;ZORBAX SB-C18制备柱(250 mm×21.2 mm,7 μm)、ZORBAX SB-C18分析柱(250 mm×4.6 mm,5 μm)为美国安捷伦公司产品;色谱甲醇购自天津市康科德科技有限公司;其他试剂均为分析纯。
药材莛子藨的地上部分在2006年采于陕西省眉县,由西北农林科技大学的吴振海教授鉴定为莛子藨Triosteum pinnatifidum Maxim.,标本(S200608007A)保存于天津大学药物科学与技术学院天然药物化学实验室。
2 方法 2.1 提取与分离取莛子藨干燥地上部分5.5 kg,95%乙醇冷浸3周,95%乙醇回流提取2次,每次2 h,60%乙醇回流提取2次,每次2 h。减压回收溶剂得浸膏400 g,加2 L蒸馏水混悬,然后用等体积石油醚、氯仿、醋酸乙酯、正丁醇依次进行萃取,得醋酸乙酯萃取部分(44.8 g)、正丁醇萃取部分(113 g)。取醋酸乙酯萃取部分(40 g)经硅胶柱色谱分离,以二氯甲烷-甲醇(9:1→0:100)梯度洗脱,通过薄层色谱检查得到4个组分(Fr. 1~4)。Fr. 2(4.0 g)经硅胶柱色谱分离,以石油醚-醋酸乙酯(7:3→5:5)→醋酸乙酯→甲醇为洗脱液,得30个组分(Fr. 2.1~2.30)。通过TLC检识合并Fr. 2.13~2.16(525 mg),然后通过2次聚酰胺柱色谱分离,得到化合物6(120 mg)和7(10 mg)。Fr. 2.17~2.21(553 mg)经硅胶柱色谱分离,二氯甲烷-甲醇(100:1→50:1→10:1)洗脱,再通过Sephadex LH-20柱色谱(甲醇)纯化得化合物3(30 mg)。Fr. 3(2.0 g)经硅胶柱色谱分离,二氯甲烷-甲醇(94:6→9:1→7:3)洗脱得42个组分,通过TLC检识合并Fr. 3.24~3.26,经过2次制备型HPLC进行纯化(依次用甲醇-水62:38、甲醇-水40:60为流动相)得化合物10(5 mg)。正丁醇部分经D101大孔吸附树脂柱色谱分离,以乙醇-水(0:100→30:70→50:50→95:5)洗脱,得4个组分(Fr. A~D)。组分Fr. B 29 g通过硅胶柱色谱,醋酸乙酯-甲醇(9:1→3:7)梯度洗脱,得5个组分(Fr. B1~B5)。Fr. B2(1.05 g)经硅胶柱色谱分离,以二氯甲烷-甲醇(96:4→95:5→92:8→8:2→0:100)为洗脱液,得40个组分(Fr. B2.1~B2.40)。Fr. B2.33~B2.39经过2次硅胶柱色谱分离,二氯甲烷-甲醇(96:4,9:1)洗脱,再通过制备型HPLC分离纯化,44%甲醇为流动相,得化合物1(20 mg)和8(6 mg)。Fr. B4(6.5 g)经硅胶柱色谱分离,醋酸乙酯-甲醇(92:8→84:16→6:4)洗脱得29个组分。Fr. B4.16~B4.20(3.1 g)经ODS柱色谱分离,甲醇-水(22:88)等度洗脱,再通过制备型HPLC纯化(甲醇-水24:86)得化合物9(10 mg)。Fr. C(10 g)通过硅胶柱色谱分离,以醋酸乙酯-甲醇(9:1→3:7)为洗脱液,得12个组分(Fr. C1~C12)。Fr. C7~C9通过甲醇重结晶分为黄色晶体部分和母液部分,晶体部分(60 mg)经聚酰胺柱色谱分离,丙酮洗脱得化合物4和5的混合物(8 mg)。母液部分(606 mg)经Sephadex LH-20柱色谱(甲醇)分离纯化,得化合物2(40 mg)。
2.2 化合物1的薄层酸水解取少量化合物1 ,甲醇溶解,点样于硅胶GF254薄层板上,置于加有浓盐酸的烧杯中(底部放一支持物使薄层板不直接与盐酸接触),密封烧杯,于80 ℃水浴加热20 min,取出后晾干,再与多种单糖对照品进行共薄层检查,以醋酸乙酯-甲醇-水-冰醋酸(13:2:1:1)为展开剂,苯胺-邻苯二甲酸为显色剂。
3 结构解析化合物1:白色固体,易溶于甲醇,难溶于二氯甲烷。HR-ESI-MS m/z: 485.201 5[M+Na]+(C21H34O11Na+,计算值485.199 9),确定分子式为C21H34O11。将化合物1的1H-NMR和13C-NMR数据与2比较,二者非常相似,提示它们具有相同的骨架,推测化合物1为单萜二糖苷类化合物。进一步分析,1相比于2 ,氢谱中芹糖的信号消失,多了另一组糖信号,因此推测化合物1与2的区别在于其中的芹糖变化成为另外一种糖。薄层酸水解结果表明化合物1中含有阿拉伯糖和葡萄糖。通过进一步分析1H-NMR、1H-1H COSY和HSQC谱图,确定另一个糖为1C4式的α-L-阿拉伯糖[11-12](表 1)。HMBC谱中显示δH 4.25 (H-1′) 与δC 68.2 (C-8) 有HMBC相关,δH 4.66 (H-1″) 与δC 67.4 (C-6′) 有HMBC相关,δH 5.07 (H-3″) 与δC 169.2 (C-1) 有HMBC相关,确定连接顺序为8-[α-L-arabinopyranosyl- (1→6)-β-D-glucopyranosyloxy]-2,6-dimethyloct-2-eno- 1,3″-lactone。NOESY谱图显示δH 1.90 (H3-9) 与δH 2.34 (H2-4) 有NOE相关,确定2、3位双键构型为E,如图 2所示。根据单萜二糖苷的生源途径,与化合物2对比,确定6位碳的绝对构型为S构型。综上所述,确定化合物1结构应为 (E)-(6S)-8-[α-L- arabinopyranosyl-(1→6)-β-D-glucopyranosyloxy]-2,6- dimethyloct-2-eno-1,3″-lactone。因此Zhu等[13-14]将从Winchia calophylla A. DC. 分离得到的wincaloside A中的阿拉伯糖确定为β-L-阿拉伯糖是有误的,应该更正为1C4式的α-L-阿拉伯糖[11-12]。
|
|
表 1 化合物1和1a的 1H-NMR数据以及化合物1的13C-NMR数据 Table 1 1H-NMR data of compounds 1 and 1a and 13C-NMR data of compound 1 |
|
图 2 化合物1的重要HMBC(→)和NOESY(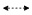  |
将化合物1的甲醇溶液在室温放置1周后进行1H-NMR谱分析,氢谱显示为混合物(化合物1和少量1a),尝试采用制备型HPLC(甲醇-水49:51)进行分离化合物1(tR=11.53 min)和1a(tR=17.72 min),分别收集只含有1和1a 的流分,然后分析其纯度,结果前者是化合物1 ,而后者仍是1和1a 的混合物,由此推测化合物1和1a 可能存在构象相互转换现象。将化合物1的甲醇溶液在室温放置6个月后进行1H-NMR分析,从氢谱积分得出二者的比例约为3:2。通过分析1a 的1H-NMR和COSY谱图确定化合物1a 的阿拉伯糖为4C1式[15],由此表明是化合物1中的阿拉伯糖发生了构象翻转现象产生了1a ,即吡喃阿拉伯糖由1C4式转变成了4C1式[16](图 1)。同时说明化合物1和1a 的甲醇溶液在室温条件下容易发生相互转换并达到动态平衡。
化合物2:无色针状晶体(甲醇)。1H-NMR (600 MHz,CD3OD) δ: 6.80 (1H,brdd,J = 7.4,7.4 Hz,H-3),2.34 (1H,m,H-4a),2.15 (1H,m,H-4b),1.64 (1H,overlapped,H-5a),1.26 (1H,m,H-5b),1.64 (1H,overlapped,H-6),1.64 (1H,overlapped,H-7a),1.45 (1H,m,H-7b),3.10 (1H,m,H-8a),3.55 (1H,m,H-8b),1.84 (3H,s,9-CH3),0.94 (3H,d,J = 6.3 Hz,10-CH3),4.23 (1H,d,J = 7.8 Hz,H-1′),3.17 (1H,brdd,J= 8.9,7.9 Hz,H-2′),3.30~3.40 (3H,overlapped,H-3′~5′),3.94 (1H,dd,J = 10.8,1.5 Hz,H-6′a),3.64 (1H,dd,J= 10.9,4.8 Hz,H-6′b),4.97 (1H,d,J = 2.3 Hz,H-1″),4.06 (1H,d, J = 2.2 Hz,H-2″),4.08 (1H,d,J = 9.6 Hz,H-4″a),3.77 (1H,d,J= 9.8 Hz,H-4″b),4.08 (2H,s,H-5″)。以上数据与文献报道基本一致[9],因此鉴定化合物2为urceolide。
化合物3:淡黄色粉末。1H-NMR (600 MHz,DMSO-d6)δ: 5.51 (1H,dd,J = 12.6,2.6 Hz,H-2),3.35 (1H,dd,J = 16.2,16.2 Hz,H-3a),2.68 (1H,overlapped,H-3b),12.15 (1H,s,5-OH),5.88 (1H,brs,H-6),5.88 (1H,brs,H-8),7.41 (1H,overlapped,H-2′),7.02 (1H,brd,J = 8.4 Hz,H-5′),7.38 (1H,overlapped,H-6′),6.78 (1H,s,H-3″),13.07 (1H,s,5″-OH),6.37 (1H,s,H-6″),7.58 (2H,d,J = 9.0 Hz,H-2′′′,6′′′),6.78 (2H,d,J = 9.0 Hz,H-3′′′,5′′′);13C-NMR (150 MHz,DMSO-d6) δ: 78.6 (C-2),42.4 (C-3),196.3 (C-4),163.5 (C-5),95.8 (C-6),166.6 (C-7),95.0 (C-8),163.1 (C-9),101.7 (C-10),128.6 (C-1′),127.8 (C-2′),119.0 (C-3′),156.0 (C-4′),115.5 (C-5′),131.4 (C-6′),163.6 (C-2″),102.4 (C-3″),182.1 (C-4″),160.3 (C-5″),98.5 (C-6″),161.9 (C-7″),104.8 (C-8″),154.4 (C-9″),103.6 (C-10″),121.4 (C-1′′′),128.3 (C-2′′′),115.8 (C-3′′′),161.0 (C-4′′′),115.8 (C-5′′′),128.3 (C-6′′′)。以上数据与文献报道基本一致[17-18],因此鉴定化合物3为2,3-二氢穗花杉双黄酮。
化合物4:淡黄色固体。1H-NMR (600 MHz,DMSO-d6)δ: 6.89 (1H,s,H-3),6.52 (1H,d,J = 1.8 Hz,H-6),6.21 (1H,d,J = 1.8 Hz,H-8),8.04 (2H,d,J = 9.0 Hz,H-2′,6′),7.20 (2H,d,J = 9.0 Hz,H-3′,5′),5.04 (1H,d,J = 7.8 Hz,H-1″),3.14~3.75 (6H,m,H-2″~6″)。以上数据与文献报道基本一致[19],因此鉴定化合物4为芹菜素-4′-O-β-D-葡萄糖苷。
化合物5:淡黄色固体。1H-NMR (600 MHz,DMSO-d6)δ: 6.87 (1H,s,H-3),6.84 (1H,d,J = 2.4 Hz,H-6),6.45 (1H,d,J = 2.4 Hz,H-8),7.96 (2H,d,J = 9.0 Hz,H-2′,6′),6.95 (2H,d,J = 9.0 Hz,H-3′,5′),5.08 (1H,d,J = 6.6 Hz,H-1″),3.14~3.75 (6H,m,H-2″~6″)。以上数据与文献报道基本一致[19],因此鉴定化合物5为芹菜素-7-O-β-D-葡萄糖苷。
化合物6:无色针状晶体。1H-NMR (600 MHz,DMSO-d6)δ: 7.34 (1H,d,J = 1.8 Hz,H-2),6.78 (1H,d,J = 8.4 Hz,H-5),7.29 (1H,dd,J = 8.4,1.8 Hz,H-6)。以上数据与文献报道基本一致[20],因此鉴定化合物6为原儿茶酸。
化合物7:白色固体。1H-NMR (600 MHz,CD3OD) δ: 7.04 (2H,s,H-2,6),4.27 (2H,q,J = 7.1 Hz,H-8),1.35 (3H,t,J = 7.1 Hz,H-9)。以上数据与文献报道基本一致[21],因此鉴定化合物7为没食子酸乙酯。
化合物8:白色固体。1H-NMR (600 MHz,CD3OD) δ: 6.82 (1H,d,J = 2.5 Hz,H-3),6.60 (1H,dd,J = 8.7,2.5 Hz,H-5),6.71 (1H,d,J = 8.7 Hz,H-6),4.76 (1H,d,J = 7.2 Hz,H-1′),3.30~3.60 (4H,m,H-2′~5′),3.92 (1H,brd,J = 12.0 Hz,H-6′a),3.70 (1H,dd,J = 11.8,5.8 Hz,H-6′b),3.85 (1H,s,-OMe);13C-NMR (150 MHz,CD3OD) δ: 142.9 (C-1),149.3 (C-2),103.8 (C-3),152.8 (C-4),109.9 (C-5),116.0 (C-6),56.3 (-OMe),103.7 (C-1′),75.0 (C-2′),78.0 (C-3′),71.6 (C-4′),78.2 (C-5′),62.6 (C-6′)。以上数据与文献报道基本一致[22],因此鉴定化合物8为tachioside。
化合物9:白色固体。1H-NMR (600 MHz,CD3OD) δ: 7.43 (2H,brd,J = 7.5 Hz,H-2,6),7.33 (2H,t-like,J = 7.2,7.5 Hz,H-3,5),7.27 (1H,t-like,J = 7.5,7.2 Hz,H-4),4.65 (1H,d,J = 12.0 Hz,H-7a),4.90 (1H,d,J = 12.0 Hz,H-7b),4.33 (1H,d,J = 7.7 Hz,H-1′),3.25 (1H,m,H-2′),3.34 (1H,m,H-3′),3.28 (1H,m,H-4′),3.40 (1H,m,H-5′),3.63 (1H,dd,J = 6.6,10.8 Hz,H-6′a),4.10 (1H,dd,J = 11.0,2.0 Hz,H-6′b),5.05 (1H,d,J = 2.5 Hz,H-1″),3.94 (1H,brs,H-2″),3.78 (1H,d,J= 9.0 Hz,H-4″a),4.00 (1H,d,J = 9.0 Hz,H-4″b),3.59 (2H,s,H2-5″)。以上数据与文献报道基本一致[23],因此鉴定化合物9为icariside F2。
化合物10:白色固体。1H-NMR (600 MHz,CD3OD) δ: 5.57 (1H,d,J = 5.9 Hz,H-2),3.46 (1H,brq, J = 5.4 Hz,H-3),3.85 (1H,overlapped,H-3a1),3.75 (1H,dd,J = 11.4,7.8 Hz,H-3a2),6.74 (1H,brs,H-4),2.65 (2H,t,J = 7.7 Hz,H2-5a),1.84 (2H,tt,J = 7.7,6.5 Hz,H-5b),3.58 (2H,t,J = 6.5 Hz,H-5c),6.76 (1H,brs,H-6),7.05 (1H,brs,H-2′),7.10 (1H,d,J = 8.4 Hz,H-5′),6.93 (1H,brd,J = 8.4 Hz,H-6′),3.89 (3H,s,7-OMe),3.82 (3H,s,3′-OMe),5.36 (1H,d,J = 1.8 Hz,H-1″),4.08 (1H,dd,J = 1.8,3.6 Hz,H-2″),3.88 (1H,overlapped,H-3″),3.47 (1H,dd,J = 9.6,9.6 Hz,H-4″),3.80 (1H,overlapped,H-5″),1.23 (3H,d,J = 6.0 Hz,6″-CH3);13C-NMR (150 MHz,CD3OD) δ: 88.6 (C-2),55.7 (C-3),65.1 (C-3a),117.9 (C-4),129.6 (C-4a),137.1 (C-5),32.9 (C-5a),35.8 (C-5b),62.2 (C-5c),114.1 (C-6),145.3 (C-7),147.5 (C-7a),138.8 (C-1′),111.2 (C-2′),152.1 (C-3′),146.6 (C-4′),119.6 (C-5′),119.1 (C-6′),56.4 (7-OMe),56.8 (3′-OMe),101.4 (C-1″),72.1 (C-2″),72.2 (C-3″),73.8 (C-4″),70.8 (C-5″),18.0 (C-6″)。以上数据与文献报道基本一致[24],因此鉴定化合物10为icariside E4。
| [1] | 郭增军. 陕西七药[M]. 西安: 陕西科学技术出版社, 2003 . |
| [2] | Chai X, Su Y F, Zheng Y H, et al. Iridoids from the roots of Triosteum pinnatifidum[J]. Biochem Syst Ecol, 2010, 38 (2) :210–212 . |
| [3] | 柴欣. 天王七和荞麦七的化学成分与生物活性研究 [D]. 天津: 天津大学, 2010. |
| [4] | 周清东. 白果七化学成分研究 [D]. 杨凌: 西北农林科技大学, 2010. |
| [5] | 丁欢星. 莛子藨的化学成分研究和叶绿素铜钠盐的制备工艺研究 [D]. 兰州: 兰州大学, 2012. |
| [6] | 周家莉. 羽裂莛子藨地上部分的化学成分研究 [D]. 天津: 天津大学, 2011. |
| [7] | Chai X, Su Y F, Yan S L, et al. Chemical constituents from the roots of Triosteum pinnatifidum[J]. Chem Nat Compd, 2014, 50 (6) :1149–1152 . |
| [8] | 杨健. 四种太白山药用植物的化学成分研究 [D]. 杨凌: 西北农林科技大学, 2011. |
| [9] | Huang X, Li Y, Su Y F, et al. Monoterpene indole alkaloids and monoterpene diglycosides from the roots of Triosteum pinnatifidum[J]. Phytochem Lett, 2014, 7 :30–34 . |
| [10] | Xing D H, Jun C Y, Jie Z, et al. Chemical constituents from the aerial parts of Triosteum pinnatifidum[J]. Chem Nat Compd, 2013, 49 (1) :95–96 . |
| [11] | Matsuo Y, Takaku R, Mimaki Y. Novel steroidal glycosides from the bulbs of Lilium pumilum[J]. Molecules, 2015, 20 (9) :16255–16265 . |
| [12] | Su Y F, Koike K, Guo D A, et al. New apiose-containing triterpenoid saponins from Conyza blinii[J]. Tetrahedron, 2001, 57 (31) :6721–6726 . |
| [13] | Zhu W M, Lu C H, Wang Y, et al. Monoterpenoids and their glycosides from Winchia calophylla[J]. J Asian Nat Prod Res, 2004, 6 (3) :193–198 . |
| [14] | Zhu W M, Wang B G, Wang Y K, et al. Two new monoterpenoids diglycosides from Winchia calophylla A. DC[J]. Chin Chem Lett, 2003, 14 (10) :1029–1032 . |
| [15] | Mabou F D, Ngnokam D, Harakat D, et al. New oleanane-type saponins: Leptocarposide B-D, from Ludwigia leptocarpa (Onagraceae)[J]. Phytochem Lett, 2015, 14 :159–164 . |
| [16] | Yan M C, Liu Y, Lu W X, et al. Facile synthesis and cytotoxicity of triterpenoid saponins bearing a unique disaccharide moiety: hederacolchiside A1 and its analogues[J]. Carbohydr Res, 2008, 343 (4) :780–784 . |
| [17] | Markham K R, Sheppard C, Geiger H. 13C-NMR studies of some naturally occurring amentoflavone and hinokiflavone biflavonoids[J]. Phytochemistry, 1987, 26 (12) :3335–3337 . |
| [18] | Markham K R, Franke A, Molloy V P J, et al. Flavonoid profiles of New Zealand Libocedrus and related genera[J]. Phytochemistry, 1990, 29 (2) :501–507 . |
| [19] | Oyama K I, Kondo T. Total synthesis of apigenin 7,4'-di-O-β-glucopyranoside, a component of blue flower pigment of Salvia patens, and seven chiral analogues[J]. Tetrahedron, 2004, 60 (9) :2025–2034 . |
| [20] | Yun X J, Shu H M, Chen G Y, et al. Chemical constituents from barks of Lannea coromandelica[J]. Chin Herb Med, 2014, 6 (1) :65–69 . |
| [21] | 谭菁菁, 赵庆春, 杨琳, 等. 白芍化学成分研究[J]. 中草药, 2010,41 (8) :1245–1248. |
| [22] | 杨竹雅, 卫莹芳, 周志宏. 厚朴叶中具血管活性作用部位的化学成分研究[J]. 中草药, 2013,44 (3) :260–264. |
| [23] | Helfrich E, Rimpler H. Iridoid glycosides and phenolic glycosides from Holmskioldia sanguinea[J]. Phytochemistry, 1999, 50 (4) :619–627 . |
| [24] | Nakanishi T, Iida N, Inatomi Y, et al. Neolignan and flavonoid glycosides in Juniperus communis var. depressa[J]. Phytochemistry, 2004, 65 (2) :207–213 . |
 2016, Vol. 47
2016, Vol. 47


