2. 天士力研究院, 天士力集团有限公司, 天津 300410;
3. 天津大学药物科学与技术研究院, 天津 300072
2. Tasly Academy, Tasly Holding Group Co., Ltd., Tianjin 300410, China;
3. School of Pharmaceutical Science and Technology, Tianjin University, Tianjin 300072, China
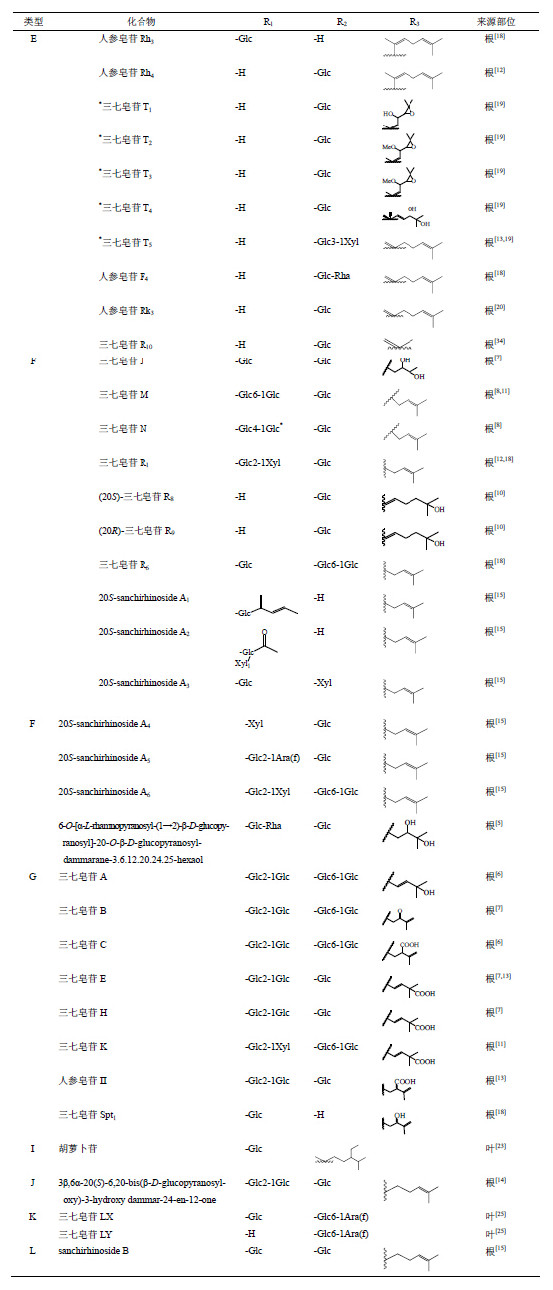
三七Panax notoginseng (Burk.) F. H. Chen为五加科人参属植物,是我国名贵中药材,也是云南独具特色的中药材资源。三七用于治疗疾病有悠久的历史,在《本草纲目》以前的《医门秘旨》、《跌损妙方》中已有记载。皂苷是三七的主要有效成分之一,迄今为止,已从三七的不同部位(根、茎叶、花蕾、种子等)分离得到70余种单体皂苷,这些单体皂苷成分大多数可分为达玛烷型的20(S)-原人参二醇 [20(S)-protopanaxadio] 和20(S)-原人参三醇 [20(S)-peotopanaxatriol] 2种类型。其中人参皂苷Rb1是主要的原人参二醇型皂苷,人参皂苷Re、Rg1和三七皂苷R1是主要的原人参三醇型皂苷成分,该4种成分(结构式见图 1)在三七总皂苷中的量分别为30%、2.5%、20%、2.5%。其中人参皂苷Rg1、Rb1和三七皂苷R1在维持血液循环、改善心肌缺血、抗心律失常、抗休克、镇静、提高智力、抗衰老、抗氧化、抗细胞增殖和抗肿瘤等方面均显示出一定的药理作用[1, 2, 3, 4]。
 | 图 1 人参皂苷Rb1、Re、Rg1和三七皂苷R1结构Fig. 1 Structures of ginsenosides Rb1, Re, Rg1, and notoginsenoside R1 |
尽管三七中皂苷成分种类繁多,但主要成分仅有人参皂苷Rg1、Rb1、Rb2、Rc、Rd、Re和三七皂苷R1。微量皂苷成分由于量极少很难获得,但其具有一定的药理活性[5],所以微量皂苷成分提取对三七研究仍有重要意义。传统认为三七具有止血散瘀、消肿定痛的功效,现代药理学表明其具有止血、保护心肌细胞、保护脑组织、调血脂、抗血栓、增强免疫力、抗炎、抗纤维化、抗肿瘤、清除氧自由基、抗氧化等作用。本文就三七中不同部位的皂苷成分以及三七在血液系统、心脑血管系统、神经系统、免疫系统等方面的药理作用进行综述。
1 三七中皂苷成分 1.1 三七根中皂苷成分三七根是提取皂苷成分的重要部位。三七根包含三七芦头、三七主根、三七须根和三七支根,味苦涩、性凉,具有扩张冠状动脉、增加冠状动脉血流量、降低心肌耗氧量、改善心肌功能,是心绞痛和冠心病患者的极佳良药,并有延缓衰老等作用,许多新型三七皂苷类成分均从其中获得。
固液分离法和液液分离法是皂苷提取的常见方法,随着学科交叉进入新的阶段,提取分离方法不断地被改进,本文根据不同的提取方法对三七根中的皂苷成分进行综述。
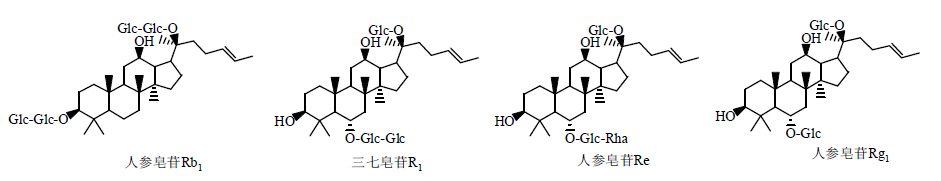
1.1.1 固液分离法固液分离法是皂苷提取的传统方法。1997年,Yoshikawa等[6, 7, 8]首次从干燥的三七根中用甲醇提取分离得到12种新型的皂苷类化合物:三七皂苷A、B、C、D、E、G、H、I、J、L、M、N。赵平等[9]经硅胶柱色谱,CHCl3-MeOH-H2O(50∶10∶1→20∶10∶1)梯度洗脱,其中50∶10∶1洗脱部分中的1个流分经用反复硅胶柱色谱,以CHCl3-MeOH-H2O(15∶19∶1)梯度洗脱,从三七根中得到1个微量皂苷三七皂苷R7,结构为人参二醇-3-O-β-D吡喃葡萄糖苷(panaxadiol-3-O-β-D- glucopyranoside)。同时,Zhao等[10]再次从三七根中分离得到2种新型微量皂苷三七皂苷R8和三七皂苷R9。Ma等[11]采用甲醇提取和反相硅胶柱色谱法,从三七干燥根中,在分离得到11种已知化合物(人参皂苷Rd、Rb1、Rb2、Rh1、Rg2、Rg1、Re和三七皂苷R4、R2、R3、R1)的同时,分离提取出3种新型皂苷三七皂苷K、L和M。曾江等[12]和宋建平等[13]采用大孔吸附树脂、硅胶、RP8和RP18柱色谱法,先后从三七根茎中鉴定得到13种化合物:人参皂苷Rh1、人参皂苷Re、三七皂苷R1、人参皂苷Rd、人参皂苷Rb1、三七皂苷T5、人参皂苷F1、人参皂苷F2、三七皂苷E,三七皂苷S、三七皂苷T(首次从三七根中分离得到),以及人参皂苷II和人参皂苷Rh4(首次从三七中分离得到)。人参皂苷II结构见图 2。
 | 图 2 人参皂苷II结构 Fig. 2 Structure of ginsenoside II |
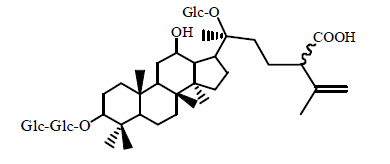
目前,固液分离法仍作为主要的分离皂苷的方法。近几年中,研究者们利用固液分离法仍获得了多种新型皂苷成分。2013年,Sakah等[14]采用乙醇抽提和硅胶柱色谱法,从三七根中除了分离得到6种常见的皂苷外,同时还得到2种新型化合物,分别为sanchirhinoside D(属于原人参二醇型皂苷)、3β, 6α-20(S)-6,20-bis(β-D-glucopyranosyloxy)-3-hydroxy dammar-24-en-12-one(属于原人参三醇型皂苷),化学结构见图 3。
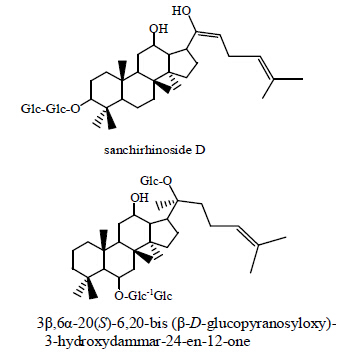 | 图 3 Sanchirhinoside D和3β,6α-20(S)-6,20-bis(β-D- glucopyranosyloxy)-3-hydroxydammar-24-en-12-one结构Fig. 3 Structures of sanchirhinoside D and 3β,6α-20(S)-6,20- bis(β-D-glucopyranosyloxy)-3-hydroxydammar-24-en-12-one |
2013年,Zhang等[15]采用醇抽提法,从三七根中分离得到7种新型的微量原人参三醇类皂苷,分别为20S-sanchirhinoside A1、A2、A3、A4、A5、A6及sanchirhinoside B,其中化合物20S-sanchirhino- side A4、A6和sanchirhinoside B在L6细胞损伤实验中,显示出明显的抗黏蛋白保护作用。7种化合物结构见图 4。
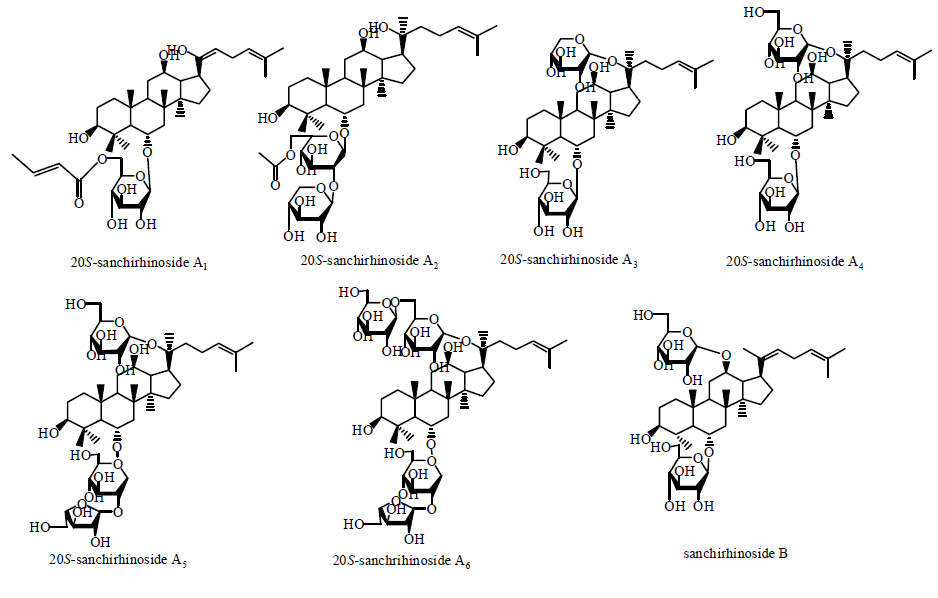 | 图 4 20S-Sanchirhinoside A1~A6及sanchirhinoside B结构Fig. 4 Structures of 20S-sanchirhinoside A1—A6, and sanchirhinoside B |
液液分离法是将样本放置于2种不相溶的溶剂中,利用化合物在2种溶剂中的分配系数不同,从而实现物质的分离。离心分配色谱法和高效逆流色谱法是2种常见的液液分离法[16]。2010年,Wang等[17]采用离心分配色谱法从三七根中分离出4种常见皂苷三七皂苷R1和人参皂苷Rg1、Re、Rb1。2013年,Zhang等[18]采用加速溶剂萃取法和高效逆流色谱法对三七成分进行提取分离,从三七根中得到6种皂苷成分,包括三七皂苷R6、Spt1、Rk1和人参皂苷F4、Rg3、Rs3。化学结构见图 5。
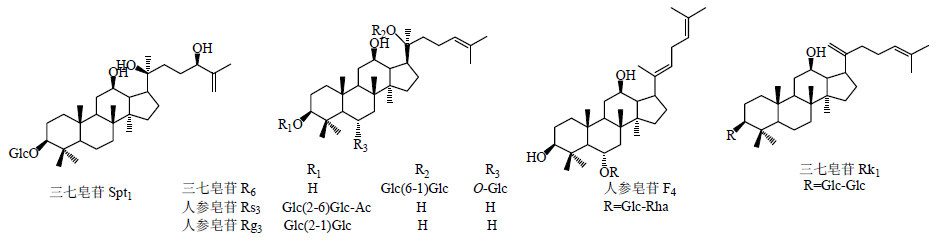 | 图 5 三七皂苷Spt1、R6、Rk1和人参皂苷Rs3、Rg3、F4的化学结构图Fig. 5 Structures of ginsenosides Rs3, Rg3, F4, and notoginsenoside Spt1, R6, Rk1 |
2004年,Teng等[19]在弱酸性(AcOH-EtOH 1∶1)条件下,采用水解反应,在提取15种已知成分的同时,分离得到5种新型皂苷成分,分别为三七皂苷T、T2、T3、T4和T5。2012年,Wang等[20]采用蒸干和烘烤的方法,从三七根中分离得到人参皂苷20(S)-Rh1、Rg3和20(R)-Rh1、Rk3、Rh4、Rg3、Rk1、Rg5,化学结构见图 6。
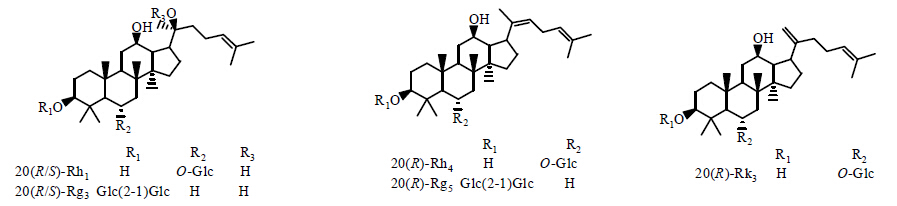 | 图 6 人参皂苷20(S)-Rh1、Rg3和20(R)-Rh1、Rk3、Rh4、Rg3、Rk1、Rg5结构图Fig. 6 Structures of ginsenosides 20(S)-Rh1, Rg3 and 20(R)-Rh1, Rk3, Rh4, Rg3, Rk1, Rg5 |
2013年,Luo等[5]采用生物转化法,从三七中分离得到1种新型化合物6-O-[α-L-rhamnopyranosyl- (1→2)-β-D-glucopyranosyl]-20-O-β-D-glucopyranosyl-dammarane-3.6.12.20.24.25-hexaol,化学结构见图 7,该化合物为白色粉末状,化学式为C48H84O20。
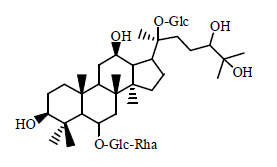 | 图 7 6-O-[α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranosyl]-20- O-β-D-glucopyranosyl-dammarane-3.6.12.20.24.25-hexaol结构Fig. 7 Structure of 6-O-[α-L-rhamnopyranosyl-(1→2)-β-D- glucopyranosyl]-20-O-β-D-glucopyranosyl-dammarane-3.6.12. 20.24.25-hexaol |
三七叶中总皂苷量4%~6%,其中人参皂苷Rb3、人参皂苷Rc、三七皂苷Fc和人参皂苷Rb1量最高。对三七茎叶的化学研究表明,其仅含有原人参二醇型皂苷,几乎不含原人参三醇型皂苷,这是与三七主根皂苷的最大不同点,此外三七茎叶中还含有少量的黄酮类化合物。20世纪80年代初已有文献报道三七茎叶的主要有效成分包括有人参皂苷Rb1、Rb3、Re,绞股蓝皂苷IX以及三七皂苷Fa、Fc和Fe。
随着三七茎叶不断深入的研究,许多微量皂苷成分也得以鉴定出来。李海舟等[21]从三七叶中分离鉴定出绞股蓝皂苷XIII、XVII和三七皂苷R1。姜彬慧等[22]从三七叶中分离得到4个微量皂苷成分化合物K、人参皂苷Rh1、人参皂苷Mc和三七皂苷Fe,且化合物K是首次从三七叶中分离得到。陈业高等[23]从三七叶中得到5个低糖链皂苷成分20(R)-人参皂苷Rh2、20(R)-人参皂苷Rg3、人参皂苷F1、人参皂苷Mc、人参皂苷Rh1和胡萝卜苷。Mao等[24]采用高效液相色谱及四级杆质谱技术,从三七叶中分离得到1种新型的抗肿瘤皂苷3-O-β-D-glucopyranoside-3β,12β,23β- triol-20-ene-dammar(Pn1),其抵抗3个肿瘤细胞株(NCI-H460、HepG2、SGC-7901)的作用远远大于人参皂苷Rg3,其结构见图 8。Li等[25]采用甲醇抽提和大孔树脂法,在得到18种已知皂苷的同时,从三七叶中分离得到3种新型具有抑制磷酸酶1B作用的皂苷,分别为三七皂苷LX、LY、FZ,结构见图 9。
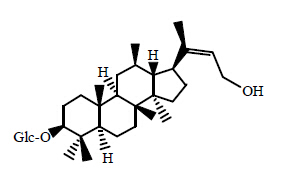 | 图 8 Pn1的结构Fig. 8 Structure of Pn1 |
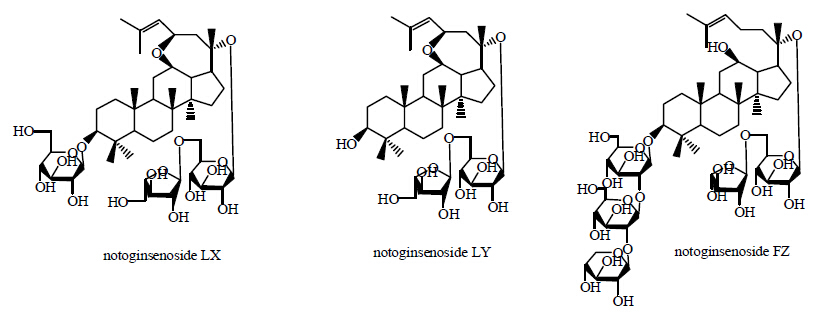 | 图 9 三七皂苷LX、LY、FZ结构Fig. 9 Structure of notoginsenoside LZ, LY, and FZ |
三七花蕾、果实及种子中同样含有一定的皂苷成分。Yoshikawa等[26]从三七花蕾中,分离得到5种新型皂苷,分别为三七皂苷O、P、Q、S、T。左国营等[27]首次分离得到三七皂苷Fe、绞股蓝皂苷IX及人参皂苷Rb3。高锐红等[28]从三七果实中分离得到人参皂苷Rb3及三七皂苷Fc。Yang等[29]从三七种子中分离得到人参皂苷Rb1、Rb3、Rc、Rd和绞股蓝皂苷IX及三七皂苷Fa、Fc,均为20(S)-原人参二醇型皂苷。
1.4 三七皂苷分类总结针对三七中皂苷成分的研究,本文在已有报道总结的基础上[30, 31],对已分离得到的皂苷成分进行更进一步的总结,按照三七中皂苷成分的母核不同,将单体皂苷分为A、B、C、D、E、F、G、H、I、J、K、L 12大类,母核结构见图 10,且按照相对应的母核不同对皂苷成分进行了分类总结,见表 1和2。
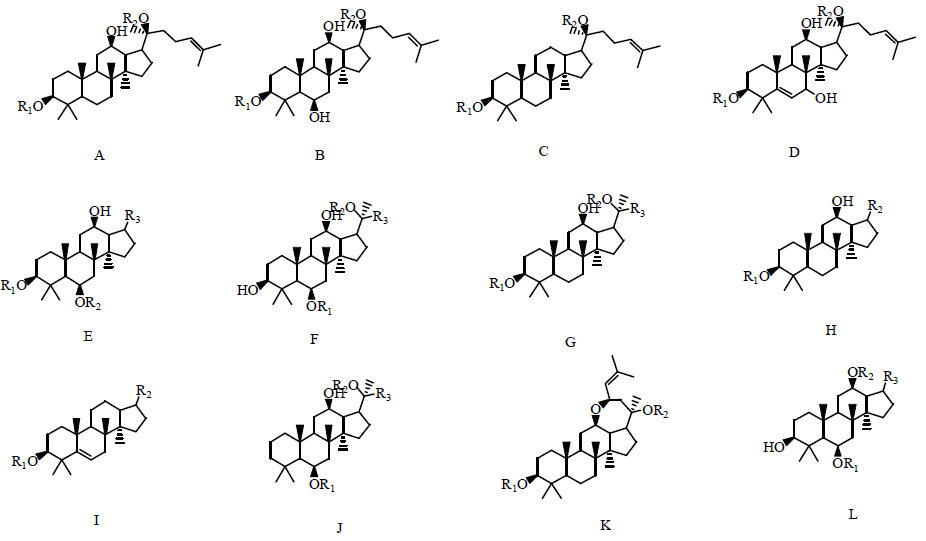 | 图 10 三七皂苷母核结构Fig. 10 Different nuclear parents of notoginsenoside |
| 表 1 三七中不同类型皂苷 (A、B、C、D、H) Table 1 Different styles of saponins in P. notoginseng (A, B, C, D, and H) |
| 表 2 三七中不同类型皂苷 (E、F、G、I、J、K、L) Table 2 Different styles of saponins in P. notoginseng (E, F, G, I, J, K, and L) |
《本草纲目新篇》记载:“三七根,止血之神药也。无论上、中、下之血,凡有外越者,一味独用亦效,加入于补气补血药中则养神”。日本学者首先从三七根中分离鉴定了三七的主要止血活性成分是一种特殊的氨基酸,即三七素。目前,对于三七素止血机制研究报道较少,张玉萍等[35]研究了三七素对小鼠凝血时间的影响(玻片法),结果表明,小鼠ip 3种不同剂量的三七素注射液能明显缩短凝血时间、凝血酶原时间和凝血酶时间。郑璐等[36]研究发现三七素对肾上腺素、ADP凝血酶和胶原所致血小板聚集均无抑制作用,从而认为三七素止血作用可能是通过促进组织胺使血管收缩引起的。王珍等[37]研究表明,三七素可能是通过综合影响大鼠的凝血系统、血小板聚集和纤溶系统,提高血浆中纤维蛋白原的量,促进血小板第I相和第II相的聚集,抑制纤维蛋白溶解、形成血栓达到止血作用的。
《中国医药大辞典》记载:“三七功用补血,去瘀损,止血衄,能通能补,功效最良,是方药中之最珍贵者”。三七能促进各类细胞分裂、生长和增殖,因而具有显著的造血功能。高瑞兰等[38]研究发现三七总皂苷(PNS)可诱导造血细胞GATA-1和GATA-2转录调粒蛋白合成增加,并提高其与上游调控区的启动子和增强子活性的表达,从而调控造血细胞增殖、分化相关基因的表达。
2.2 对心脑血管系统的作用 2.2.1 对心肌的保护作用PNS具有抗心肌缺血再灌注损伤的作用[39],心肌缺血再灌注损伤可引起心肌细胞凋亡[40]。中性粒细胞是参与心肌缺血再灌注损伤过程的重要细胞成分之一。唐旭东等[41]采用兔心肌缺血再灌注模型,观察PNS对心肌缺血再灌注时中性粒细胞内核因子-κB活性变化、细胞间黏附因子表达及中性粒细胞浸润的影响,结果显示,PNS能抑制中性粒细胞内核因子-κB的变化,减少细胞间黏附因子表达及中性粒细胞浸润,起到保护心肌作用。顾国嵘等[42]通过酶学、形态学、组织免疫化学等观察PNS预处理对缺血-再灌注心肌的延迟保护作用,结果表明,PNS预处理24 h后能明显减少缺血-再灌注导致的心肌细胞坏死和凋亡,对缺血-再灌注心肌起到保护作用。
2.2.2 抗心律失常作用PNS对多种实验性心律失常模型均有明显的对抗作用。黄胜英等[43]在研究PNS抗心律失常作用的实验中发现,PNS能明显缩短乌头碱、BaCl2和CaCl2-Ach混合液诱发大鼠心律失常的维持时间,减少室性早博,降低房颤的发生。张丽君等[44]实验显示,PNS能减轻大鼠结扎冠状动脉诱发的缺血性心律失常及再灌注性心律失常,其机制可能与减少氧化损伤和降低炎症因子释放有关。
2.2.3 保护脑组织PNS可延缓缺血期间细胞内高能磷酸化合物的分解,改善脑缺血引起的脑能量耗竭,从而增加脑组织血液的供应,改善能量代谢,有明显的脑保护作用。PNS具有钙通道阻滞作用,能阻滞颅脑损伤后神经细胞内钙超载,阻断钙调蛋白(CAM)复合物的形成,减轻脑水肿,提高血-脑脊液屏障通透性,降低脑损伤后血与脑组织中丙二醛(MDA)的量,对颅脑损伤有一定的保护作用[45]。
2.2.4 改善脑血循环三七能扩张脑血管降低脑血管阻力,增加脑血流量,PNS使麻醉家兔股动脉平均血压(BMP)和脑血管阻力(CVR)下降,也可使麻醉大鼠BMP、CVP下降,且呈剂量依赖性,但不增加脑血流量,对颈动脉亦有扩张影响[46]。
2.3 对中枢神经系统的作用 2.3.1 镇静作用三七地上部分对中枢神经有抑制作用,表现出镇静、安定和改善睡眠作用。人参皂苷Rb1有显著的镇静作用,并能协同中枢抑制药对中枢起到抑制作用,此中枢抑制作用部分是通过减少突触体谷氨酸的量实现的[47]。
2.3.2 镇痛作用三七挥发油对中枢神经系统具有镇静、抑制作用,不仅用于止痛,也有安神之效;PNS对化学性和热刺激引起的疼痛均有明显地对抗作用,且PNS是一种阿片肽样受体激动剂,不具成瘾的副作用[48]。
2.3.3 提高记忆力PNS能够改善鹅膏蕈氨酸(IBA)所致痴呆模型大鼠的学习记忆能力,其机制可能与提高海马内乙酰胆碱(Ach)的量有关[49]。孙启祥等[50]研究表明,大鼠食管给药三七活性成分后,记忆功能及脑M受体密度均有显著提高,学习、记忆指数显著提高,并可改善动物的拟痴呆症。PNS能够提高痴呆模型大鼠脑皮质内去甲肾上腺素(NE)、多巴胺(DA)和5-羟色胺(5-HT)的量,能改善痴呆模型大鼠的学习记忆能力,提高海马内Ach的量[51]。
2.4 抗炎作用PNS能明显抑制角叉菜胶(Car)、巴豆油、蛋清等多种致炎剂所致大鼠足肿胀和小鼠耳廓炎症,对摘除肾上腺鼠也有一定抗炎作用。PDS对角叉菜胶、磷酸组胺引起的大鼠踝关节肿有抑制作用,对二甲苯引起的小鼠毛细血管通透性增加有显著抑制作用。PNS对急性炎症引起的毛细血管通透性升高、炎性渗出和组织水肿以及炎症后期肉芽组织增生也均有抑制作用,其作用机制可能与PNS阻止炎性细胞内游离钙水平的升高,抑制灌流液中磷脂酶A2的活性,减少地诺前列酮的释放有关[52]。
2.5 抗肿瘤作用
PNS可通过直接杀死肿瘤细胞,抑制肿瘤细胞生长或转移,诱导肿瘤细胞调亡,诱导肿瘤细胞分化使其逆转,逆转肿瘤细胞多药耐药,增强和刺激机体免疫力功能等多种方式起到抗肿瘤作用。尚西亮等[53]采用流式细胞仪检测不同浓度PNS对细胞周期分布及细胞凋亡率的影响,结果表明,PNS能抑制SMMC-7721细胞生长、诱导细胞凋亡或坏死,且能恢复或上调细胞的缝隙连接细胞间通讯功能。
2.6 抗纤维化作用已有研究表明,三七总皂苷对四氯化碳诱发小鼠血清谷丙转氨酶(ALT)的升高有明显的抑制作用,还能抑制成纤维细胞、肝星状细胞增殖及细胞内外I型胶原的生成[54]。李佩等[55]采用纤维化小鼠模型观察三七粉对小鼠肝纤维化的影响,结果表明,三七可显著降低血清ALT、r-谷氨酰基转肽酶(r-GT)、总胆红素(TBil)、直接胆红素(DBil)水平,同时具有抗肝细胞纤维化作用。
2.7 抗衰老和抗氧化作用机体衰老是一个复杂过程,如能提高机体自身对自由基的清除能力,就能达到抗氧化、延缓衰老的作用。屈泽强等[56]研究表明,PNS可提高血清超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)、过氧化氢酶(CAT)水平,具有较强的抗自由基作用。
2.8 抗病毒作用三七总黄酮具有抗病毒作用。孙非等[57]通过柯萨奇B3病毒感染原代培养大鼠、乳鼠心肌细胞体外模型实验,发现三七总黄酮能明显抑制体外培养心肌细胞病变;对Balb/c小鼠ip柯萨奇B3型病毒感染建立病毒性心肌炎体内实验模型,发现三七总黄酮能明显提高小鼠生存率,明显降低心肌酶释放活性,小鼠干扰素水平上升,病毒滴度降低。
3 结语三七水溶性成分的主要活性成分是PNS,PNS中单体皂苷成分种类繁多,且药理活性各有不同,所以分离单体皂苷成分对三七的研究具有重大意义。固液萃取和液液萃取作为分离三七皂苷成分的主要手段,为分离单体皂苷成分做出了一定贡献。随着科技的进步,各学科不断交叉发展,各种新型的分离方法的不断涌现,许多新型皂苷成分仍不断地被发现,研究者们仍不断地致力于三七新型皂苷成分研究,这在很大程度上使得三七成分的研究进入了新的阶段。
近年来有关PNS药理作用的实验研究较多,已证实其在中枢神经系统、心脑血管系统、血液系统和免疫系统等方面有较强的生理活性。相信随着对三七成分药理作用研究的不断深入,临床应用范围会越来越广泛。
| [1] | Shi S M, Liu Y Z, Tai W, et al. Smashing tissue extraction and HPLC determination of active saponins from different parts of Panax notoginseng [J]. Chin Herb Med, 2012, 4(4): 340-344. |
| [2] | 杨秋娅, 李晓宇, 刘皋林. 人参皂苷 Rb1的药理作用研究进展 [J]. 中国药学杂志, 2013, 48(15): 1233-1237. |
| [3] | 杨 逸, 杨丽瑛, 戴景峰, 等. 人参皂苷 Rg1药理活性的研究进展 [J]. 时珍国医国药, 2012, 23(12): 3121-3123. |
| [4] | 高 洁, 张楠楠, 韩彦琪, 等. 三七抗增殖作用的有效成分筛选及机制研究 [J]. 中草药, 2014, 45(6): 801-806. |
| [5] | Luo S L, Dang L Z, Li J F, et al. Biotransformation of saponins by endophytes isolated from Panax notoginseng [J]. Chem Biodiv, 2013, 10(11): 2021-2031. |
| [6] | Yoshikawa M, Murakami T, Ueno T, et al. Bioactive saponins and glycosides. VIII. Notoginseng (1): new dammarane-type triterpene oligoglycosides, notoginseno- sides-A, -B, -C, and-D, from the dried root of Panax notoginseng (Burk.) F. H Chen [J]. Chem Pharm Bull, 1997, 45(6): 1039-1045. |
| [7] | Yoshikawa M, Murakami T, Ueno T, et al. Bioactive saponins and glycosides. IX. Notoginseng (2): structures of five new dammarane-type triterpene oligoglycosides, notoginsenosides-E, -G, -H, -I, and-J, and a novel acetylenic fatty acid glycoside, notoginsenic acid β-sophoroside, from the dried root of Panax notoginseng (Burk.) F. H Chen [J]. Chem Pharm Bull, 1997, 45(6): 1056-1062. |
| [8] | Yoshikawa M, Morikawa T, Yashiro K, et al. Bioactive saponins and glycosides. XIX. Notoginseng (3): immunological adjuvant activity of notoginsenosides and related saponins: structures of notoginsenosides-L, -M, and-N from the roots of Panax notoginseng (Burk.) F. H Chen [J]. Chem Pharm Bull, 2001, 49(11): 1452-1456. |
| [9] | 赵 平, 刘玉清. 三七根的微量成分 (1) [J]. 云南植物研究, 1993, 15(4): 409-412. |
| [10] | Zhao P, Liu Y Q, Yang C R. Minor dammarane saponins from Panax notoginseng [J]. Phytochemistry, 1996, 41(5): 1419-1422. |
| [11] | Ma W G, Mizutani M, Malterud K E, et al. Saponins from the roots of Panax notoginseng [J]. Phytochemistry, 1999, 52(6): 1133-1139. |
| [12] | 曾 江, 崔秀明, 周家明, 等. 三七根茎的化学成分研究 [J]. 中药材, 2008, 30(11): 1388-1391. |
| [13] | 宋建平, 曾 江, 崔秀明, 等. 三七根茎的化学成分研究 (II) [J]. 云南大学学报: 自然科学版, 2007, 29(3): 287-290. |
| [14] | Sakah K J, Wang T, Liu L, et al. Eight darmarane-type saponins isolated from the roots of Panax notoginseng [J]. Acta Pharm Sin B, 2013, 3(6): 381-384. |
| [15] | Zhang Y, Han L F, Sakah K J, et al. Bioactive protopanaxatriol type saponins isolated from the roots of Panax notoginseng (Burk.) F. H Chen [J]. Molecules, 2013, 18(9): 10352-10366. |
| [16] | Qi L W, Wang C Z, Yuan C S. Isolation and analysis of ginseng: advances and challenges [J]. Nat Prod Rep, 2011, 28(3): 467-495. |
| [17] | Wang J, Liu C, Li L, et al. Isolation of four high-purity dammarane saponins from extract of Panax notoginseng by centrifugal partition chromatography coupled with evaporative light scattering detection in one operation [J]. Phytochem Anal, 2011, 22(3): 263-267. |
| [18] | Zhang Y C, Liu C M, Qi Y J, et al. Application of accelerated solvent extraction coupled with counter- current chromatography to extraction and online isolation of saponins with a broad range of polarity from Panax notoginseng [J]. Sep Purif Technol, 2013, 106(14): 82-89. |
| [19] | Teng R W, Li H Z, Wang D Z, et al. Hydrolytic reaction of plant extracts to generate molecular diversity: new dammarane glycosides from the mild acid hydrolysate of root saponins of Panax notoginseng [J]. Helv Chim Acta, 2004, 87(5): 1270-1278. |
| [20] | Wang D, Liao P Y, Zhu H T, et al. The processing of Panax notoginseng and the transformation of its saponin components [J]. Food Chem, 2012, 132(4): 1808-1813. |
| [21] | 李海舟, 刘锡葵, 杨崇仁. 三七茎叶的化学成分(摘要) [J]. 药学实践杂志, 2009, 18(5): 354. |
| [22] | 姜彬慧, 王承志, 韩 颖, 等. 三七叶中微量活性皂苷的分离与鉴定 [J]. 中药材, 2004, 27(7): 489-491. |
| [23] | 陈业高, 詹尔益, 陈红芬, 等. 三七叶中低糖链皂营的分离与鉴定 [J]. 中药材, 2002, 25(3): 176-178. |
| [24] | Mao Q, Yang J, Cui X M, et al. Target separation of a new antitumor saponin and metabolic profiling of leaves of Panax notoginseng by liquid chromatography with eletrospray ionization quadrupole time-of-flight mass spectrometry [J]. J Pharm Biomed Anal, 2012, 59(5): 67-77. |
| [25] | Li D W, Cao J Q, Bi X L, et al. New dammarane-type triterpenoids from the leaves of Panax notoginseng and their protein tyrosine phosphatase 1B inhibitory activity [J]. J Ginseng Res, 2014, 38(1): 28-33. |
| [26] | Yoshikawa M, Morikawa T, Kashima Y, et al. Structures of new dammarane-type triterpene saponins from the flower buds of Panax notoginseng and hepatoprotective effects of principal ginseng saponins 1 [J]. J Nat Prod, 2003, 66(7): 922-927. |
| [27] | 左国营, 魏均娴, 杜元冲, 等. 三七花蕾皂苷成分的研究 [J]. 天然产物研究与开发, 1991, 3(4): 24-30. |
| [28] | 高锐红, 刘润民, 张建萍. 三七种籽的皂甙成分 [J]. 云南中医学院学报, 1990, 13(1): 47-48. |
| [29] | Yang T R, Kasai R, Zhou J, et al. Dammarane saponins of leaves and seeds of Panax notoginseng [J]. Phytochemistry, 1983, 22(6): 1473-1478. |
| [30] | 夏鹏国, 张顺仓, 梁宗锁, 等. 三七化学成分的研究历程和概况 [J]. 中草药, 2014, 45(17): 2564-2570. |
| [31] | 鲍建才, 刘 刚, 丛登立, 等. 三七的化学成分研究进展 [J]. 中成药, 2006, 28(2): 246-253. |
| [32] | Wang C Z, McEntee E, Wicks S, et al. Phytochemical and analytical Panax notoginseng (Burk.) F. H. Chen [J]. J Nat Med, 2006, 60(2): 97-106. |
| [33] | 魏均娴, 唐宝书, 王菊芳, 等. 三七叶中皂苷成分的研究 [J]. 华西药学杂志, 1986, 1(1): 7-10. |
| [34] | Li H Z, Teng R W, Yang C R. A novel hexanordammarane glycoside from the roots of Panax notoginseng [J]. Chin Chem Lett, 2001, 12(1): 59-62. |
| [35] | 张玉萍, 余 琼. 三七素的止血活性及其神经毒作用实验研究 [J]. 山东中医杂志, 2010, 29(1): 43-45. |
| [36] | 郑 璐, 郑 健, 刘庆荣, 等. 红参中水溶性成分三七素的生理活性研究 [J]. 中成药, 2001, 23(12): 905-906. |
| [37] | 王 珍, 杨靖亚, 宋书杰, 等. 三七素对凝血功能的影响及止血机制 [J]. 中国新药杂志, 2014, 23(3): 356-359. |
| [38] | 高瑞兰, 徐卫红, 林筱洁, 等. 三七皂苷对造血细胞GATA-1和GATA-2转录调控蛋白的诱导作用 [J]. 中华血液学杂志, 2004, 25(5): 281-284. |
| [39] | 李秀才. 抗心肌缺血再灌注损伤的中草药研究进展 [J]. 中国现代应用药学杂志, 1998, 15(4): 1-4. |
| [40] | 余丽梅, 邓永坤, 袁 芳, 等. 三七总皂苷抗心肌缺血的研究概述 [J]. 中国药师, 2011, 14(11): 1685-1687. |
| [41] | 唐旭东, 姜建青, 赁常文, 等. 三七总皂苷对心肌缺血-再灌注中中性粒细胞浸润的影响及其核转录机制的实验研究 [J]. 成都中医药大学学报, 2002, 25(3): 32-35. |
| [42] | 顾国嵘, 黄培志, 葛均波, 等. 缺血及三七总皂苷预处理对心肌缺血-再灌流损伤的保护作用 [J]. 中华急诊医学杂志, 2005, 14(4): 307-309. |
| [43] | 黄胜英, 谢世荣, 黄彩云, 等. 三七叶皂苷抗心率失常作用的实验研究 [J]. 大连大学学报, 2001, 22(6): 82-84. |
| [44] | 张丽君, 耿志辉. 三七总皂苷对大鼠心肌缺血再灌注损伤的保护作用 [J]. 吉林医学, 2007, 28(11): 1261-1262. |
| [45] | 韩金安, 苏增会, 胡戚美. 三七皂苷对颅脑损伤后出血组织丙二醛含量的影响 [J]. 药学学报, 1998, 12(4): 15-17. |
| [46] | 伍杰雄, 孙家钧. 三七总皂苷对Sprague-Dawley种系大鼠脑循环的影响 [J]. 现代应用药学, 1995, 12(1): 1-3. |
| [47] | Cicero A F, Vitale G, Savion G, et al. Panax notoginseng (Burk) effects fibrinogen and lipid plasma level in rats fed on a high-fat diet [J]. Phytother Res, 2003, 17: 174-178. |
| [48] | 马丽炎, 肖培根. 三七总皂苷对突出体谷氨酸受体特异性结合的影响 [J]. 中国药理学通报, 1998, 14(4): 311-313. |
| [49] | 郭长杰, 伍杰雄, 李若馨. 三七总皂苷对痴呆模型大鼠记忆行为的影响及其机理探讨 [J]. 中国药房, 2004, 15(10): 598-600. |
| [50] | 孙启祥, 陆 阳, 胡雅儿, 等. 三七有效成分对SD拟痴呆模型的影响 [J]. 中国临床康复, 2004, 8(28): 6152-6154. |
| [51] | 陈忠伦. 三七通舒胶囊对血管性痴呆模型大鼠学习记忆的影响 [J]. 华西药学杂志, 2010, 25(2): 159-160. |
| [52] | 杨志刚. 中药三七对神经系统和免疫系统的影响 [J]. 中国药房, 2008, 19(18): 1422-1426. |
| [53] | 尚西亮, 傅华群, 刘 佳, 等. 三七总皂苷对人肝癌细胞的抑制作用 [J]. 中国临床康复, 2006, 10(23): 121-123. |
| [54] | 熊磊, 刘平, 谭英姿, 等. 三七总苷对肝星状细胞增值及胶原生成的影响 [J]. 中西医结合肝病杂志, 1999, 9(3): 19-21. |
| [55] | 李 佩, 向芙蓉, 潘慧敏, 等. 三七粉对肝纤维化干预作用的实验研究 [J]. 右江民族医学院学报, 2009, (5): 779-781. |
| [56] | 屈泽强, 谢智光, 王乃平, 等. 三七总皂苷抗衰老作用的实验研究 [J]. 广州中医药大学学报, 2005, 22(2): 130-132. |
| [57] | 孙 非, 衣同辉, 梁重阳, 等. 三七总黄酮对病毒性心肌炎模型治疗作用的药效学研究 [J]. 中国药理学通报, 2006, 22(4): 476-478. |
 2015, Vol. 46
2015, Vol. 46