2. 甘肃省中医院, 甘肃 兰州 730050
2. Gansu Province Hospital of Ttraditional Chinese Medicine, Lanzhou 730050, China
秦皮总香豆素是秦皮药材Fraxini Cortex中的主要活性物质[1]。现代药理研究表明,秦皮总香豆素对急性痛风性关节炎大鼠、家兔具有抗炎作用,对正常小鼠血尿酸以及ip黄嘌呤造成的高尿酸小鼠血尿酸有显著降低作用[2, 3]。临床研究表明,秦皮总香豆素对原发性急性痛风性关节炎具有一定止痛效应[4]。对秦皮总香豆素的活性研究不断有新的发现,所以对秦皮总香豆素的制备纯化工艺研究具有应用价值。
目前,未见对秦皮总香豆素纯化工艺研究的文献报道,专利由于技术的保密性限制,其报道缺少纯化参数优化和明确的纯化工艺[5]。本课题组在以往研究基础上,通过对秦皮总香豆素和4种香豆素成分的吸附率、解吸率、转移率考察,优选秦皮总香豆素纯化工艺参数,为进一步开发秦皮奠定基础。
1 仪器与材料Agilent 1100高效液相色谱仪,G1311A四元泵,G1313A自动进样器,G1316A柱温箱,G1315B DAD检测器,HP化学工作站;色谱柱为Agilent Zorbax SB C18(250 mm×4.6 mm,5 μm),Agilent 8453紫外-可见分光光度计,美国安捷伦公司;CP2202S电子天平,瑞士梅特勒-托利多;SPS202F电子天平,奥豪斯公司;YZN50液体真空浓缩煎药机,北京东华原医疗设备有限责任公司;CX-250超声波清洗机,天海双龙医疗设备有限公司;ZK-82B型真空干燥箱,上海市实验仪器总厂;UWA-K-030电子秤,厦门联贸电子有限公司;3520 pH Meter酸度计,英国Jenway公司。
秦皮饮片购于北京市本草方源药业有限公司,产地河北,经中国中医科学院中药所胡世林研究员鉴定为木犀科植物苦枥白蜡树Fraxinus rhynchophylla Hance的干燥枝皮,秦皮饮片含秦皮甲素3.49%、秦皮乙素0.04%,合计为3.53%,符合《中国药典》2010年版的规定,另外含有秦皮苷1.61%,秦皮素0.09%。大孔吸附树脂ADS-5、AB-8(非极性),ADS-17(中极性),ADS-21、NKA-9(极性),S-8、ADS-7(强极性),均为天津南开和成科技有限公司。秦皮甲素、秦皮乙素对照品(批号110740-200104、110741-200506)购自中国食品药品检定研究院,供定量测定用,质量分数均>98%;秦皮苷、秦皮素(自制,HPLC测定质量分数均>98%)[6, 7];乙腈为色谱纯(Fisher公司),其他试剂为分析纯,水为纯净水。
2 方法与结果 2.1 秦皮总香豆素定量测定[8] 2.1.1 对照品溶液制备精密称定秦皮甲素对照品加甲醇溶解制成288 μg/mL的溶液,即得。
2.1.2 供试品溶液的配制取秦皮总香豆素乙醇提取物(秦皮饮片加8倍量75%乙醇,回流提取2次,每次回流2 h[9])10 mg,精密称定,置锥形瓶中,精密加甲醇10 mL,密塞,称定质量,超声处理(功率250 W,频率200 Hz)30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过。精密量取续滤液1.0 mL,置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得。
2.1.3 线性关系考察精密吸取“2.1.1”项下秦皮甲素对照品溶液0.20、0.35、0.50、0.65、0.80 mL,分别置于10 mL量瓶中,加甲醇稀释至刻度,摇匀。以甲醇为空白,照《中国药典》2010年版一部分光光度法,在334 nm的波长处测定吸光度(A)值,结果分别为0.211、0.365、0.531、0.686、0.857。以秦皮甲素质量浓度为横坐标(X),A值为纵坐标(Y),绘制标准曲线,其回归方程为Y=0.037 3 X-0.007 7,r=0.999 9,结果表明秦皮甲素在5.76~23.04 μg/mL与A值有良好的线性关系。
2.2 秦皮甲素、秦皮乙素、秦皮苷、秦皮素的定量测定[8] 2.2.1 色谱条件色谱柱为Agilent Zorbax SB-C18柱(250 mm×4.6 mm,5 μm),流动相为乙腈-0.01%磷酸水溶液:0~21 min,8%~15%乙腈;21.0~21.1 min,15%~80%乙腈;21.1~25.0 min,80%乙腈;柱温25 ℃,体积流量1.0 mL/min,检测波长334 nm,进样量10 μL。
2.2.2 对照品溶液的制备取秦皮甲素、秦皮苷、秦皮乙素、秦皮素对照品,精密称定,分别置于10 mL量瓶中,以甲醇溶解,定容,得质量浓度分别为550.0、539.0、60.0、56.2 μg/mL的对照品溶液,过微孔滤膜(0.45 μm),取续滤液,备用。
2.2.3 供试品溶液的制备取秦皮总香豆素提取物适量,粉碎,过80目筛,精密称取10 mg置50 mL锥形瓶中,精密加甲醇10 mL,密塞,称定质量,超声40 min(功率250 W,频率200 Hz),取出,放冷,甲醇补足减失的质量,摇匀,滤过,取续滤液作为供试品溶液。
2.2.4 线性关系考察精密吸取秦皮甲素对照品溶液(550.0 μg/mL)0.1、0.5、1.5、3.0、5.0、7.0 μL,秦皮苷对照品溶液(539.0 μg/mL)0.1、0.5、1.5、3.0、5.0、7.0 μL,秦皮乙素对照品溶液(60.0 μg/mL)1.0、3.0、5.0、7.0、9.0、11.0 μL,秦皮素对照品溶液(56.2 μg/mL)1.0、3.0、5.0、7.0、9.0、11.0 μL,按上述色谱条件测定峰面积。以峰面积为纵坐标(Y),进样量为横坐标(X)绘制标准曲线,计算回归方程为秦皮甲素Y=2 111.7 X+71.454,r=0.999 7;秦皮苷Y=1 563.5 X-4.734 2,r=0.999 8;秦皮乙素Y=3 313 X+7.608,r=0.999 9;秦皮素Y=3 122.7 X+13.715,r=0.999 9;表明秦皮甲素在55.0~3 850.0 ng、秦皮苷在53.9~3 773.0 ng、秦皮乙素在60.0~660.0 ng、秦皮素在56.2~618.2 ng与峰面积呈良好的线性关系。
2.3 秦皮上柱药液的提取取秦皮饮片适量,按已优选醇提取工艺[9](加8倍量75%乙醇,回流提取2次,每次回流2 h)提取药材,提取液回收乙醇至无醇味,加水适量,使药液质量浓度达生药0.75 g/mL,放置过夜,离心,上清液计量体积和质量,备用。纯化参数筛选时,分别按“2.1”和“2.2”项下紫外分光光度法和液相色谱法测定样品的质量浓度,计算上样药液、水清洗液、醇洗脱液中总香豆素和4种香豆素成分的量。
2.4 秦皮提取液上大孔树脂前质量浓度的筛选取秦皮饮片400.0 g,按优选的醇提工艺提取[9],药液减压回收乙醇,得无醇味稠液,均分4份,加水,使药液质量浓度分别为生药2、1、0.75、0.5 g/mL,样品冷藏过夜,离心,上清液减压回收乙醇,减压干燥(65 ℃),称定质量,计算出膏率,测总香豆素的量,计算总香豆素提取率,实验结果见表 1。结果表明,秦皮提取液过大孔树脂前,浓缩质量浓度对样品出膏率、总香豆素的量、提取率均可产生影响,以总香豆素提取率为指标,秦皮提取液上大孔树脂前浓缩质量浓度为生药0.75 g/mL较为合适。
| 表 1 秦皮提取液上大孔树脂前质量浓度的筛选结果 Table 1 Extract from Fraxini Cortex with different concentration |
根据香豆素的结构特点和不同大孔吸附树脂的吸附特性,选择不同极性7种型号的大孔吸附树脂(ADS-5、AB-8、ADS-17、ADS-21、NKA-9、S-8、ADS-7),按说明书方法处理,各取100.00 g,备用,树脂柱规格3 cm×40 cm,柱体积(V0)150 cm3(以下实验相同)。
取“2.3”项下秦皮提取液适量(质量浓度C0、体积V0),均以2 BV/h体积流量过7种大孔吸附树脂柱,收集流出液,并用适量去离子水洗涤树脂柱至水洗液呈无色,水洗液与流出液合并,计量体积(V1),测定其总香豆素质量浓度(C1);再用适量95%乙醇以相同的体积流量(2 BV/h)进行洗脱至洗脱液无色,计量洗脱液体积(V2),测定洗脱液总香豆素的质量浓度(C2),按公式计算吸附率、解吸率,上柱后总香豆素转移率,以评价各树脂吸附和解吸附效果,实验结果见表 2。结果表明,ADS-5大孔树脂对秦皮总香豆素的吸附率、解吸率、转移率最高,相对于其他树脂,ADS-5既较好地吸附样品,又将有效成分解吸下来,所以确定纯化树脂选用ADS-5。
| 表 2 不同大孔树脂动态筛选结果 Table 2 Purification of coumarin from Fraxini Cortex by different macroporous resins |
吸附率=(C0V0-C1V1)/C0V0
解吸率=C2V2/(C0V0-C1V1)
转移率=C2V2/C0V0
2.6 秦皮总香豆素提取物纯化参数的优化 2.6.1 吸附容量考察称取处理合格的ADS-5大孔树脂50.00 g装于玻璃柱中,取秦皮提取液过柱(体积流量2 BV/h)至药液穿透,分段收集流出液,每份4 mL,检测其A值,计算总香豆素质量浓度(C)。以单位质量树脂吸附的生药量为横坐标,流出液与原药液中总香豆素质量浓度之比(C/C0)为纵坐标,绘制吸附曲线,见图 1。实验结果表明,当上样量达到0.45 g/g时,开始检测到香豆素类成分,当上样量达1.26 g/g时,上样流出液C与原液C0之比为0.09,文献报道[10]当C/C0=0.1时,认为达到穿透点,开始泄漏,上样量应小于泄露点,即小于1.26 g/g。预试验发现,按1.20 g/g上样,水清洗2 BV,样品转移率仅为31.48%,发现水清洗时同时会损失一部分香豆素,上样量、水洗体积对香豆素的转移率影响很大,所以选择4个上样比例,进一步对上样量进行考察。
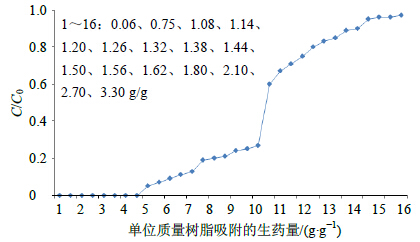 |
图 1 秦皮总香豆素提取液吸附曲线 Fig.1 Adsorption curve of total coumarin extracted from Fraxini Cortex |
称取处理合格的ADS-5大孔树脂(100.00 g/份)4份装柱,上样量按0.45、0.60、0.80、1.00 g/g上样,上样体积流量均为2 BV/h,收集流出液,计量体积;用去离子水清洗杂质,分段接收0.5、1、1.5、2 BV,测各样品总香豆素的量,计算吸附率,结果见表 3。结果表明,上样量愈大,水清洗杂质时损失的香豆素越多。上样量为1.00 g/g香豆素损失过大;上样量为0.45 g/g或0.60 g/g树脂利用率太低;上样量为0.8 g/g,水清洗杂质为0.5~1 BV时,总香豆素吸附率可达74.47%~86.73%,所以上样量定为生药量-树脂0.8 g/g。
| 表 3 不同上样量及清洗杂质不同体积对总香豆素吸附率的影响 Table 3 Effect of different loading quantities and impurifying volumn on adsorption rate of coumarin |
称取处理合格的ADS-5大孔树脂100.00 g装柱,按确定的吸附容量上样,上样体积流量2 BV/h,收集流出液,去离子水清洗0.5 BV,然后依次用5%、10%、20%、30%、40%、50%、95%乙醇洗脱1~2 BV(各洗脱液颜色变浅即可),分段收集,计量体积,各样品采用液相色谱法、紫外分光光度法进行定量测定,计算吸附率、解吸率、转移率,绘制洗脱曲线,结果见图 2、图 3。结果表明,水清洗0.5 BV时,样品中总香豆素的质量分数仅为1.23%,4种香豆素成分质量分数总和为0.79%(图 3),说明除掉的是大量的杂质。5%乙醇1 BV洗脱样品中总香豆素的质量分数仅为12.09%,说明其含杂质较多,应该加大水洗体积,以减少醇洗中样品的杂质量。10%乙醇1~2 BV、20%乙醇1~2.5 BV洗脱样品中总香豆素的质量分数在66.33%~77.99%(图 3),4种香豆素成分累计转移率为99.12%(图 2),说明4种香豆素成分基本上全部被洗脱下来;当洗脱剂为30%乙醇时,各样品中总香豆素的质量分数开始下降,并由49.92%降至33.08%(图 3),低于50%,不符合5类新药的定量要求,所以洗脱剂乙醇的体积分数应小于30%;考虑到用20%乙醇洗脱时洗脱体积较大,所以确定脱剂为25%乙醇。
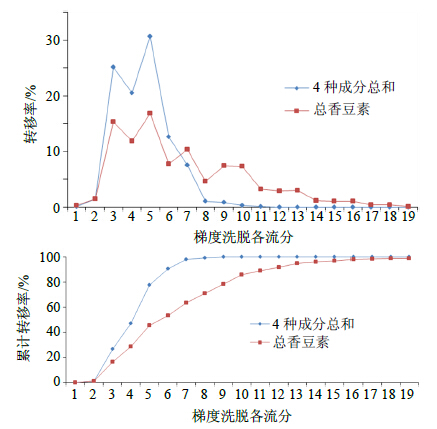 |
1-流出液 2-水0.5 BV 3-5%乙醇1 BV 4-10%乙醇1 BV 5-10%乙醇2 BV 6-20%乙醇1 BV 7-20%乙醇2 BV 8-20%乙醇2.5 BV 9-30%乙醇1 BV 10-30%乙醇2 BV 11-30%乙醇3 BV 12-40%乙醇1 BV 13-40%乙醇2 BV 14-40%乙醇3 BV 15-50%乙醇1 BV 16-50%乙醇2 BV 17-50%乙醇3 BV 18-95%乙醇1 BV 19-95%乙醇2 BV,图 3同 1-effluent 2-0.5 BV water 3-1 BV 5% ethanol 4-1 BV 10% ethanol 5-2 BV 10% ethanol 6-1 BV 20% ethanol 7-2 BV 20% ethanol 8-2.5 BV 20% ethanol 9-1 BV 30% ethanol 10-2 BV 30% ethanol 11-3 BV 30% ethanol 12-1 BV 40% ethanol 13-2 BV 40% ethanol 14-3 BV 40% ethanol 15-1 BV 50% ethanol 16-2 BV 50% ethanol 17-3 BV 50% ethanol 18-1 BV 95% ethanol 19-2 BV 95% ethanol, same as Fig. 3 图 2 水和不同体积分数乙醇梯度洗脱曲线 Fig.2 Eluting curves of gradient elution |
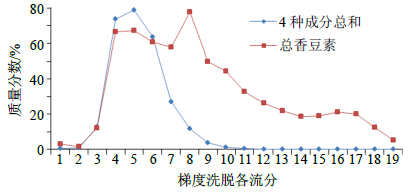 |
图 3 各洗脱样品中4种成分及总香豆素质量分数 Fig.3 Curves of total coumarin percentage content in four components ofelution |
称取处理合格的ADS-5大孔吸附树脂100.00 g装柱,按确定的吸附容量上样,上样体积流量2 BV/h,收集流出液;用去离子水清洗0.5、0.75、1、1.5、2 BV,至颜色变浅,然后用25%乙醇洗脱,分段接收,最后50%乙醇洗脱至近无颜色,计量体积;各洗脱处理方式分别为1#:上样流出液0.65 BV,2#:水洗1-0.5 BV,3#:水洗2-0.25 BV,4#:水洗3-0.25 BV,5#:水洗4-0.25 BV,6#:水洗5-0.75 BV,7#:25%乙醇1-0.5 BV,8#:25%乙醇2-0.5 BV,9#:25%乙醇3-0.5 BV,10#:25%乙醇4-1.5 BV,11#:25%乙醇5-1 BV,12#:25%乙醇6-1 BV,13#:25%乙醇7-1 BV,14#:25%乙醇8-0.5 BV,15#:50%乙醇1-2 BV,16#:50%乙醇2-2 BV,编号为1~16。各样品采用液相色谱法、紫外分光光度法进行定量测定,减压干燥,计算吸附率、解吸率、转移率以及样品的质量分数和收率。结果见表 4和图 4。
| 表 4 水清洗杂质1 BV和25%乙醇洗脱样品3 BV的纯化结果 Table 4 Purification parameters of impurities 1BV with water and elution 3 BV with 25% ethanol |
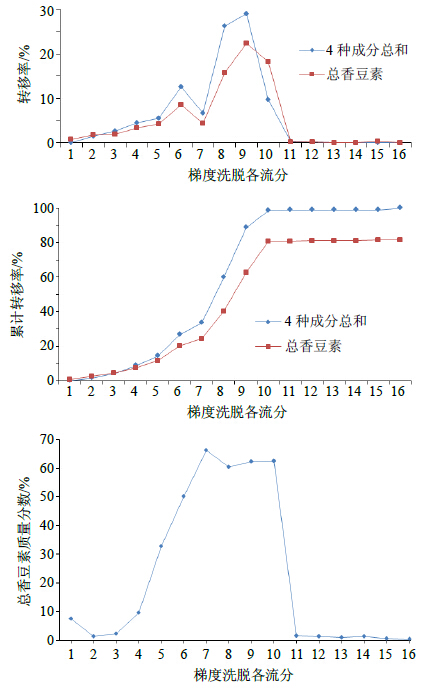 |
图 4 清洗杂质体积和样品洗脱体积筛选曲线 Fig.4 Transfer rates of volume of cleaning impurity and different eluent |
实验结果表明,水清洗杂质0.5、0.75、1 BV各样品中总香豆素占提取物质量分数分别为1.34%、2.36%、9.52%,如果水清洗体积为0.75 BV时,25%乙醇洗脱3 BV,得到样品中的总香豆素质量分数为47.22%,没有达到5类新药定量要求;如果水清洗体积为1 BV时,25%乙醇洗脱3 BV,得到样品中的香豆素质量分数为57.53%,符合5类新药定量要求;若继续水洗,下一份水洗样品中总香豆素质量分数是32.66%,由于香豆素损失较多,不宜再继续水洗。所以确定水清洗杂质体积为1 BV。
25%乙醇洗脱的各样品(7#~10#)中总香豆素质量分数均大于60%。当洗脱至第3 BV(10#)时,该样品中总香豆素质量分数为62.40%(图 4),经计算总香豆素质量分数累计占提取物的57.53%,符合5类新药的定量要求,此时4种香豆素成分质量分数之和为41.86%;当洗脱至第4 BV(11#)时,该样品中总香豆素质量分数仅为1.55%(图 4),说明香豆素成分很少,可以不再洗脱。故确定25%乙醇洗脱3 BV。
2.6.4 上柱药液质量浓度的考察称取处理合格的ADS-5大孔吸附树脂4份各100.00 g,装柱,取秦皮提取液,1份保持原药液浓度(生药0.75 g/mL),其他3份调质量浓度分别为生药1.55、1.15、0.75、0.35 g/mL,按确定的吸附容量上样,上样体积流量2 BV/h,收集上样流出液,水清洗1 BV(体积流量为2 BV/h),收集水洗液与上样液合并,计量体积;再用25%乙醇洗脱,洗脱体积流量为2 BV/h,洗脱3 BV,计量体积。各样品进行定量测定,计算吸附率、解吸率、转移率,实验结果见表 5。结果表明,不同质量浓度上样液4种香豆素成分总和的吸附率相差无几,但随着上样质量浓度的减小,解吸率、转移率逐渐上升并趋于平缓,生药0.75 g/mL样品的转移率略高于生药0.35 g/mL的样品;总香豆素成分吸附率、解吸率、转移率的变化趋势与4种香豆素成分总和变化趋势相同。定量测定结果显示,上样质量浓度为生药0.75 g/mL时,转移率最佳,故确定上样质量浓度为生药0.75 g/mL。
| 表 5 上柱药液质量浓度对总香豆素、4种香豆素成分总和纯化的影响 Table 5 Effect of loading solution with different concentration on purification parameters of total coumarin and total of four kinds of components |
称取处理合格的ADS-5大孔吸附树脂3份各100.00 g,装柱,取秦皮提取液,1份保持原药液的pH 4.0,另外2份用5% NaOH、稀HCl调节pH值分别为7.0和2.0,按确定的吸附容量上样,上样体积流量2 BV/h,收集流出液,水清洗1 BV(体积流量为2 BV/h),收集水洗液与上样液合并,计量体积;再用25%乙醇洗脱,洗脱速度为2 BV/h,洗脱3 BV,计量体积。各样品进行定量测定,计算吸附率、解吸率、转移率,结果见表 6。结果表明,随着上柱药液pH值降低,总香豆素和4种香豆素成分转移率逐渐升高并趋于平稳,pH 2.0药液转移率略高于pH 4.0的原液。考虑生产实际情况,如果调节药液pH值为2.0,增加一道工序和成本,且对产品的质量、收率影响不大,而且偏酸性药液对生产产生其他影响,所以确定上柱药液保持原液pH值。药液pH值会受温度等因素影响,经多次测量,原药液pH值在4.0~4.3。
| 表 6 上柱药液pH值对总香豆素、4种香豆素成分总和纯化的影响 Table 6 Effect of loading solution with different pH values on purification parameters of total coumarin and total of four kinds of components |
称取处理合格的ADS-5大孔吸附树脂3份各100.00 g,装柱,取秦皮提取液,按确定的吸附容量上样,上样体积流量分别为6、4、2 BV/h,收集上样流出液,水清洗(体积流量为2 BV/h)1 BV与上样液合并,计量体积;再用25%乙醇洗脱,洗脱体积流量为2 BV/h,洗脱3 BV,计量体积。各样品进行定量测定,计算吸附率、解吸率、转移率,结果见表 7。结果表明,上样速度对吸附率、解吸率、转移率影响不大。总香豆素转移率显示,上样体积流量为2 BV/h略优于4、6 BV/h;4种香豆素转移率之和显示,上柱体积流量为2、4 BV/h,其值几乎相同,略高于6 BV/h,从生产实际考虑,上样体积流量可以控制在2~4 BV/h。
| 表 7 药液上柱体积流量对总香豆素、4种香豆素成分总和纯化的影响 Table 7 Effect of loading solution with different flow rate of macroporous resin column on purification parameters of total coumarin and total of four kinds of components |
称取处理合格的ADS-5大孔吸附树脂3份各100.00 g,装柱,取秦皮提取液,按确定的吸附容量上样,上样体积流量均为2 BV/h,收集上样流出液,水清洗(体积流量为2 BV/h)1 BV与上样液合并,计量体积;再用25%乙醇洗脱,洗脱体积流量分别为2、4、6 BV/h,洗脱3 BV,计量体积。各样品进行定量测定,计算吸附率、解吸率、转移率,结果见表 8。
| 表 8 样品洗脱体积流量对总香豆素、4种香豆素成分总和纯化的影响 Table 8 Effect of of different eluent flow rates of macroporous resin column on purification parameters of total coumarin |
结果表明,总香豆素、4种香豆素成分之和转移率均显示,洗脱体积流量为2 BV/h时,优于4、6 BV/h,所以样品洗脱体积流量定为2 BV/h。
最终确定秦皮总香豆素纯化工艺:采用ADS-5大孔吸附树脂,上样量为生药-树脂0.8 g/g,上样液质量浓度为生药0.75 g/mL,以原液上样(pH 4.0~4.3),上柱体积流量为2~4 BV/h;上样后,水清洗杂质1 BV,洗脱溶剂为25%乙醇,洗脱体积流量为2 BV/h,洗脱体积为3 BV。
2.7 秦皮总香豆素提取物纯化工艺验证试验取3份秦皮药材各800.0 g,按优选的提取工艺[9](加药材8倍量75%乙醇,回流2次,每次回流2 h)提取,回收乙醇至无醇味,浓缩至密度1.064 g/mL(20 ℃)时,加水适量,使药液质量浓度为生药0.75 g/mL,冷藏过夜,离心,上清液备用。
取处理合格的ADS-5大孔树脂装3根树脂柱(规格80 cm×6 cm),每根柱载树脂量为1.0 kg,水冲洗柱体积平稳后,将提取药液按上述优选工艺进行纯化,纯化样品回收乙醇,减压干燥,得干膏,进行定量测定,计算样品纯化工艺参数。实验结果见表 9。
| 表 9 3批验证试验各指标参数结果 Table 9 Each process parameter results of three batches of verification |
工艺验证时的投料量比工艺参数筛选时放大了10倍。验证试验结果表明,3次验证试验的转移率相近,各批次提取指标、定量指标接近,纯化参数比较平稳,说明该工艺稳定,质量可控,纯化后提取物中总香豆素质量分数大于50%,符合5类新药的申报要求。
3 讨论本研究选择非极性(ADS-5、AB-8)、中极性(ADS-17)、极性(ADS-21)、强极性(S-8、ADS-7)大孔树脂筛选适于秦皮香豆素纯化的型号,结果显示,ADS-5、AB-8、S-8对秦皮香豆素的吸附、解吸性能良好,而聚苯乙烯型非极性吸附树脂更适合于纯化秦皮香豆素。在筛选时发现,兼具表面吸附和氢键吸附双重作用的ADS-17,对秦皮香豆素的吸附率(37.45%)较低,而解吸率(91.71%)很高;具有吸附酚类物质特性的ADS-21,并没有显示出对香豆素吸附的优势,吸附率仅为49.87%。因为每种中药所含成分不同,多方面因素都会影响树脂对药液的纯化效果,所以在筛选树脂类型时,尽可能考虑各种类型的树脂[10, 11]。
在采用大孔树脂纯化样品时,杂质去除通常有2种途径:一是采用水清洗树脂柱除去部分杂质,一是采用适宜体积分数的乙醇洗脱样品后,让部分杂质留在树脂柱上,这样使样品得以纯化。从本实验可以看出,水清洗杂质体积和上样量共同影响样品纯化效果。不能仅从上样流出液占原药液的10%[12]来决定水清洗杂质体积。由于有些有效成分在树脂柱上吸附的不够牢固,水清洗杂质时,一部分有效成分将会被冲洗下来,造成一定量有效成分的损失。如果是同样的上样量,水清洗杂质的体积越多,有效成分吸附率越低;如果是同样的清洗体积,上样量越大,有效成分吸附率越低。所以要选择合适的上样量,同时控制好水清洗杂质的体积,保证最大限度地去除杂质,而又使有效成分丢失最少。本实验中如果选择0.45 g/g的上样量,树脂的利用率太低,势必增加生产成本;如果选择1.00 g/g的上样量,则不利于有效成分的吸附,造成有效成分的大量损失。故有些中药的纯化,在完成吸附曲线实验后,在渗漏点[12]附近,有必要进一步筛选合适的吸附比例,以满足被纯化样品的纯度需求。
本研究在不同树脂筛选时,各型号树脂上样量均控制在最低量,所以ADS-5在筛选时的吸附率(98.38%)高于工艺筛选时的吸附率(92.46%),其原因就在于上样量的不同。
从实验结果可知,对于香豆素类偏酸性成分,在筛选上柱药液pH值时,因为香豆素的α-吡喃酮环具有α、β不饱和内酯,在碱液中易水解,香豆素开环,生成顺邻羟桂皮酸盐,使游离的香豆素减少,筛选上柱药液pH值时,设计中性和偏酸性pH值参数即可,不必考察碱性pH值的数值。本实验结果也证实了这一点,在偏碱性条件下(pH 9.5),样品的吸附率(34.61%)、解吸率(58.39%)、转移率(20.21%)3个指标与酸性药液的指标相比大大降低,故本实验中只考虑了酸性至中性药液pH值对吸附的影响。
| [1] | 陈 琳, 刘丽梅, 王瑞海, 等. HPLC测定不同品种秦皮药材中香豆素类成分[J]. 中国中药杂志, 2008, 33(23): 2858. |
| [2] | 曹世霞, 祝 捷, 张三印, 等. 秦皮总香豆素对急性痛风性关节炎大鼠模型IL-1β、IL-8、TNF-α的影响[J]. 四川中医, 2011, 29(3): 68-70. |
| [3] | 赵军宁, 邓治文, 戴 瑛. 秦皮总香豆素对实验性痛风性关节炎及尿酸代谢的影响[J]. 中国药学杂志, 2009, 44(10): 751-753. |
| [4] | 罗 玫, 刘 芳, 邹建东, 等. 秦皮总香豆素对原发性急性痛风性关节炎止痛效应的探索性临床试验[J]. 中国临床药理学与治疗学, 2005, 10(4): 475-478. |
| [5] | 杨东安, 赵军宁. 秦皮总香豆素的制备方法及其在制药中的应用: 中国, 1398861A[P]. 2003-02-26. |
| [6] | 刘丽梅, 陈 琳, 王瑞海, 等. 秦皮化学成分的研究[J]. 中草药, 2001, 32(12): 1073-1074. |
| [7] | 刘丽梅, 王瑞海, 陈 琳, 等. 秦皮化学成分的研究[J]. 中草药, 2003, 34(10): 889-890. |
| [8] | 叶 迎, 柏 冬, 包 强, 等. 秦皮提取物UV、HPLC含量测定方法研究[J]. 中国中医药信息杂志, 2015, 22(8): 83-87. |
| [9] | 王瑞海, 柏 冬, 刘寨华, 等. 秦皮总香豆素不同提取工艺的对比研究[J]. 中国中医药信息杂志, 2015, 22(10): 86-90. |
| [10] | 周秋月, 李 琪, 李慧敏, 等. 大孔树脂分离复方黑骨藤药物有效成分工艺的研究[J]. 中草药, 2014, 45(21): 3098-3104. |
| [11] | 李 晨, 狄留庆, 赵晓莉, 等. 大孔吸附树脂分离纯化消癥丸提取液工艺研究[J]. 中草药, 2014, 45(22): 3266-3270. |
| [12] | 董江涛, 李 燕, 徐慧强, 等. HPD-722大孔树脂纯化葎草总黄酮的工艺研究[J]. 辽宁农业科学, 2010(3): 11-15. |
 2015, Vol. 46
2015, Vol. 46


