绞股蓝Gynostemma pentaphyllun (Thunb.) Makino是隶属于葫芦科(Cucurbitaceae)绞股蓝属Gynostemma Bl. 的多年生草质藤本药用植物,可通过种子繁殖,也可进行克隆生长,为典型的热带亚洲分布类型,生于海拔300~3 200 m的山谷密林、灌丛中或溪水河岸边。其自然地理分布区主要位于中国、印度、马来西亚和日本等国家[1]。我国绞股蓝植物资源非常丰富,主要分布在长江流域及其南部地区,云南的西南部是绞股蓝的现代分布中心和多样化中心[2]。
绞股蓝在古时民间已被广泛使用,把其作为神奇的“不老长寿药草”。国内外研究表明,绞股蓝含有达玛烷型皂苷、小分子多糖、维生素、游离氨基酸、微量元素以及黄酮类等生物活性物质,具有抑制肿瘤细胞繁殖、抗疲劳、调节脂质代谢、抗老年性痴呆等药理作用,被誉为“南方人参”,引起人们的广泛兴趣和重视[3, 4]。1986年,国家科委在“星火计划”中,把绞股蓝列为待开发的“名贵中药材”之首位。然而目前,作为我国重要的传统药用资源植物,由于大量的人为采挖和利用,致使绞股蓝野生自然资源逐渐变的稀少,居群大量呈现片段化分布状态。绞股蓝已被列为《中国重点保护植物名录》II级保护,因此,广泛而深入地开展绞股蓝植物资源的考察、收集并对其遗传多样性和居群遗传结构进行研究,从而制定相应的保护策略就显得十分必要和迫切[5]。
近年来,运用包括SSR分子标记技术在内的分子生物学方法,探讨濒危植物及药用植物的遗传多样性已经得到广泛应用[6, 7]。李忠虎等[8]用SSR分子标记技术,对党参的野外居群进行遗传多样性分析,结果显示,党参居群具有较丰富的遗传多样性水平,从DNA 水平上验证了党参居群丰富的遗传变异能力,说明党参具有较强的环境适应能力,为后续党参属植物资源的保护、利用和评价奠定了良好基础。此外,SSR技术还被广泛应用于丹参、天麻、人参、番红花、柴胡等药用植物的遗传多样性研究[9, 10, 11, 12, 13, 14]。
本实验利用SSR分子标记对绞股蓝自然居群的遗传多样性与群体结构进行研究,目的在于了解该物种自然居群的遗传背景,确立该物种的有效保护单元,为进一步保护和合理利用绞股蓝植物资源提供切实可行的保护策略和科学依据。
1 材料
野外采集新鲜完整的绞股蓝,经西北大学生命科学学院赵桂仿教授鉴定为绞股蓝Gynostemma pentaphyllun (Thunb.) Makino Bot. Mag. (Tokyo) 幼嫩叶片,置于硅胶干燥剂中吸水干燥后,带回实验室置于常温保存。共采集绞股蓝28个自然居群426份个体样本,每个居群采集3~23份个体。不同的个体之间间隔10~15 m的距离。采集样本的详细信息见表 1。
| 表 1 28个绞股蓝居群样本信息表 Table 1Geographic information of 28 population sites of G. pentaphyllun |
2.1 DNA提取和SSR分析
2.1.1 DNA提取
从每份样本中取30 mg干叶,放入1.5 mL离心管中,用组织破碎仪粉碎后,用植物基因组DNA提取试剂盒(北京天根生化科技有限公司)提取DNA。
2.1.2 PCR 扩增及检测从14对SSR引物[15]中筛选出6对多态性丰富、条带清晰且扩增效果稳定的引物用于后续实验分析(表 2)。10 μL反应体系包括2×Taq PCR Mix 5 μL(含TaqDNA聚合酶、dNTPs、MgCl2、反应缓冲剂等),10 μmol/L引物F 0.5 μL,10 μmol/L引物R 0.5 μL,20 ng/μL模板DNA 1.0 μL,ddH2O 3 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,退火复性30 s(各引物退火温度由梯度PCR确定),7 2 ℃延伸50 s,35个循环;72 ℃延伸7 min。PCR扩增产物用10%聚丙烯酰胺凝胶电泳检测,采用银染技术显带。
| 表 2 筛选出的6对引物信息表 Table 2Information of six primers in G. pentaphyllum |
选择清晰、可重复的条带进行统计,用Quantity One软件进行条带相对分子质量读取,记录结果。应用Popgene软件计算各居群的扩增多态性位点比率(PPL)、平均等位基因数(Na)、平均有效等位基因数(Ne)、居群特有等位基因数(Np)、居群的期望杂合度(He)和观测杂合度(Ho)、Shannon信息指数(I)、群体之间的Nei’s遗传距离和遗传一致度。
利用Arlequin v3.ll软件进行分子变异(AMOVA)分析和F统计(FST),并计算居群之间的基因流(Nm)。同时在GenALEx6.5软件中进行不同居群之间的地理距离以及主成分分析(PCA),用IBD在线软件进行Mental检验。
利用MEGAv6.0软件构建NJ聚类树,分析各居群之间的遗传关系。利用Structure v2.3软件计算居群的遗传结构,随机运行10次(K值设置为1~8)。结果选用2个确定最适K值的标准对合适的居群遗传结构进行评价,取值最大且前后变化平缓的lnP(D) 值以及最大的ΔK值,确定聚类分组。
3 结果与分析3.1 遗传多样性和遗传分化
将28个绞股蓝自然居群按其倍性划分为4组,进行遗传多样性和遗传分化比较。绞股蓝自然居群的遗传多样性整体不高,He和I分别为0.18和0.27,其中四倍体的遗传多样性最高(He=0.31、I=0.47),其次为八倍体(He=0.28、I=0.41)、六倍体(He=0.20、I=0.32)和二倍体(He=0.15、I=0.24)。绞股蓝6个引物的PPL为58.33%,同样是四倍体类群最高(88.89%),二倍体最低(51.52%)。
由表 3可知,绞股蓝28个居群的He在0.01~0.34,最低的是RH和HN居群,He=0.01,最高的是NJ、ZJ和ZT,He依次为0.34、0.33和0.28;各居群的平均I在0.02~0.50。与遗传多样性指数类似,I最低和最高的居群也分别是RH、HN,以及NJ、ZJ和ZT。PPL从16.67%~100%,平均为58.33%。
| 表 3 不同倍性及居群绞股蓝的遗传多样性信息 Table 3Genetic diversity of G. pentaphyllun with different ploidys and populations |
利用6对引物组合分析426份绞股蓝样本分析遗传分化和各基因位点之间的基因流,结果见表 4,FST在0.423~0.858,平均值为0.673;Nm处于0.041~0.340,平均为0.142。
| 表 4 遗传分化系数FST和基因流Nm情况 Table 4Summary of FST and Nm for all loci |
AMOVA分析结果表明,在物种水平,居群间的遗传分化显著大于居群内部,遗传变异主要存在于居群之间,为78.86%,而居群内部的遗传变异仅为21.14%;当群组结构依据倍性不同划分为2组时,即二倍体集群和多倍体集群,组间变异不大,为13.73%,组内居群间遗传变异和居群内遗传变异分别为66.96%和19.32%,组内居群间变异程度也显著大于居群内部变异程度。
3.2 绞股蓝的遗传关系
通过分析绞股蓝28个居群的遗传距离和地理距离,并进行Mantel检验。结果表明,28个居群之间并不存在显著的线性关系,R为负值,且不显著(R=−0.090 2,P=0.87)。
将遗传距离数据在MEGAv6.0软件中构建NJ聚类树。28个绞股蓝居群可分为2大遗传分支:YJ、XC、JS、DL、ZJ、NJ组成一支;其他18个居群组成另一支,后者又由2个较为明显的亚支组成,其中YF、GZ、JR、YH、GY、ML、BS、HN、GP、LC、NN聚为1个亚支;剩下的ZT、WS、LH、ES、WN、RH、RJ、KM、TC、CZ、YN为第2个亚支。多倍体居群的关系较为密切(图 1)。
 | 图 1 基于遗传距离的NJ聚类树Fig.1 NJ Clustering tree based on genetic distance |
PCA分析表明(图 2),28个绞股蓝自然居群可分为3个区域。从结果中可以明显看出,6个多倍体居群中的4 个与二倍体居群之间有较远的距离,即ZJ、NJ、DL、JS。而其他24个居群可以大致分隔成2个区域:第1个区域包含1个六倍体云南盈江居群(YJ)和12个二倍体居群(XC、ZT、RH、WS、WN、YN、LH、ES、TC、KM、RJ、CZ);另一区域包含云南景洪南糯山的四倍体居群(NN)和10个二倍体居群(GY、HN、GP、BS、YH、YF、GZ、ML、JR、LC)。
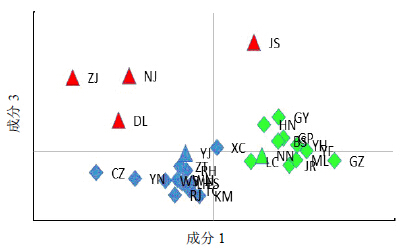 | 图 2 PCA图Fig.2 Result of PCA |
根据对28个绞股蓝自然居群的聚类分析,利用两个不同分组评价,确定了28个居群的最优分组为4组:当用Pritrchard等[16]的方法时,K=4的平均lnP(D)=−4 078.14;当采用ΔK统计的方法[17]时,当K=4,ΔK存在最大峰值。
图 3显示K=4时,绞股蓝的群体遗传结构。
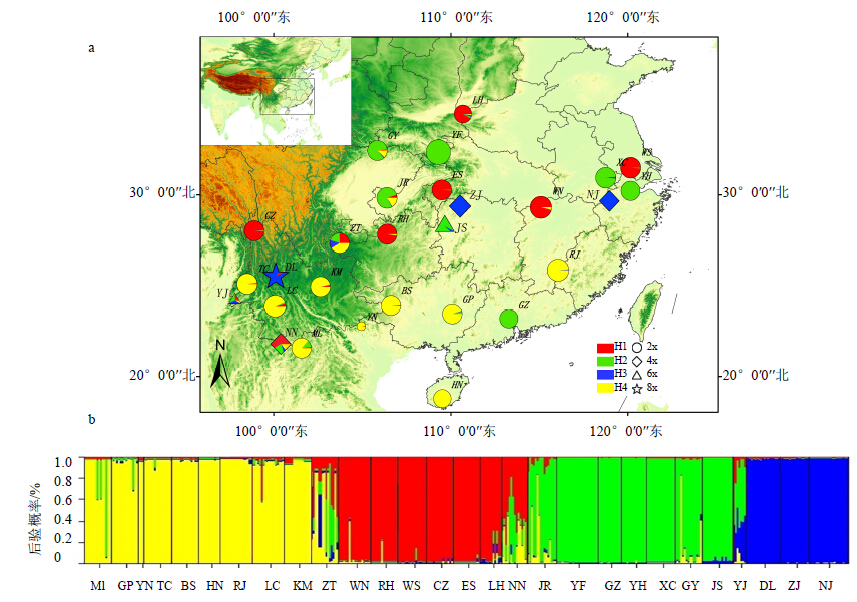 |
a-遗传结构地理分布图 b-K=4时STRUCTURE分组结果条形图 a-geographic distribution ranges of genetic structure; b- bar plots showing assignment probabilities from STRUCTURE analyses when K = 4 图 3 绞股蓝28个居群遗传结构Fig.3 Genetic structure of 28 populations of G. pentaphyllun |
28个居群可分为4组(H1~H4),按地理区域划分即为第1组为西南部居群,包括ML、GP、YN、TC、BS、HN、RJ、LC、KM、NN;第2组为贯穿分布范围的中部居群,包括ZT、WN、RH、WS、CZ、ES、LH;第3组为中东部居群,包括JR、YF、GZ、YH、XC、GY、JS;第4组为多倍体居群,包括YJ、DL、ZJ、NJ。该结果与PCA的分析结果相一致,多倍体居群更趋向于聚为一组,其他居群有较明显的地域结构。
4 讨论4.1 绞股蓝自然居群的遗传多样性和遗传分化
物种的遗传多样性是制约其进化的关键因素[18]。遗传多样性低的物种,被认为缺乏应对不断变化的生态环境的能力,从而缺少必要的进化灵活度,在长期的进化过程中处于被动。大多数珍稀濒危物种的遗传多样性偏低,是导致濒危的重要因素[19]。本研究基于6对SSR引物研究绞股蓝自然居群的遗传多样性,结果表明,绞股蓝具有较低的遗传多样性水平,PPL=58.33%,He=0.18,I=0.27。而Wang等[20]利用ISSR分子标记研究了绞股蓝14个居群的遗传多态性和遗传结构,结果表明绞股蓝居群具有高水平的遗传多样性(PPL=96.39%,I=0.407,He=0.262),而且居群间产生了显著的遗传分化。这种研究结果的差异可能与研究所使用的样本数量以及分子标记特性有关。绞股蓝是一种虫媒传粉的多年生草本植物,自然条件下主要进行克隆繁殖,长期的无性繁殖必然导致居群内部个体之间的遗传差异降低,而克隆(居群)之间的遗传差异增加。本研究的AMOVA遗传变异分析结果进一步证明组内居群间变异程度显著大于居群内部变异程度,说明绞股蓝的遗传变异主要存在于居群之间。将28个绞股蓝居群按倍性划分为4组,进行遗传多样性和遗传分化比较,结果表明,遗传多样性由高到低依次为四倍体、八倍体、六倍体、二倍体。
绞股蓝426份样本的平均FST值为0.673(>0.25),说明居群之间有较大的遗传分化;由FST值估算出的基因流指数显示绞股蓝自然居群之间Nm水平较低,约为0.142(<l),说明基因流不足以抵制居群内部的遗传漂变,从而引起了居群分化。多数研究表明,小居群往往会经历较强的遗传漂变,而且长期的居群隔离会使遗传漂变的作用加剧,进而降低居群内的多样性水平,促进居群间的遗传分化[21]。
4.2 绞股蓝自然居群的遗传关系和遗传结构
遗传距离反映了所研究居群的系统进化关系,常用以描述居群的遗传结构及居群间的差异。一般认为居群分化时间越短,遗传距离就越小[22]。本研究中,28个绞股蓝自然居群,遗传距离最大的是GZ和ZJ,Nei’s遗传距离高达2.648。另外,Mantel检验显示绞股蓝自然居群遗传距离和地理距离不存在显著的相关性(R=−0.090 2,P=0.87),说明居群的遗传分化与地理距离无关,推测绞股蓝自然居群的分化可能是因为其繁殖特性、地理隔离与人类活动综合作用的结果。近年来由于大量的人为开发和利用,致使绞股蓝自然植物资源逐渐变的稀少,加之绞股蓝适宜阴湿温和的气候,其生活环境多在山涧、林下、小溪边等荫蔽处,居群大量呈现片段化分布状态,因此导致了明显的居群遗传分化。生境片段化不仅影响生态系统的种类组成、数量结构、生态过程以及非生物因素,同时也会对物种的遗传结构产生较大的影响[23]。
一个物种或群体的进化潜力,在很大程度上取决于它的居群遗传结构。确定一个物种的居群遗传结构,是了解其生物学属性,探讨物种进化过程和机制的重要一步[24]。用遗传距离数据构建的NJ聚类树显示,绞股蓝28个居群可分为2个大支:二倍体居群WN和多倍体的ZJ、DL、JS分为1支,其他24个居群组成另一个由3个亚支组成的分支;另外,PCA的结果表明,多数多倍体居群的遗传关系与二倍体较远;而Structure结果也将多倍体居群与二倍体居群划分开,说明两者间存在较为明显的遗传差异。
本研究根据Structure的分析结果表明,28个绞股蓝居群存在最可能的遗传结构时,可以分为4个群组。而在所有居群中,有3个居群较为特殊,即二倍体的ZT居群、四倍体的NN居群和六倍体的YJ居群,均有较复杂的遗传结构以及较高水平的遗传多样性,推测可能是较为原始的祖先居群或者是居群扩散的交汇中心。而JR、ZT居群遗传结构较复杂,遗传多样性较高,可能是绞股蓝进化分支交汇于此的结果。类似的结果在其他研究中也有所报导。例如王翀[25]利用cpDNA rp120-rpsl2片段构建绞股蓝属植物单倍型网络进化关系图,并结合该属植物自然地理分布情况,推测中国云南省为绞股蓝属植物的起源中心,历史上曾经沿着南北两条线路向我国东部地区扩散。此外,董文华[26]利用叶绿体DNA trnL-trnF序列对中国云南省绞股蓝属植物的居群进化历史进行研究,结果表明由于受到过去冰期气候波动的影响较小,横断山河谷低海拔地区可能为绞股蓝属植物提供了冰期避难所,成为该属植物的起源和演化中心。
对于绞股蓝二倍体与多倍体的分布格局,多倍体多是倾向于聚在一起而非以地理区域相聚,推测来自不同地点的绞股蓝多倍体可能具有相似的起源方式。蒋玲艳[27]通过对绞股蓝核基因ITS序列的研究揭示了同源多倍化在绞股蓝多倍体形成和进化过程中占主要作用。绞股蓝一些多倍体居群可能起源于与其地理分布较近的二倍体居群,然后经过一定的时间,或者取代其二倍体亲本,或者与其二倍体亲本并存而居住地分化,占领新的生态位,形成地理的重新分布。
二倍体受近期环境影响的波动较大,另外受到奠基者效应和瓶颈效应的影响,导致遗传多样性水平的降低;而多倍体的遗传多样性普遍高于二倍体,表明绞股蓝在多倍化过程当中,趋向于固定一些更适应特殊生境的基因型,而不同倍性绞股蓝的特有等位基因比率也是多倍体明显大于二倍体,也能很好的证明这一点。
群体遗传多样性和遗传结构的研究一直是生物多样性保护的一个重要内容,优先保护多样性水平高的居群,可最大限度地保护物种进化的适应性,而对于遗传多样性较低的居群,应保护其免受进化因素影响而面临濒危。绞股蓝作为一种药用植物,药用价值高,人类一方面对其野生种群的采挖日益严重,另一方面建立了越来越多的栽培基地,因此,对于绞股蓝野生居群的保护,应同时采用原地保护和迁地保护,停止对野生居群的采挖,保护其生存环境,另外应防止栽培种对野生种群的污染。
本研究通过对绞股蓝遗传多样性和遗传分化以及遗传关系和结构的研究,表明绞股蓝自然居群的遗传多样性水平较低,居群的遗传变异主要存在于居群间,基因交流受到限制,推测存在一定的隔离机制。现今绞股蓝二倍体与多倍体的分布格局,其亲缘关系与地理分布不一致,可能的原因为绞股蓝在进化过程中的多倍化事件为一种自发现象且多倍化方式相似。该研究为更好地进行绞股蓝植物资源的开发利用、保护和评价提供了科学依据与理论基础。根据本研究结果,建议对绞股蓝遗传多样性水平较高的居群进行原地保护(如多倍体居群和二倍体ZT、WN居群等),同时对一些包含特有基因型的居群(例如JR、LC、RJ、KM等)进行原地和迁地重点保护。
| [1] | 路安民, 陈书坤. 中国植物志 [M]. 北京: 科学出版社, 1986. |
| [2] | 陈书坤. 绞股蓝属植物的分类系统和分布 [J]. 植物分类学报, 1995, 33(4): 403-410. |
| [3] | 史琳, 赵虹, 张璐雅, 等. 绞股蓝药理作用的研究进展 [J]. 药物评价研究, 2011, 34(2): 125-129. |
| [4] | 卢汝梅, 潘立卫, 韦建华, 等. 绞股蓝化学成分的研究 [J]. 中草药, 2014, 45(19): 2757-2761. |
| [5] | 李忠虎, 刘占林, 赵鹏, 等. 绞股蓝属植物系统进化研究进展述评 [J]. 西北植物学报, 2012, 32(10): 2133-2138. |
| [6] | 孙稚颖, 姚辉. 不同产地菘蓝ISSR分析与鉴定 [J]. 中草药, 2014, 45(22): 3323-3326. |
| [7] | 葛淑俊, 孟义江, 李广敏, 等. 我国药用植物遗传多样性研究进展 [J]. 中草药, 2006, 37(10): 1584-1589. |
| [8] | 李忠虎, 刘晓东, 王晓琦, 等. 党参微卫星引物筛选及群体遗传多样性研究 [J]. 中草药, 2013, 44(2): 210-214. |
| [9] | 邓科君, 张勇, 熊丙全, 等. 药用植物丹参EST-SSR标记的鉴定 [J]. 药学学报, 2009, 44(10): 1165-1172. |
| [10] | 王晓丽, 常楚瑞, 宋聚先, 等. 天麻不同种质的AFLP和SSR分析 [J]. 中华中医药杂志, 2012, 27(3): 555-558. |
| [11] | 杨广顺, 王义, 孙春玉, 等. 人参遗传多样性的SSR分析 [J]. 安徽农业科学, 2010, 38(13): 6660-6662. |
| [12] | 吴天姝, 梁翠, 李宏博, 等. 人参单一基因微卫星标记的分析 [J]. 中国农业科学, 2011, 44(13): 2650-2660. |
| [13] | 陈国庆. 番红花EST资源的SSR信息分析 [J]. 广西植物, 2011, 31(1): 43-46. |
| [14] | 战晴晴, 隋春, 魏建和, 等. 利用ISSR和SSR分子标记构建北柴胡遗传图谱 [J]. 药学学报, 2010, 45(4): 517-523. |
| [15] | Liao H, Zhao Y, Zhou Y, et al. Micorsatellite markers in the traditional Chinese medical herb Gynostemma pentaphyllum (Cucurbitaceae) [J]. Am J Bot, 2011, 98(3): 61-63. |
| [16] | Pritchard J K, Stephens M, Donnelly P. Inference of population structure using multilocus genetype data [J]. Genetics, 2000, 155(2): 945-959. |
| [17] | Evanno G, Regnaut S, Goudet J. Detecting the number of clusters of individuals using the software structure: a simulation study [J]. Mol Ecol, 2005, 14(8): 2611-2620. |
| [18] | 王钦. 青藏高原东缘橐吾属三种植物的遗传多样性 [D]. 兰州: 西北师范大学, 2003. |
| [19] | 李巧明. 龙脑香科两种濒危植物的保护遗传学研究 [D]. 昆明: 中国科学院昆明植物研究所, 2002. |
| [20] | Wang C, Zhang H, Qian Z Q, et al. Genetic differentiation in endangered Gynostemma pentaphyllum (THunb.) Makino based on ISSR polymorphism and its implications for conservation [J]. Biochem Syst Ecol, 2008, 36(9): 699-705. |
| [21] | Ellstrand N C, Elam D R. Population genetic consequences of small Population size: implieations for plant conservation [J]. Ann Rev Eeol Syst, 1993(24): 217-242. |
| [22] | 郝丽娟. 能源植物黄连木遗传多样性的SSR及ISSR分析 [D]. 北京: 北京林业大学, 2011. |
| [23] | 陈小勇. 生境片断化对植物种群遗传结构的影响及植物遗传多样性保护 [J]. 生态学报, 2000(5): 884-892. |
| [24] | Loveless M D, Hamriek J L. Ecological determinants of genetic structure in plant populations [J]. Ann Rev Eeol Syst, 1984(15): 65-95. |
| [25] | 王翀. 绞股蓝属遗传多样性与亲缘地理学研究 [D]. 西安: 西北大学, 2008. |
| [26] | 董文华. 云南省绞股蓝属植物地理遗传结构及八倍体绞股蓝起源的初步研究 [D]. 西安: 西北大学, 2011. |
| [27] | 蒋玲艳. 中国不同地区绞股蓝ITS序列分析 [J]. 中草药. 2009, 40(7): 1123-1127. |
 2015, Vol. 46
2015, Vol. 46


