2. 中国中医科学院 中药资源中心, 北京 100700;
3. 道地药材国家重点实验室, 北京 100700;
4. 武汉轻工大学, 湖北 武汉 430023
2. National Resource Center of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China;
3. State Key Laboratory of Daodi Herbs, National Resource Center of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China;
4. Wuhan Polytechnic University, Wuhan 430023, China
新疆紫草Arnebia euchroma (Royle) Johnst又名软紫草,为药用紫草的主要来源之一和道地药材[1],生长在海拔2 100~3 300 m的新疆高山向阳坡[2]。其主要成分为紫草素类化合物、酚酸类、多糖类、有机酸类、紫草呋喃类等化合物[3, 4],具有止血、杀菌抗炎、抗氧化、镇静、增强机体抵抗力等药理活性[5, 6, 7],在医药行业广泛应用,并作为天然染料和添加剂广泛应用于工业生产[8, 9]。
由于新疆紫草分布区域狭窄,全球变暖,其生态环境恶化,加之采收的不合理,新疆紫草野生种群处于濒危状态,属于国家重点保护野生植物[10]。生物工程培养新疆紫草获取次生代谢产物[11]是目前满足日益庞大的紫草素类化合物的工业和社会需求的主要手段[12],也是新疆紫草目前研究的热点[13, 14]。
但是新疆紫草作为中药紫草的道地药材,是环境型和基因型共同作用的产物,特定自然条件和生态环境决定了其化学成分的独特性[15]。新疆紫草分布在高寒山地,低温是其主要环境胁迫因子之一,也是其化学成分形成的主要因素[16, 17]。此外,高寒地带植物具有的耐寒性也是目前生物学领域研究的热门[18, 19, 20],低温胁迫对于植物生长、发育影响的研究,对于在生产上选育抗冻品种[21, 22, 23]也具有非常重要的意义。
本研究拟给予新疆紫草悬浮细胞远低于生长温度的低温刺激,考察低温胁迫下的新疆紫草组织培养与正常组培温度下的次生代谢物的差异,尝试研究低温对于新疆紫草化学成分的影响,对于揭示新疆紫草道地性形成的机制提供直接的实验支持。
1 材料与仪器高效液相色谱仪:沃特世科技(上海)有限公司Waters Separations Module 2695型,检测器:沃特世科技(上海)有限公司Waters 2996 Photodiode Array Detector,工作站为沃特世科技(上海)有限公司Waters Millennium32;色谱柱:安捷伦科技(中国)有限公司Agellient TC-C18(250 mm×4.6 mm,5 μm);电子精密天平:赛多利斯科学仪器(北京)有限公司Sartorius BS 2202S;人工培养箱:加拿大Conviron公司(康威恩)Conviron Adaptis CMP6010;摇床:太仓市实验设备厂TCYQ超大型摇床;超净工作台:苏州安泰空气技术有限公司SW-CJ-2FD型双人单面净化工作台;电热干燥箱:上海-恒科仪器有限公司DHG-9145AZ;全自动高压灭菌锅:TOMY SS-325;分析型酸度计:JENWAY 3510;其他常规组培设备;超纯水仪:Milli-Q Advantage 超纯水系统;球磨机:Ratsch MM400。色谱纯甲醇、乙腈为Fisher Chemical公司产品。其他试剂如乙酸均为分析纯,以及培养基母液配制所需固体无机试剂均为国药集团化学试剂有限公司产品。对照品:迷迭香酸、紫草酸B、β,β′-二甲基丙烯酰紫草素购自中国食品药品检定研究院(质量分数均≥99.98%);乙酰紫草素购自上海同田生物科技;脱氧紫草素、异丁酰紫草素、异戊酰紫草素购自日本TCI化成株式会社,紫草呋喃A、紫草呋喃E的对照品由山东科学院分析测试中心制备,质量分数 均≥98%。新疆紫草Arnebia euchroma (Royle) Johnst愈伤组织由中国科学院植物研究所叶和春研究员提供并鉴定,并由本实验室保存并继代为悬浮细胞。
2 方法 2.1 材料培养在超净工作台内称取3 g性状良好的新疆紫草悬浮细胞接种于30 mL已高压灭菌的改良LS液体培养基(pH为5.8±0.2),置于摇床悬浮培养,转速120 r/min,培养温度25 ℃,暗培养,作为实验材料。
2.2 处理方法悬浮细胞生长至指数生长期的14 d,其他培养条件不变,在4 ℃低温培养24 h,然后25 ℃继续培养,作为低温胁迫实验组。对照组培养温度恒定为25 ℃。实验组和对照组在低温胁迫前取0 h的样品,并在低温胁迫24 h后的12、24、48、72、168 h 5个时间点分别取样。样品真空抽滤后置于电热干燥箱40 ℃干燥24 h至恒质量。样品使用球磨机震荡研磨后精密称取0.02 g置于2 mL离心管,加入1.5 mL甲醇,25 ℃超声60 min,静置,取上清液经0.45 μm滤膜滤过于液相样品瓶供高效液相进样。实验设3次重复。
2.3 色谱条件参照本实验室建立的新疆紫草次生代谢产物HPLC方法[13],选用安捷伦TC-C18(250 mm×4.6 mm, 5 μm)色谱柱,柱温30 ℃,体积流量1.0 mL/min,进样量10 μL,检测波长280 nm,以乙腈-0.1%乙酸水溶液为流动相进行梯度洗脱,见表 1。
| 表 1 流动相梯度洗脱程序 Table 1Gradient elution procedure of mobile phase |
使用万分之一天平分别精确称量约1 mg的迷迭香酸、紫草酸B、紫草呋喃A、紫草呋喃E、乙酰紫草素、脱氧紫草素、异丁酰紫草素、β,β′-二甲基丙烯酰紫草素和异戊酰紫草素对照品于离心管中,使用移液器精密加入甲醇至质量浓度为1 mg/L,超声至完全溶解。分别取对照品母液1 μL定容至100 mL棕色量瓶,即获得1.0 pg/mL的对照品溶液。对照品标准曲线及线性范围见表 2。
| 表 2 9种新疆紫草对照品标准曲线及线性范围 Table 2Standard curve and linear range of nine reference substances in A. euchroma |
使用Microsoft Excel 2010和IBM SPSS 20.0进行数据分析。
3 结果与分析在给予低温胁迫前,低温胁迫组(DW)和对照组(CK)取共同的0 h样品作为起始对照,在4 ℃低温胁迫24 h后, DW和CK组分别检测12、24、48、72、168 h新疆紫草悬浮细胞酚酸类化合物:迷迭香酸、紫草酸B,紫草呋喃类化合物:紫草呋喃A、紫草呋喃E,紫草素类化合物:乙酰紫草素、脱氧紫草素、异丁酰紫草素、β,β′-二甲基丙烯酰紫草素、异戊酰紫草素,检测所得峰值换算为质量分数见表 3。
| 表 3 新疆紫草9种次生代谢物的质量分数 Table 3Contents of nine secondary metabolites in A. euchroma |
设定9个化合物和紫草素类化合物总量为考察组,0、12、24、48、72、168 h每个时间点观测DW组和CK组,合计12个观测数据,做方差分析,结果显示P<0.05,说明在显著水平α=0.05时6个不同时间点低温胁迫对新疆紫草9种次生代谢物紫草素类化合物总量影响均极显著。
3.1 低温胁迫对新疆紫草酚酸类化合物的影响低温胁迫后的新疆紫草酚酸类化合物在72 h以内的量都在0 h的水平以上,168 h CK组和DW组值都降低到了0 h 水平以下,同时CK组此时的量较DW组高。见图 1。12 h DW组的迷迭香酸和紫草酸B的量陡增,从0.009 26%升高到0.078 96%,增幅超过750%,但是未给予低温胁迫的CK组只有小幅增长。24 h时DW组增加放缓,迷迭香酸基本停滞增长,达到最大值,紫草酸B有10%的增幅,但是CK组在此时陡增近400%,2个化合物均达到峰值。48 h时DW组紫草酸B达到峰值,此后2种酚酸类化合物量持续降低。与DW组不同的是,CK组在72 h迷迭香酸和紫草酸B量相对于48 h分别有30%和150%的增长,之后回落。低温胁迫后的新疆紫草2种酚酸类化合物量峰值是CK组的1.5和1.7倍,同属酚酸类化合物,但是迷迭香酸的量在6个时间点分别是紫草酸B的75、16、12、10、5、54</ span>倍。酚酸类化合物在低温胁迫后的量变化呈A型,CK组的量变化呈M型。
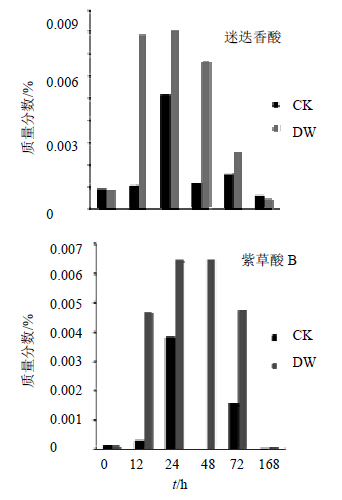 | 图 1 低温胁迫后新疆紫草酚酸类化合物不同时间点的量变化Fig.1 Content changes of phenolic compounds in A.euchroma at different time points after low temperature stress |
低温胁迫后新疆紫草紫草呋喃类化合物的变化呈M型,紫草呋喃A在12 h快速增长并在24 h达到峰值,然后在48 h小幅回落,72 h再次增长后大幅降低,168 h达到低温胁迫后紫草呋喃类化合物的最低值,紫草呋喃E在12 h达到最大值,从24 h开始持续回落直到48 h时到达一个较低的值。CK组也呈同样趋势,但是其各时间点的量均不到DW组的50%。168 h时CK组的紫草呋喃都降低到了0 h水平以下,而DW都在0 h水平以上,其中紫草呋喃A量是CK组的2.75倍,是0 h时的1.75倍,紫草呋喃E的量是CK组的2.69倍,是0 h时的1.68倍。见图 2。48 h紫草呋喃A的量和紫草呋喃E的量分别是最大值的69%和65%,是0 h时的2.84和2.75倍,是168 h时的1.61和1.63倍。CK组紫草呋喃A和紫草呋喃E量最大值与最小值分别相差174%和170%,DW组的2种紫草呋喃最大值与最小值分别相差311%和526%。DW组各个时间点紫草呋喃A量是紫草呋喃E的2.6、2.5、2.7、2.6、2.7、2.7倍,均值为2.58。
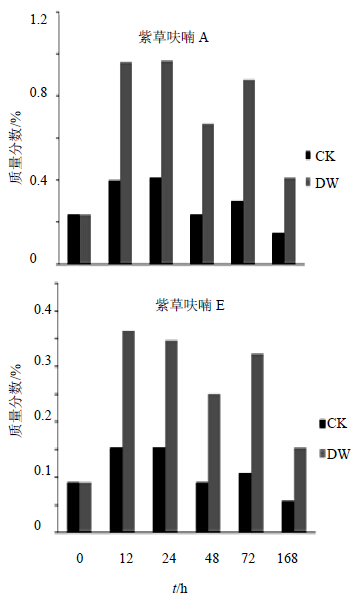 | 图 2 低温胁迫后新疆紫草紫草呋喃类化合物不同时间点的量变化Fig.2 Content changes of furan compounds in A. euchroma at different time points after low temperature stress |
低温胁迫后的不同紫草素类化合物的量变化不同。乙酰紫草素从12 h开始,DW和CK组的量一直大于0 h,变化趋势近似M型。12 h时DW组的第一个峰尖,增幅为116.8%,24 h时CK组处于峰尖而DW组降入峰谷。CK组在24、48 h时乙酰紫草素量明显高于< span lang="EN-US" style='letter-spacing:-.2pt' xml:lang="EN-US">DW组,在72 h时CK组和DW组的乙酰紫草素量大幅增加,分别有31.4%和143%的增幅,但是此时DW组的量明显高于CK组,之后的DW和CK组均降低,DW组降幅较大,约为30%,168 h时乙酰紫草素量比CK组高15.2%。见图 3。
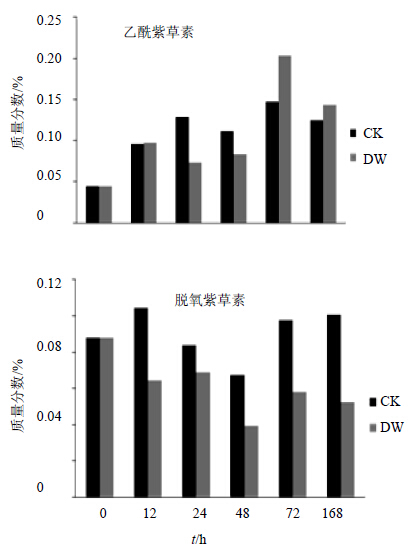 | 图 3 低温胁迫后新疆紫草乙酰紫草素、脱氧紫草素不同时间点的量变化Fig.3 Content changes of AS and DS in A. euchroma at different time points after low temperature stress |
脱氧紫草素从12 h开始,DW组的量一直低于0 h,变化趋势近似波浪型,0、24、72 h在浪尖,12 h和48 h处于浪底,降幅分别为26.7%和42.62%,在24 h时候,DW组有一个6.73%的脱氧紫草素量增加。CK组变化趋势近似N型,12 h和168 h量较左右时间点高,48 h是量的最低点,相对于12 h降低35.13%,且24 h和48 h 2个时间点的量均低于0 h。CK组和DW组在48~72 h脱氧紫草素均有最大幅度的量增加,分别为76.74%和46.74%。到达72 h后,CK组向168 h有微弱的增幅,而DW组则缓慢回落。见图 3。
异丁酰紫草素量的变化CK组呈N型,DW组近似M型。CK组在12 h异丁酰紫草素有一个大的增加,增幅113.4%,然后持续降低到48 h,降幅在25.76%左右,72 h时激增94.93%后缓慢增长到168 h,获得量的最大值。DW组的24 h和72 h贡献了异丁酰紫草素量变化的2个峰尖,24 h之前共增加63.08%,同样在48 h进入一个谷底,降幅约为30%,而且于CK组类似的是72 h前是一个明显的增值,增加了126.5%。DW组和CK组异丁酰紫草素量在72 h后向2个方向发展:DW组此时是异丁酰紫草素量降低的过程,降低15.67%,而CK组则增加了6.48%异丁酰紫草素。见图 4。
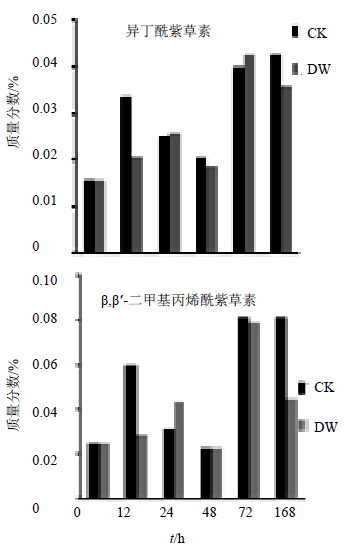 | 图 4 低温胁迫后新疆紫草异丁酰紫草素、β,β′-二甲基丙烯酰紫草素不同时间点的量变化Fig.4 Content changes of IBS and DAS at different time points after low temperature stress |
β,β′-二甲基丙烯酰紫草素的变化趋势与异丁酰紫草素的相似:CK组整体呈N型,DW组近似M型。CK组在12 h和72 h有非常明显的量增加,增幅分别为136.68%和254.96%。12 h后的CK组量降低非常明显,幅度很大,连续2次分别降低47.59%和26.73%,合计降低约74.32%。72 h后CK组β,β′-二甲基丙烯酰紫草素量降幅过小,可以忽略不计。DW组开始是一个缓慢的量增加,24 h前是一个较大的增加,增幅50.94%,此时是唯一一个β,β′-二甲基丙烯酰紫草素量较CK组高的时间点,高出38.21%。24 h后快速降低47.64%至谷底,然后是一个247.1%的增长,在72 h时达到了峰值之后快速降低,降幅达43.29%。见图 4。
异戊紫草素的CK组和DW组的变化均呈N型,在12 h前是第一个增长,增幅分别为75.77%和47.28%,之后异戊紫草素的量逐渐降低,48 h时到达谷底,分别累计降低29.57%、22.89%。72前CK组和DW组各自大幅增加98.63%、157.97%,72 h之后的增长放缓,CK组和DW组在168 h达到异戊紫草素量的最大值,分别有11.49%和18.42%的增加。CK组12、24、48 h 3个时间点的量比DW组量高,分别高出19.39%、27.44%、9%,但是72、168 h的量反而是DW组较CK组高,分别高出19.15%和26.55%。见图 5。
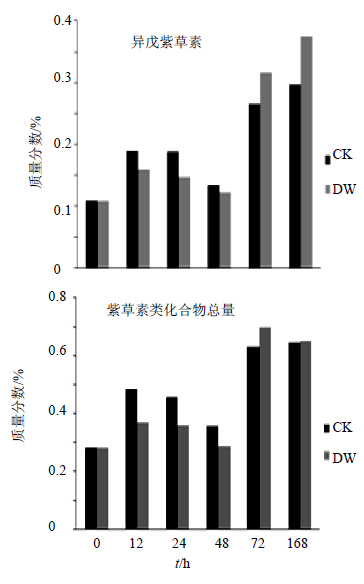 | 图 5 低温胁迫后异戊紫草素和紫草素类化合物总量不同时间点的变化Fig.5 Content changes of IVS and total shikonin compounds at different time points after low temperature stress |
合计乙酰紫草素、脱氧紫草素、异丁酰紫草素、β,β′-二甲基丙烯酰紫草素和异戊酰紫草素5种化合物的量,得到DW组新疆紫草紫草素类化合物总量不同时间点的变化趋势近似于M型,12 h和72 h是2个峰尖,之前分别有31.38%和143.36%的增幅,并在48 h降入峰谷,累计下降22.42%,最后168 h是一个6.83%的降幅。见图 5。CK组呈明显的N型,与DW组相同的是12 h前也是第一个增幅,增加71.62%,然后持续下降26.27%到48 h低谷,之后一个77.18%的大增幅到72 h,但是168 h前CK组是一个微弱的量增加,而DW组则明显下降。与异戊紫草素相似:12、24、48 h 3个时间点的CK组量比DW组量高,分别高出30.64%、27.46%、24.14%,72、168 h则是DW组较高,其中72 h时高出10.63%,而168 h时只有不到1%的增加。
低温胁迫后的新疆紫草次生代谢发生了很多变化,不同类的化学成分变化不一致,同类的化学成分也存在一定的差异,其中酚酸类和紫草呋喃类的化合物胁迫之后次生代谢物在各时间点都较对照组量高,均在168 h前出现最高量,而且无论DW组和CK组,次生代谢物随时间的变化均近似M型。迷迭香酸的最大量出现在DW组的24 h,紫草酸B的最大量出现在DW组的48 h,且迷迭香酸量最大值是紫草酸B的12.46倍。紫草呋喃A和紫草呋喃E分别在24 h和12 h出现量最大值,两值相差151.68%。对于5个紫草素类化合物,DW组量变化乙酰紫草素、异丁酰紫草素、β,β′-二甲基丙烯酰紫草素近似M型,异戊酰紫草素近似N型,脱氧紫草素则呈波浪型。CK组的紫草素类化合物只有乙酰紫草素近似M型,其余均呈N型。乙酰紫草素的最大值出现在DW组的72 h,脱氧紫草素最大值出现在CK组的12 h,异丁酰紫草素在DW组的72 h,β,β′-二甲基丙烯酰紫草素最大值在CK组的72 h,异戊酰紫草素在DW组的168 h达到最大量。就整体而言,5种紫草素类化合物量变化在DW组内呈M型,在CK组内呈N型,最大值出现在DW组的72 h。
4 讨论植物次生代谢和防御反应之间关系密切,植物不仅会对病原体、昆虫和草食动物的攻击或其他生物、非生物胁迫产生响应,对于诱导子(各种来源的小分子)也会有相同的响应[24]。低浓度诱导子在活细胞中能够引发新的代谢,增加特定次生代谢物的产量,可以有效地提高具有一定价值的次生代谢物的产量[25, 26]。
低温属于非生物诱导子中的物理诱导子,是主要的环境胁迫因子之一。低温会降低光合速率和叶绿素量以及呼吸作用,长时间的低温胁迫会显著提高膜脂过氧化物和超氧阴离子等的量,但是会抑制超氧化物歧化酶和过氧化物酶活性,进而对植物初级和次级代谢造成影响[27]。Hilda等[28]在研究中发现低温胁迫会促进花青素的积累,认为花青素量的增加是植物应对低温胁迫的一种表现。在低温胁迫下,一些低温抗性蛋白基因会被迫表达,产生和积累小分子抗性物质并活化抗氧化系统,提高植物的抗寒性,缓解低温胁迫造成的机械损伤,保护机体不受生理伤害[29, 30]。张芳转等[31]发现低温胁迫紫草科植物新疆紫草A. euchroma和假狼紫草Nonea capsica (Willd.) G. Don,会促使其积累r-亚麻酸。罗丹等研究结果显示,番茄幼苗叶片中脯氨酸的量及吡咯啉-5-羧酸合成酶、鸟氨酸转移酶的活性会随着低温胁迫时间的延长或温度的降低均呈现出先升高后降低的趋势,这与罗丹和Ceron-Garcia A等的研究结果一致[32, 33]。
本研究考察了低温胁迫后的不同生长时间点新疆紫草次生代谢物的量变化,发现酚酸、紫草呋喃类化合物和草素类化合物对于低温胁迫的反应很敏感,而且低温胁迫极大的促进了这三类成分的生成和积累,对于指导实际生产具有显著的意义。
此外根据以药效成分和环境因子为出发点道地药材的形成的“模型模式”[34],在新疆紫草质量评价体系已建立[35]而且其主要次生代谢物相对明确的的情况下,低温这一新疆紫草产地所特异的一个环境因子对于新疆紫草道地性的形成,尤其在主要化学成分,如紫草素类化合物、紫草呋喃类化合物、酚酸类化合物的产生和积累具有非常显著的相关性。
这种道地产区以外,单一给予道地药材产地所特有的环境因子,对指标性化学成分所造成显著差异,揭示出环境因子对于道地药材形成具有不可忽视的作用,也从另一个侧面提示道地药材形成机制的复杂性。但是,同样可以得出另外一个结论,模拟道地药材的生境,提供相似的环境因子,对于道地性形成的机制研究有很大的帮助,对于道地药材和产地的保护具有重要意义。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 初雨, 潘晓玲. 新疆药用资源植物及其开发利用现状 [J]. 中国野生植物资源, 2001, 20(1): 21-23. |
| [3] | 徐新刚, 王宝珍, 孙志蓉, 等. 新疆紫草的主要化学成分 [J]. 吉林大学学报: 理学版, 2010, 48(2): 319-322. |
| [4] | 郭鑫, 李治建, 谢奇, 等. 新疆紫草化学成分的初步研究 [J]. 时珍国医国药, 2012, 23(4): 815. |
| [5] | Kashiwada Y, Bastow K F, Lee K. Novel lignan derivatives as selective inhibitors of DNA topoisomerase II [J]. Bioorg Med Chem Lett, 1995, 5(4): 905-908. |
| [6] | Hu Y, Jiang Z, Leung K S, et al. Simultaneous determination of naphthoquinone derivatives in Boraginaceous herbs by high-performance liquid chromatography [J]. Anal Chim Acta, 2006, 577(1): 26-31. |
| [7] | Cheng Y W, Chang C Y, Lin K L. Shikonin derivatives inhibited LPS-induced NOS in RAW264. 7 cells via down regulation of MAPK/NF-B signaling [J]. J Ethnopharmacol, 2008, 120(2): 264-271. |
| [8] | 李晓瑾, 谭秀芳, 马媛, 等. 药用植物紫草的研究进展 [J]. 新疆师范大学学报, 2005, 24(4): 69-73. |
| [9] | 任贻军, 张宏琳. 新疆紫草的药理作用 [J]. 中国民族民间医药, 2009(1): 13-14. |
| [10] | 计巧灵. 新疆紫草无性繁殖体系的建立 [J]. 中草药, 2003, 32(11): 1041-1044. |
| [11] | Tabata M, Mizukami H, Hiraoka N. Pigment formation in callus cultures of Lithmpemtum erythrorhison [J]. Phytochemistry, 1974, 13: 927-932. |
| [12] | 李国凤, 伍正容, 叶和春, 等. 离体培养的新疆紫草萘醌色素的诱导形成 [J]. 植物学通报, 1988, 5(2): 84-86. |
| [13] | 王升, 谢腾, 郭兰萍, 等. 两种新疆紫草细胞系表型分析和悬浮培养生长及紫草素类化合物积累的动力学研究 [J]. 中国中药杂志, 2013, 28(7): 74-80. |
| [14] | 庞克坚, 王玉春, 王晓东. 新疆紫草种子包衣育苗技术研究 [J]. 中草药, 2005, 36(11): 1713-1715. |
| [15] | 肖小河, 陈士林. 论道地药材的系统研究 [J]. 四川中草药研究, 1991, 5(2/3): 15-18. |
| [16] | 黄璐琦, 张瑞贤. "道地药材"的生物学探讨 [J]. 中国药学杂志, 1997, 32(9): 563-568. |
| [17] | 黄璐琦, 王康才. 药用植物生理生态学 [M]. 北京: 中国中医药出版社, 2012. |
| [18] | 张芳转, 周晶, 陈光辉, 等. 低温对2种紫草科植物Δ6-脂肪酸脱氢酶基因表达的影响 [J]. 西北农业学报, 2011, 20(8): 101-105. |
| [19] | TeixeiraM C, Carvalho I S, Brodelius M. Omega-3 fatty acid desaturase genes isolated from purslane (Portulaca oleracea L.) expression in different tissues and response to cold and wound stress [J]. J Agric Food Chem, 2010, 58: 1870-1877. |
| [20] | Kodama H, Horiguchi B, Nishiuchi T, et al. Fatty acid de saturation during chilling acclimation is one of the factor involved in conferring low-temperature tolerance to young tobacco leaves [J]. Plant Physiol, 1995, 107(6): 1177-1185. |
| [21] | 韩龙植, 张媛媛, 乔永利, 等. 水稻低温发芽势的遗传及数量性状基因座分析 [J]. 遗传学报, 2006, 33(11): 998-1006. |
| [22] | Somerville C. Direct tests of the role of membane lipid composition in low-temperature-induced photoinhibition and chilling sensitivity in plants and cyanobaeteria [J]. P Natl Acad Sci USA, 1995, 92(21): 6215-6218. |
| [23] | 岳海, 李国华, 李国伟, 等. 澳洲坚果不同品种耐寒特性的研究 [J]. 园艺学报, 2010, 37(1): 31-38. |
| [24] | Namdeo A G. Plant cell elicitation for production of secondary metabolites: A Review [J]. Phcog Rev, 2007, 1(12): 69-79. |
| [25] | Almagro F L, Sabater-Jara A B, Belchí-Navarro S, et al. Effect of UV light on secondary metabolite biosynthesis in plant cell cultures elicited with cyclodextrins and methyl jasmonate [J]. Plants Environ, 2011(2): 115-136. |
| [26] | Boller T, Meins F. Genes Involved in Plant Defense [M]. New York: Springer-Verlag, 1992. |
| [27] | Thomashow M F. Plant cold accliamtion: Freezing tolerance genes and regulatory mechanisms [J]. Ann Rev Plant Physiol Plant Mol Biol, 1999, 50(22): 571-599. |
| [28] | Hilda P, Sierra-de-Grado R, Vigliocco A, et al. Cold and water stresses produce changes in endogenous jasmonates in two populations of Pinus pinaster Ait [J]. Plant Growth Regulation, 2007, 52(2): 111-116. |
| [29] | Weiser C J. Cold resistance and injury in woody plants [J]. Science, 1970, 169(19): 1269-1273. |
| [30] | Knight M R, Knight H. Low-temperature perception leading to gene expression and cold tolerance in higher plants [J]. New Phytolog, 2012, 195(4): 737-751. |
| [31] | 张芳转, 周晶, 陈光辉, 等. 低温对2种紫草科植物Δ6-脂肪酸脱氢酶基因表达的影响 [J]. 西北农业学报, 2011, 20(8): 101-105. |
| [32] | 罗丹, 张喜春, 田硕. 低温胁迫对番茄幼苗脯氨酸积累及其代谢关键酶活性的影响 [J]. 中国农学通报, 2013, 29(16): 90-95. |
| [33] | Ceron-Garcia A, Gonzalez-Aguilar G A, Vargas-Arispuro I, et al. Oligoglucans as elicitors of an enzymatic antioxidant system in Zucchini Squash (Cucurbita pepo L.) seedlings at low temperature [J]. Am J Agric Biol Sci, 2010, 6(1): 52-60. |
| [34] | 郭兰萍, 黄璐琦, 蒋有绪, 等. 2种不同模式中药适宜性区划的比较研究 [J]. 中国中药杂志, 2003, 33(6): 718-721. |
| [35] | 王升, 李璇, 郭兰萍, 等. 紫草素及其衍生物合成相关基因及信号传导研究进展 [J]. 中草药, 2012, 43(6): 1219-1225. |
 2015, Vol. 46
2015, Vol. 46


